14. B E Z W O D N I K I I H A L O G E N K I K W A S O W E
Aleksander Kołodziejczyk grudzień 2007
H A L O G E N K I K W A S O W E
Halogenki kwasowe są pochodnymi kwasów karboksylowych, w których funkcja hydroksylowa została zastąpiona przez halogen.
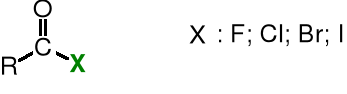
Występowanie
Halogenki kwasowe nie występują w stanie naturalnym, ponieważ są bardzo reaktywne. Wszystkie zostały otrzymywane syntetycznie. W praktyce laboratoryjnej i w przemyśle znalazły zastosowanie głównie chlorki kwasowe.
Nomenklatura
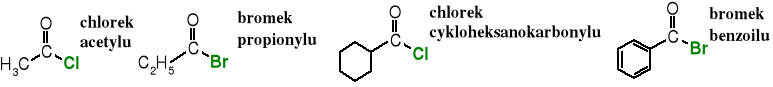
Nazwę halogenków kwasowych tworzy się przez dodanie do nazwy halogenku (fluorku, chlorku, bromku lub jodku) nazwę reszty acylowej, np. chlorek acetylu.
Otrzymywanie
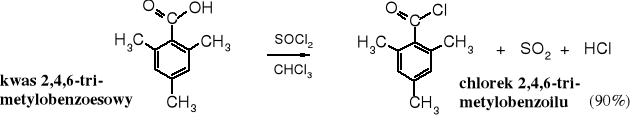
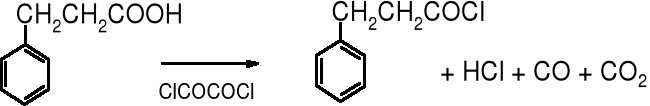
Halogenki kwasowe otrzymuje się z kwasów karboksylowych. Najczęściej stosowanym odczynnikiem do przekształcania kwasów w chlorki kwasowe jest chlorek tionylu (SOCl2). Jego zaletą, oprócz niskiej ceny i dobrej wydajności jest to, że obok chlorku kwasowego powstają łatwe do usunięcia produkty gazowe (SO2 i HCl). Podobne zalety wykazuje chlorek oksalilu - ClCOCOCl.
kwas 3-fenylopropanowy chlorek 3-fenylopropionylu (95%)
Reakcja kwasów karboksylowych z chlorkiem tionylu biegnie zgodnie z mechanizmem SN. W wyniku addycji SOCl2 do acylowego atomu węgla powstaje chlorosiarczyn acylu, który pod wpływem anionu chlorkowego traci cząsteczkę SO2 i przekształca się w chlorek kwasowy.
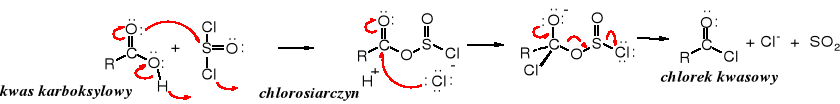
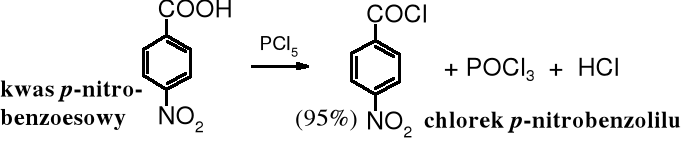
Chlorki kwasowe można otrzymywać również w reakcji kwasów z takimi pochodnymi fosforu, jak PCl3, POCl3, PCl5. Bromki kwasowe syntezuje się z kwasów i PBr3 lub POBr3, zaś jodki kwasowe powstają z chlorków kwasowych pod wpływem jodowodoru, a fluorki kwasowe z bezwodników i bezwodnego fluorowodoru.
![]()
octan sodu bromek acetylu (65%)
Właściwości fizyczne i fizjologiczne
Halogenki kwasowe o niskich ciężarach cząsteczkowych są cieczami; chlorek acetylu wrze w temperaturze 52oC, chlorek propionylu w 78oC, a chlorek benzoilu w 198oC. Chlorek p-nitrobenzoilu jest krystaliczny, topnieje w temperaturze 73oC. Halogenki kwasowe są nierozpuszczalne w wodzie, ale reagują z nią ulegając rozkładowi do kwasów karboksylowych. Po wlaniu do wody opadają na dno i w niskiej temperaturze wolno hydrolizują z wydzielaniem HCl. Niższe halogenki kwasowe reagują z wodą energiczniej, a bardzo gwałtownie z alkoholami (rozpuszczają się w nich). Halogenki kwasowe mają intensywny, gryzący zapach; nawet te niskolotne są duszące - dymią na powietrzu.
Właściwości chemiczne
Halogenki kwasowe są bardzo reaktywne, ulegają rozkładowi (lizie) pod wpływem wielu odczynników. Z wodą zachodzi hydroliza do kwasów karboksylowych, z alkoholami w wyniku alkoholizy powstają estry, z amoniakiem (amonoliza) tworzą się amidy niepodstawione, z aminami (aminoliza) - amidy podstawione, a z solami kwasów karboksylowych - bezwodniki kwasowe.
1. Hydroliza
Chlorki kwasowe w reakcji z wodą ulegają hydrolizie do kwasów karboksylowych. Im mniejsza masa cząsteczkowa chlorku tym szybciej reaguje on z wodą.
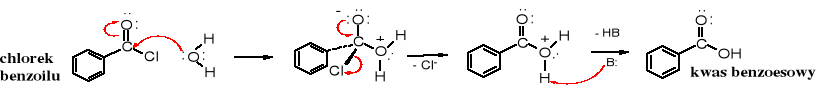
W praktyce hydroliza chlorków kwasowych nie jest wykorzystywana do otrzymywania kwasów karboksylowych, gdyż to z kwasów otrzymuje się chlorki kwasowe. Należy jednak pamiętać o tym, że chlorki kwasowe są wrażliwe na wilgoć. Powinno się, zatem przechowywać je w szczelnie zamkniętych naczyniach, a reakcje z nimi prowadzić w warunkach bezwodnych. Wyższe chlorki kwasowe są mniej reaktywne i można ich roztwory w rozpuszczalniku niemieszającym się z wodą przemywać zimną wodą w celu oczyszczenia, po czym roztwór dobrze wysuszyć (usunąć resztki wody).
2. Alkoholiza
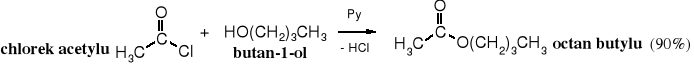
Reakcja chlorków kwasowych z alkoholami, zwana reakcją alkoholizy, czyli rozkładu pod wpływem alkoholu jest szeroko stosowana do otrzymywania estrów.
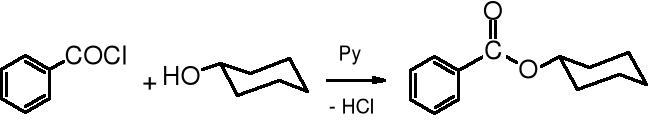
chlorek benzoilu cykoheksanol benzoesan cykloheksylu (97%)
Reakcję prowadzi się wobec zasad, np. pirydyny (Py), NaOH lub NEt3, które pochłaniają wydzielający się chlorowodór.
Alkoholiza chlorków kwasowych biegnie zwykle gwałtowniej niż ich hydroliza, ponieważ są one rozpuszczalne w alkoholach. Z tego powodu alkoholizę należy prowadzić ostrożnie, w obniżonej temperaturze, wkraplając chlorek do środowiska reakcji.
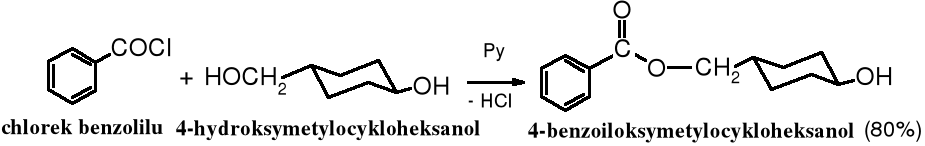
Szybkość alkoholizy chlorków kwasowych w dużym stopniu zależy od rzędowości reagującego alkoholu. Alkohole 1o reagują znacznie szybciej niż 2o, dlatego wykorzystując tę zależność można alkohole niżej rzędowe selektywnie acylować w obecności wyżej rzędowych.
3. Amonoliza i aminoliza
Halogenki kwasowe w obecności amoniaku ulegają amonolizie, a pod wpływem amin 1o i 2o - aminolizie. W obu reakcja tworzą się z wysokimi wydajnością amidy, odpowiednio niepodstawione lub podstawione. Zarówno amonoliza jak i aminoliza niskocząsteczkowych chlorków kwasowych biegnie gwałtownie.
![]()
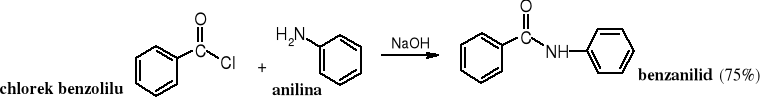
Reakcja aminolizy chlorków i bezwodników kwasowych w wodzie wobec NaOH znana jest pod nazwą reakcji Schottena-Baumanna.
Carl Schotten (1853-1910), ur. w Marburgu, Niemcy; doktorat u Hofmanna w Berlinie; prof. na Uniwersytecie w Berlinie.
Reakcja Schottena-Baumanna wykorzystywana jest zarówno laboratoryjne, jak i w przemyśle. Przykładem praktycznego zastosowania amonolizy chlorku kwasowego może być synteza leku uspokajającego - trimetozyny.
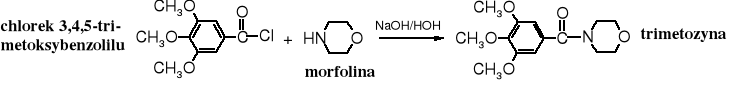
Syntetyczna trimetozyna jest analogiem (podobna w budowie) do meskaliny, narkotyku wytwarzanego przez pejot, kaktus rosnący w Meksyku i na południu USA.
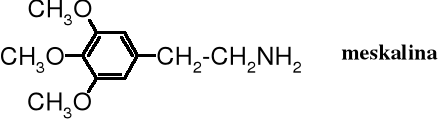
Meskalina, silny, halucynogenny narkotyk wywołuje zaburzenie poczucia czasu i miejsca przebywania oraz barwne wizje. Zażywana wielokrotnie powoduje uzależnienie i zmiany psychiczne przypominające schizofrenię. Na przełomie XIX i XX w. była popularna pośród malarzy, którzy pod jej wpływem tworzyli obrazy zawierające niezwykłe kształty i barwy (Witkacy). Natomiast morfolina, pomimo podobieństwa w nazwie do morfiny nie jest narkotykiem.
4. Redukcja
Przez długi czas chlorki kwasowe stanowiły cenny substrat w syntezie aldehydów. Pierwotnym ich substratem były łatwo dostępne kwasy karboksylowe, których przekształcenie w chlorki kwasowe nie nastręczało trudności. Problem stanowiła ich redukcja, ponieważ łatwiej jest zredukować chlorki kwasowe do alkoholi 1o, niż do aldehydów. Przez długi czas jedynym dostępnym sposobem redukcji chlorków kwasowych było ich uwodornienie wodorem w obecności katalizatora palladowego zatrutego związkami siarki. Reakcję tę znaną pod nazwą reakcji Rosenmunda prowadziło się we wrzącym ksylenie. Nie cieszyła się powodzeniem ze względu na stosunkowo niskie wydajności i niezbyt dogodne warunki jej prowadzenia.
Pd/S
chlorek kwasowy R-COCl + H2 __→ R-CHO + HCl aldehyd
ksylen, tw
Obecnie chlorki kwasowe najdogodniej przeprowadza się w aldehydy za pomocą tri-tert-butyloksyhydroglinianu litu.
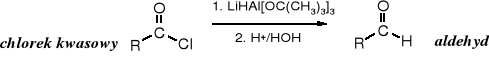
Ten selektywny reduktor otrzymuje się w reakcji t-butanolu z tetrahydroglinianem litu.
![]()
Tri-tert-butyloksyhydroglinian litu selektywnie redukuje chlorki kwasowe, ponieważ ma słabsze zdolności redukujące niż LiAlH4, a jego rozbudowana przestrzennie cząsteczka zawiera tylko jeden atom H. Odczynnik ten pozwala redukować chlorki kwasowe w obecności grupy nitrowej.
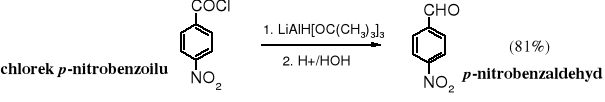
Oczywiście nie ma zalet bez wad, tri-tert-butyloksyhydroglinian litu w porównaniu do LiAlH4 jest mniej wydajny (stechiometrycznie redukuje cztery razy mniej chlorku). W takim przypadku mówimy o niskiej wydajności atomowej reakcji. Z powodów ekonomicznych ten reduktor jest stosowany jedynie w badaniach naukowych i do wytwarzania drogich produktów.
Tetrahydroglinian litu redukuje chlorki kwasowe do alkoholi 1o.
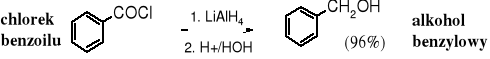
Reduktorem w tej reakcji jest anion wodorkowy: H-. Reakcja biegnie wg mechanizmu SN. Przejściowo powstaje aldehyd, ale reakcja nie zatrzymuje się na tym etapie i biegnie dalej do alkoholu.
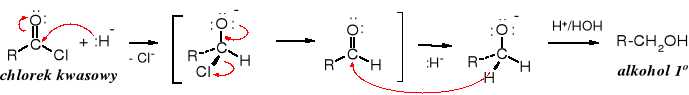
W praktyce chlorki kwasowe rzadko są redukowane za pomocą LiAlH4, ponieważ te same produkty można otrzymać z kwasu, niepotrzebny jest, więc etap przekształcania kwasów w chlorki kwasowe.
5. Reakcje ze związkami metaloorganicznymi
Chlorki kwasowe reagują z dwoma molami związku Grignarda (2 mole/1 mol chlorku), ponieważ powstający przejściowo keton ulega w warunkach reakcji przyłącza kolejną cząsteczkę związku Grignarda i po hydrolizie tworzy się alkohol 3o. Reakcja biegnie mechanizmem SN.
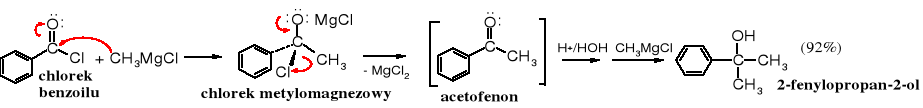
Reakcję można zatrzymać na etapie ketonu pod warunkiem, że użyje się mniej reaktywnych reagentów, takich jak odczynniki Gilmana czy związki kadmoorganiczne. Odczynniki Gilmana nie reagują z estrami, ani z bezwodnikami. Dietylomiedzian litu został wykorzystany do otrzymywania manikonu, feromonu alarmowego mrówek Manica.
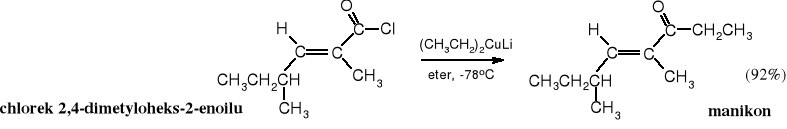
Zadanie: nazwij systematycznie manikon
Związki kadmoorganiczne są też mniej reaktywne od magnezoorganicznych i służą do otrzymywania ketonów z chlorków kwasowych. Powstają one ze związków Grignarda w reakcji w chlorkiem kadmu.
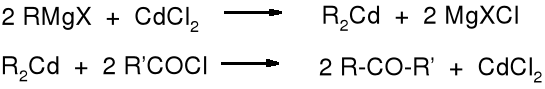
Mniejsza reaktywność związków kadmoorganicznych pozwala na selektywne przyłączanie reszt alkilowych wobec innych reaktywnych grup.
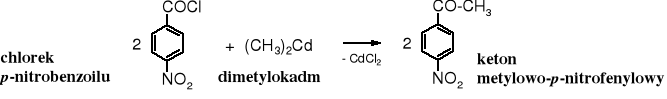
Również estry nie reagują ze związkami kadmoorganicznymi.
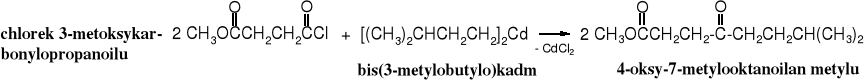
Zadanie: nazwij ten związek przyjmując, że keton stanowi główną grupę
6. Acylowanie Firedla - Craftsa
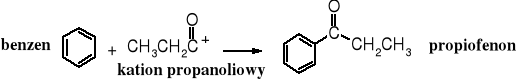
Chlorki kwasowe służą nie tylko do O-acylowania (otrzymywania estrów) i N-acylowania (otrzymywania amidów), ale również do C-acylowania prowadzącego do ketonów. Pośród reakcji C-acylowania najbardziej znaną jest reakcja Friedla - Craftsa polegająca na działaniu chlorku kwasowego na związek aromatyczny w obecności bezwodnego chlorku glinu. W procesie tym następuje wymiana protonu związane z aromatycznym pierścieniem na resztę acylową. Reakcja biegnie wg mechanizmu SE. Chlorek glinu ułatwia wytworzenie kationu acyliowego z chlorku kwasowego.
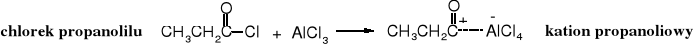
W obecności związków aromatycznych dochodzi do utworzenia ketonu poprzez podstawienie aromatycznego protonu kationem acyliowym.
Reakcja Friedla - Craftsa jest szeroko wykorzystywana w syntezie organicznej. Zamiast chlorków kwasowych stosuje się też bezwodniki kwasowe.
B E Z W O D N I K I K W A S O W E
Bezwodniki są pochodnymi kwasów karboksylowych, w których atom wodoru funkcji hydroksylowej został podstawiony reszta acylową. Ich nazwa wywodzi się ze sposobu ich otrzymywania, tj. kondensacji dwóch cząsteczek kwasu karboksylowego (kwasów), podczas której wydziela się cząsteczka wody. Wzór sumaryczny produktu różni się od dwóch cząsteczek kwasów, z których powstał, brakiem cząsteczki wody, stąd bezwodnik.
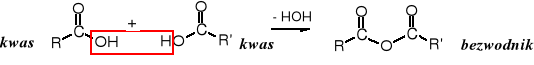
Bezwodniki mogą być symetryczne (R = R'), jeżeli zbudowane są z reszt tego samego kwasu bądź niesymetryczne - jeżeli powstały z cząsteczek dwóch różnych kwasów (R ≠ R').
Występowanie
Bezwodniki kwasowe nie występują w naturze, są otrzymywane syntetycznie.
Nomenklatura
Nazwy bezwodników tworzone są od nazw kwasów, z których się wywodzą, przy czym w nazwie bezwodnika symetrycznego po słowie bezwodnik występuje nazwa kwasu w formie przymiotnikowej, np. bezwodnik octowy, bezwodnik ftalowy itd. Bezwodniki niesymetryczne nazywa się podobnie jak ketony, tzn. po słowie bezwodnik podaje się w porządku alfabetycznym przymiotnikowe nazwy macierzystych kwasów, np. bezwodnik mrówkowo-octowy czy masłowo-propionowy.

W nazwach bezwodników stosuje się również systematyczne nazwy kwasów.
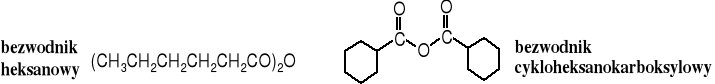
Otrzymywanie
1. Acylowanie soli kwasów
Typowy sposób otrzymywania bezwodników, zarówno symetrycznych, jak i niesymetrycznych polega na reakcji soli kwasu z chlorkiem kwasowym.
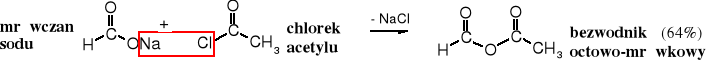
2. Przemysłowa produkcja bezwodnika octowego
Przemysłowa metoda otrzymywania bezwodnika octowego polega na reakcji ketenu z kwasem octowym. Keten powstaje w wyniku wysokotemperaturowej dehydratacji kwasu octowego.
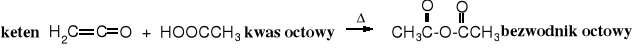
3. Za pomocą DCC
Dogodnym laboratoryjnym sposobem otrzymywania bezwodników jest reakcja odwodnienia kwasów za pomocą dicykloheksylokarbodiimidu (DCC). Odczynnik ten wykorzystuje się często w chemii peptydów do tworzenia wiązania peptydowego. Z N-chronionych aminokwasów można otrzymywać symetryczne lub niesymetryczne bezwodniki, które służą do acylowania C-chronionych aminokwasów.
DCC
kwas 2 R-COOH __→ (RCO)2O bezwodnik
- HOH
4. Dehydratacja termiczna kwasów dikarboksylowych
Bezwodniki cykliczne powstają w trakcie termicznej dehydratacji kwasów dikarboksylowych.
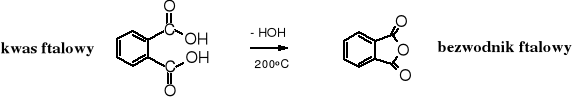
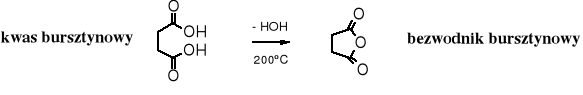
Właściwości chemiczne
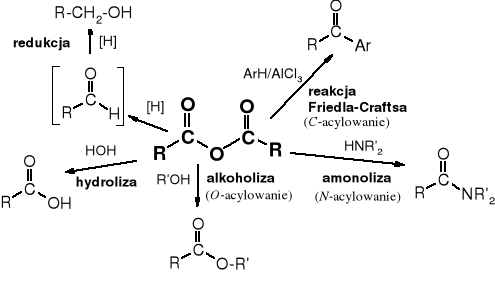
Bezwodniki kwasowe swoimi właściwościami przypominają chlorki kwasowe, są jednak trochę mniej reaktywne. Ulegają one reakcjom hydrolizy, alkoholizy, amonolizy, aminolizy i redukcji, wchodzą w reakcję ze związkami metaloorganicznymi i służą do C-acylowania.
1. Hydroliza
Bezwodniki hydrolizują w obecności wody do kwasu (kwasów), z którego się wywodzą. Nie jest to jednak metoda otrzymywania kwasów. Należy jedynie pamiętać o możliwości hydrolizy bezwodników podczas pracy z nimi.
(RCO)2O + HOH _→ 2 RCOOH
Hydroliza bezwodników biegnie wg mechanizmu typowego dla pochodnych kwasów, czyli jest to złożona substytucja nukleofilowa. W pierwszym etapie następuje addycja do acylowego atomu węgla, po czym dochodzi do eliminacji grupy odchodzącej, w tym wypadku cząsteczki kwasu.
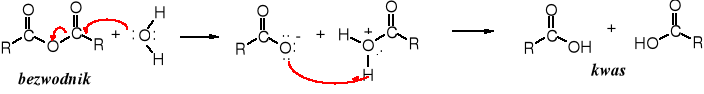
2. Alkoholiza
W wyniku reakcji alkoholu z bezwodnikiem tworzy się ester i wydziela cząsteczka kwasu.
(RCO)2O + HOR' _→ RCOOR' + RCOOH
Nie jest wydajny sposób otrzymywania estrów, ponieważ połowa cząsteczki bezwodnika jest „marnowana”, jako produkt uboczny wydziela się kwas karboksylowy. Niektóre bezwodniki są jednak powszechnie stosowane, gdyż są tanie i wygodniejsze w użyciu niż chlorki kwasowe. Należą do nich bezwodnik octowy i benzoesowy. Reakcja alkoholizy bezwodników jest katalizowana zarówno przez kwasy jak i zasady.
Mechanizm:
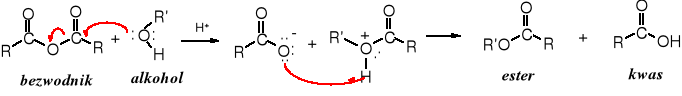
Zarówno podczas hydrolizy, jak i alkoholizy bezwodników dochodzi do autokatalizy, ponieważ powstający w reakcji kwas katalizuje te reakcje.
Wykorzystywanie tylko połowy cząsteczki bezwodnika do acylowania jest dogodnym sposobem otrzymywania monoestrów kwasów dikarboksylowych z bezwodników cyklicznych.
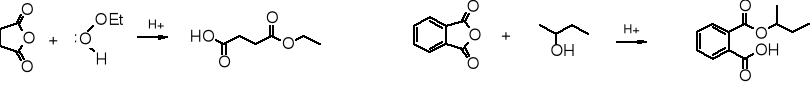
bezwodnik bursztynowy wodorobursztynian etylu bezwodnik ftalowy alkohol sec-butylowy wodoroftalan sec-butylu
Acylowanie za pomocą bezwodników w środowisku wody z udziałem NaOH, podobnie jak dla chlorków kwasowych, nazywa się reakcją Schottena-Baumanna.
Bezwodnik octowy jest wykorzystywany w produkcji aspiryny, czyli kwasu acetylosalicylowego.
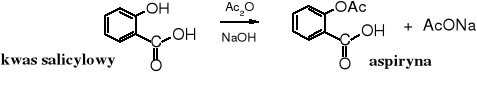
Zadanie: nazwij systematycznie substrat i produkt
3. Amonoliza (aminoliza)
W reakcji bezwodników z amoniakiem lub aminami 1o lub 2o tworzą się amidy, odpowiednio niepodstawione lub podstawione oraz sól kwasu karboksylowego. W reakcji zużywane są dwa mole aminy na 1 mol bezwodnika lub należy dodać 1 mol innej zasady, żeby związać powstający kwas; amina w postaci soli nie ulega acylowaniu.
(RCO)2O + 2 HNR'2 _→ RCONR'2 + RCOO- N+H2R'2
Mechanizm:
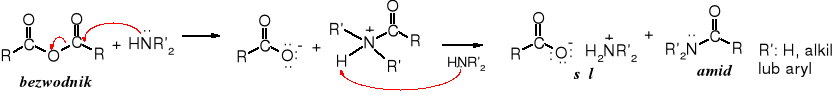
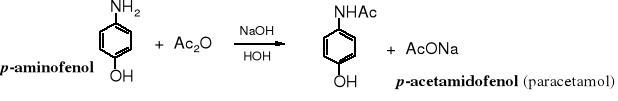
Bezwodnik octowy jest często stosowany do reakcji N-acylowania, powstają w niej amidy. Grupa aminowa jest bardziej podatna na acylowanie niż hydroksylowa, dlatego też można selektywnie acylować aminy wobec alkoholi (fenoli). W ten sposób otrzymuje się p-acetamidofenol, powszechnie stosowany lek przeciwbólowy, znany pod nazwą paracetamolu. Bardziej reaktywne chlorki kwasowe nie są selektywne w tej reakcji.
Amonoliza bezwodników cyklicznych jest dogodnym sposobem otrzymywania monoamidów kwasów dikarboksylowych.
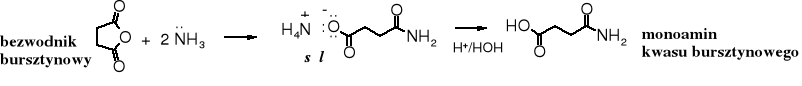
Użycie bezwodnika bursztynowego i amoniaku w stosunku molowym 1 : 1 nie prowadzi do imidu; w tych warunkach powstaje także monoamid. Imid kwasu bursztynowego (sukcynoimid) jest powszechnie stosowanym, komercyjnym odczynnikiem. Jego otrzymywanie polega na termicznym rozkładzie soli amonowej kwasu bursztynowego.
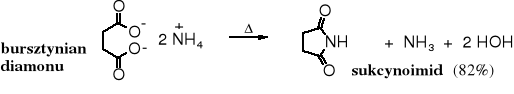
Podobne reakcje zachodzą z bezwodnikiem ftalowym.
Użycie aminy 1o w reakcji z cyklicznymi bezwodnikami prowadzi bezpośrednio do imidu (N-podstawionego).
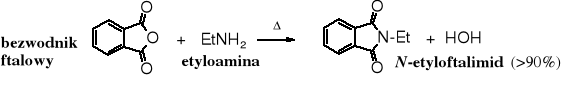
4. Redukcja
Redukcja bezwodników tetrahydroglinianem litu prowadzi do alkoholi. Z jednego mola bezwodnika otrzymuje się 2 mole alkoholu. Reakcja ta nie ma większego znaczenia praktycznego, ponieważ bezpośrednio z kwasu można otrzymać ten sam produkt.
![]()
5. Reakcja ze związkami Grignarda
Bezwodniki reagują ze związkami Grignarda podobnie jak inne związki zawierające grupę karbonylową. Reakcja ta nie ma większego znaczenia, ponieważ podobne produkty otrzymuje się z łatwiej dostępnych estrów.
6. Acylowanie Friedla-Craftsa
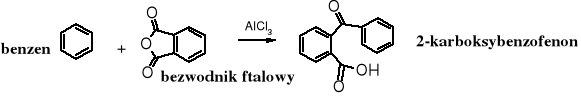
Bezwodniki, podobnie jak chlorki kwasowe używane są do C-acylowania arenów. Reakcja biegnie w obecności chlorku glinu, który ułatwia powstawanie kationu acyliowego.
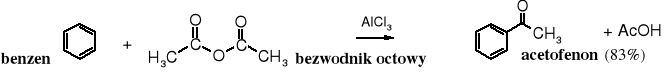
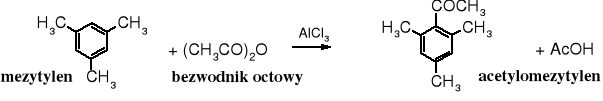
Acylowanie arenów cyklicznymi bezwodnikami prowadzi do oksokwasów.
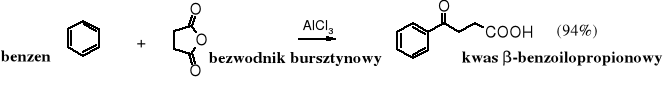
Właściwości chemiczne bezwodników Schemat 13.1
1
Wyszukiwarka
Podobne podstrony:
16 Bezwodniki i halogenki kwasowe
W -- Bezwodniki i halogenki kwasowe, podstawy chemii organicznej
14) Badanie składników kwasów nukleinowychid 15604
wyklad 14
Vol 14 Podst wiedza na temat przeg okr 1
Metoda magnetyczna MT 14
Równowaga kwasowo zasadowa fizjot3
wyklad 14 15 2010
Oznaczanie kwasowości
TT Sem III 14 03
Rˇwnowaga kwasowo zasadowa
więcej podobnych podstron