
Termodynamika Techniczna
Seminarium II

Zagadnienia:
Lepkość dynamiczna i kinematyczna, liczba Reynoldsa,
równanie Bernoulliego, gazy doskonałe, gazy rzeczywiste,
równanie Clapeyrona, prawa gazowe, termiczne równanie
stanu gazów, prawo Avogadra, równanie van der Waalsa

.
2
2
const
g
h
w
p
s
Równanie Bernoulliego:
Przy ustalonym przepływie w dowolnym przekroju rurociągu suma ciśnienia statycznego , dynamicznego
i ciśnienia położenia (wysokości) jest wielkością stałą
h – wysokość położenia [m]
ρ – gęstość czynnika [kg/m
3
]
p
s
– ciśnienie statyczne [Pa]
w – prędkość przepływu [m/s]
g – przyśpieszenie ziemskie 9,81 [m/s
2
]
Równanie Bernoulliego

Termodynamika gazów
Gaz doskonały
brak oddziaływań międzycząsteczkowych z wyjątkiem odpychania
w momencie zderzeń cząsteczek
objętość cząsteczek jest znikoma w stosunku do objętości gazu
zderzenia cząsteczek są doskonale sprężyste
Gaz półdoskonały
w drobinach gazu występują drgania
Gaz rzeczywisty
zachowuje się jak półdoskonały pod dostatecznie niskim ciśnieniem

Prawo Boyle’a-Mariotte’a
Dotyczy zachowania gazu doskonałego w przemianie izotermicznej
Ciśnienie danej masy gazu jest odwrotnie proporcjonalne do zajmowanej
objętości w danej temperaturze
R. Boyle 1662 r., E. Mariotte 1676 r.
T=const.; p·V = const.
p
V
1
~
2
2
1
1
V
p
V
p
1
2
2
1
V
V
p
p

Prawo Gay-Lussaca
.
0
0
const
T
V
T
V
Przy stałym ciśnieniu objętość danej masy jest wprost
proporcjonalna do temperatury

Prawo Charlesa
Dotyczy zachowania gazu doskonałego w przemianie izochorycznej.
W stałej objętości ciśnienie danej masy gazu jest wprost proporcjonalne do
temperatury
T
p~
.
0
0
const
T
p
T
p

Prawo Avogadra
W tych samych warunkach fizycznych
tj. w takiej samej temperaturze i pod takim samym ciśnieniem,
w równych objętościach różnych gazów
znajduje się taka sama liczba cząstek
W warunkach normalnych (1 atm., 0
o
C)
1 mol
dowolnego gazu zajmuje objętość
22,4 dm
3
W warunkach umownych (1 bar, 0
o
C)
1 mol
gazu będzie zajmował objętość
22,71 dm
3

Równanie Clapeyrona
gaz doskonały składa się z cząsteczek stanowiących punkty materialne,
a więc, nie posiadających objętości własnej
pomiędzy poszczególnymi cząsteczkami nie istnieją siły wzajemnego
oddziaływania (przyciągania lub odpychania).
Gaz rzeczywisty będzie spełniał wyżej wymienione warunki w przypadku, gdy:
lub
Równanie stanu gazu doskonałego
(równanie Clapeyrona)
,
może zostać
zapisane w jednej z postaci:
gdzie:
- indywidualna stała gazowa
- objętość właściwa
0
p
V
nRT
pV
T
mR
pV
i
T
R
pv
i
]
[
kgK
J
M
R
R
i
]
[
3
kg
m
m
V
v

Prawo Daltona
Ciśnienie p
i
, wytworzone w naczyniu przez jakiś komponent (składnik
„i”) jest równe ciśnieniu, jakie wytworzyłby ten składnik, gdyby sam
wypełniał całe naczynie. Jest to tzw.
ciśnienie cząstkowe
.
Dla dostatecznie rozrzedzonych gazów, ciśnienie gazowej mieszaniny
(p) jest równe sumie ciśnień cząstkowych poszczególnych składników:
p = p
1
+ p
2
+…+ p
n
„gaz widzi ścianki, a nie widzi drugiego gazu”
Stąd równanie Clapeyrona można zapisać jako:
RT
M
m
M
m
M
m
pV
i
i
)
...
(
2
2
1
1
lub
RT
n
n
n
pV
i
)
...
(
2
1
gdzie: n
i
– liczba moli składnika mieszaniny

Ciepło właściwe gazów doskonałych
Mianem ciepła właściwego określa się ilość ciepła, jaka jest niezbędna
do ogrzania jednostki (masy, objętości, liczby moli) substancji o 1 K
gdzie: c – ciepło właściwe, Q – zmiana ciepła (energii), m – masa,
T – zmiana temperatury
]
[
kgK
J
T
m
Q
c
]
[J
T
c
m
Q

Ciepło właściwe
Ciepło właściwe
(pojemność cieplna, heat capacity) danej substancji jest
zdefiniowana jako pochodna ciepła wymienianego przez układ z otoczeniem,
względem temperatury:
]
,
[
kmolK
J
kgK
J
dT
dq
c
gdzie:
]
,
[
kmol
J
kg
J
q
-jednostkowa ilość ciepła (odniesiona do
jednostkowej ilości czynnika)
Ciepło właściwe ciał stałych i cieczy, a w pewnych warunkach również
gazów, jest wielkością w przybliżeniu stałą, zatem:
]
,
[
kmolK
J
kgK
J
T
q
c

Ciepło właściwe
Ciepło właściwe:
masowe c [J/kgK]
molowe C [J/kmolK]
zależność: C=c∙M
Wielkość ciepła właściwego jest uzależniona od rodzaju przemiany, jakiej
podlega czynnik, czyli od sposobu, w jaki wymieniane jest ciepło:
ciepło właściwe przy stałej objętości:
ciepło właściwe przy stałym ciśnieniu:
V
v
T
U
c
p
p
p
T
I
T
H
c
U- energia wewnętrzna,
H- entalpia (oznaczana również jako I)

Ciepło właściwe
Zależności wiążące wyżej zdefiniowane wielkości:
v
p
v
p
C
C
c
c
gdzie: κ - wykładnik adiabaty
Równanie Mayera:
ind
v
p
R
c
c
wynikające zależności:
1
ind
v
R
c
ind
p
R
c
1
R
C
C
v
p

R
c
v
2
3
Zależności wartości ciepła właściwego dla gazów:
- jednoatomowych
R
c
p
2
5
R
c
v
2
5
- dwuatomowych
R
c
p
2
7
R
c
v
3
- trój- i wieloatomowych
R
c
p
4

Ciepło właściwe
Ciepło właściwe gazu rzeczywistego nie jest wielkością stałą – zależy ono od
wielu parametrów, z których najistotniejszym jest temperatura: c =c(T).
W pewnych warunkach dogodnym sposobem posługiwania się ciepłem
właściwym gazu rzeczywistego jest obliczenie jego wartości średniej w
rozważanym zakresie temperatur:
2
1
)
(
1
2
T
T
śr
dT
T
c
T
T
c
c
Mając do dyspozycji wartości średniego ciepła właściwego, określonego od
T
0
(najczęściej T
0
= 0 ) do danej temperatury, średnie ciepło właściwe w
zakresie temperatur T
1 ,
T
2
można określić z zależności:
1
2
1
2
1
0
2
0
2
1
|
|
|
T
T
T
c
T
c
c
T
T
T
T
T
T

Ciepło właściwe gazów półdoskonałych
Jeżeli w danym procesie zmiany temperatur stanów początkowego
i końcowego są niewielkie, można przyjąć, że zmiana ciepła właściwego jest
niewielka
Zmiany temperatur układu podczas ogrzewania lub chłodzenia
gazów półdoskonałych układu są stosunkowo duże:
)
(
1
2
2
1
,
2
1
T
T
c
m
cdT
m
Q
T
T
c
)
(
|
)
(
1
2
2
1
,
2
1
2
1
T
T
c
m
dT
T
c
m
Q
T
T
T
T
c

Właściwości gazów rzeczywistych
Gazy rzeczywiste różnią się od gazów doskonałych tym, że ich cząsteczki
posiadają własną objętość oraz oddziałują na siebie siłami
międzycząsteczkowymi (zwanymi siłami van der Waalsa)
Równanie van der Waalsa:
dla 1 kilomola gazu
dla n kilomoli
gdzie: V’ - molowa objętość gazu, V’ =V/n [m
3
/kmol]
V - objętość gazu
a – stała charakterystyczna dla danego gazu uwzględniająca
przyciąganie cząsteczek gazu czyli spadek ciśnienia
b - stała charakterystyczna dla danego gazu uwzględniająca objętość
własną cząsteczek
T
R
b
V
V
a
p
)
'
)(
'
(
2
T
R
n
b
n
V
V
a
n
p
)
)(
(
2
2
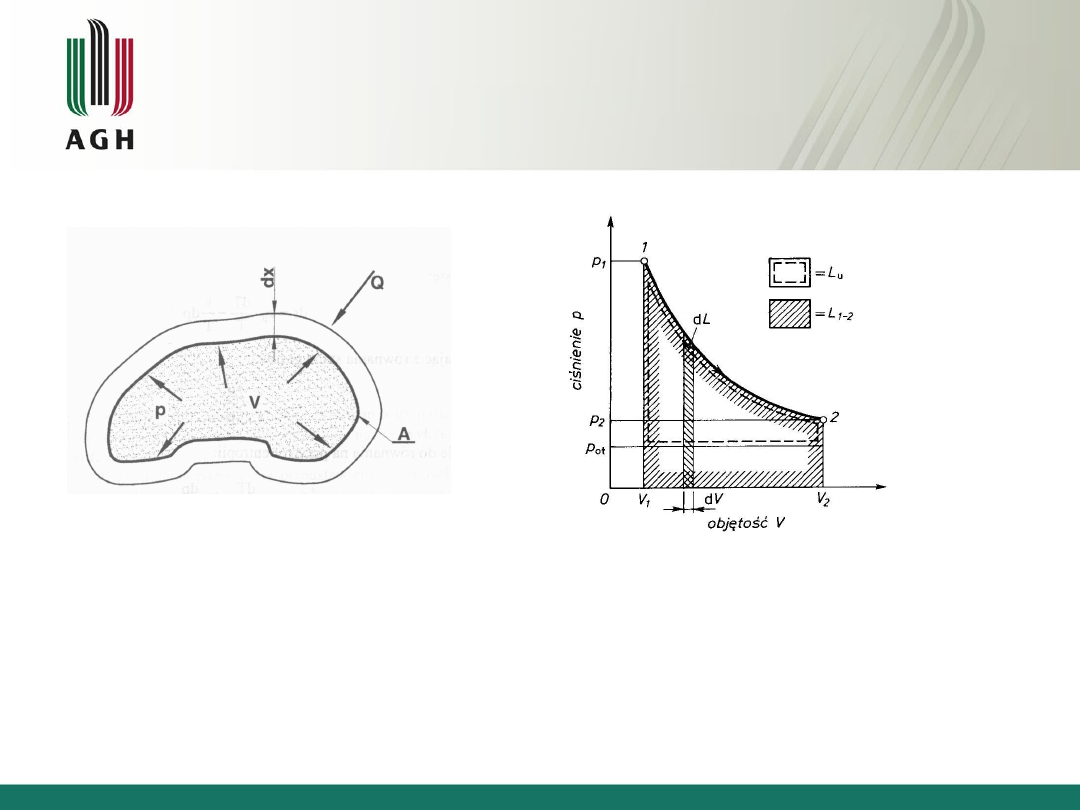
Praca bezwzględna
Jeżeli w układzie o objętości V ograniczonym elastyczną powłoką znajduje się gaz o
ciśnieniu bezwzględnym p, a pod wpływem doprowadzonego ciśnienia objętość V
zwiększy się o dV, to wykonaną podczas tego rozprężania gazu pracę powierzchni A przy
ciśnieniu p na drodze dx określa się mianem pracy bezwzględnej
pdV
dx
A
p
L
p – ciśnienie bezwzględne gazu
A – powierzchnia, na której wykonywana
jest praca
dx – droga, na której wykonywana jest praca
dV – przyrost objętości
2
1
V
V
pdV
I
Zależność dla przemiany zachodzącej
w granicach zmian objętości od V
1
do V
2
dla 1 kg czynnika
Praca bezwzględna:
.
0
0
const
T
V
T
V
Przy stałym ciśnieniu objętość danej masy jest
wprost proporcjonalna do temperatury
Prawo Gay-Lussaca:
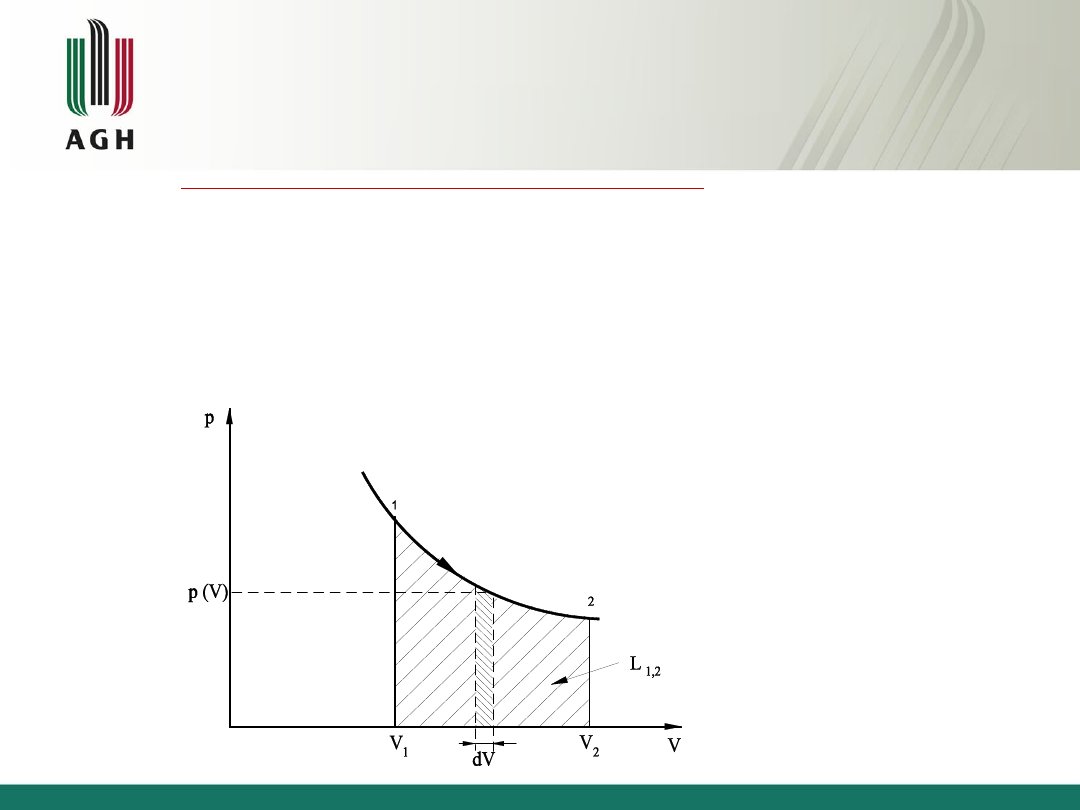
Praca
Praca zewnętrzna (związana ze zmianą objętości)
Praca zewnętrzna oddawaną do otoczenia przez układ przyjmuje się za
dodatnią (dV>0), a pracę zewnętrzną pobieraną przez układ z otoczenia za
ujemną (dV<0).
W szczególnym przypadku praca zewnętrzna ogranicza się do pracy zmiany
objętości, a wtedy dla przemian odwracalnych ciał prostych mamy:
2
1
2
,
1
V
V
pdV
L
pdV
dU
dQ
2
1
1
2
2
,
1
1
2
2
,
1
V
V
pdV
U
U
L
U
U
Q
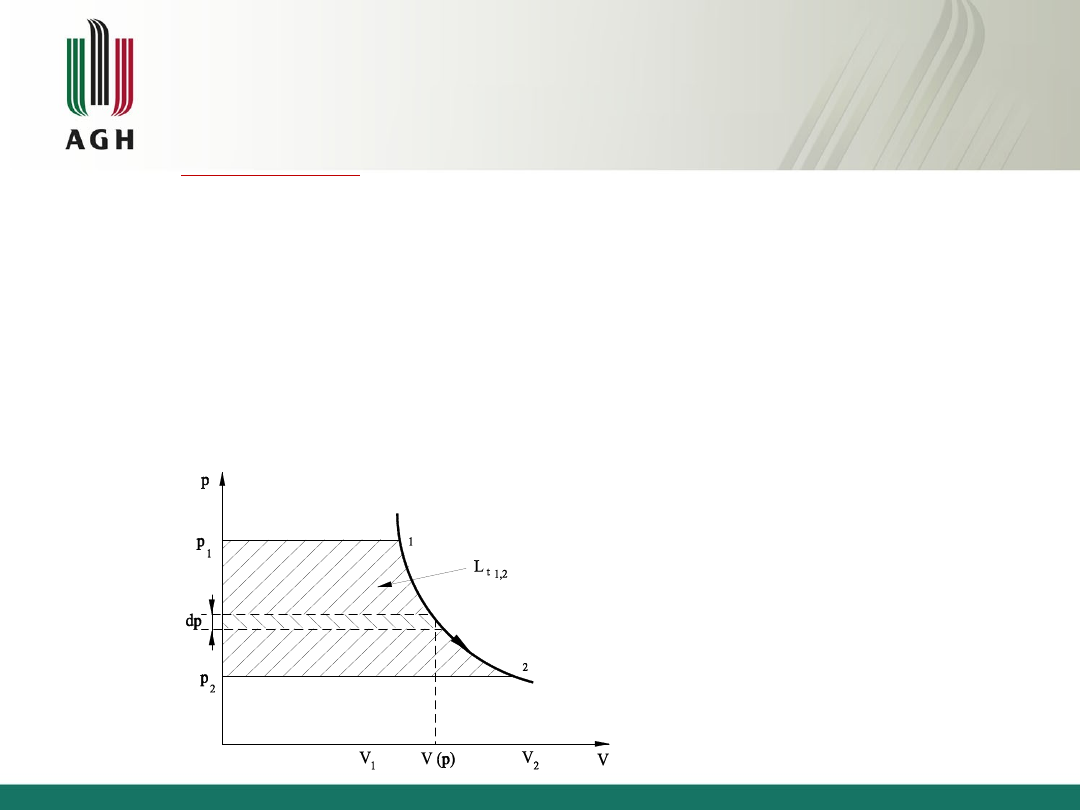
Praca
Praca techniczna
Praca techniczna jest dodatnia przy rozprężaniu (dp<0) i ujemna przy
sprężaniu (dp>0)
Jeżeli w równaniu
wyrażającym pierwszą zasadę termodynamiki dla układu zamkniętego,
wstawimy w miejsce energii wewnętrznej entalpię, wówczas praca zewnętrzna
zamieni się na
pracę techniczną
i dla przemian odwracalnych równanie to
przyjmie postać:
2
1
2
,
1
p
p
t
Vdp
L
pdV
dU
dQ
2
1
1
2
2
,
1
1
2
2
,
1
p
p
t
Vdp
I
I
L
I
I
Q
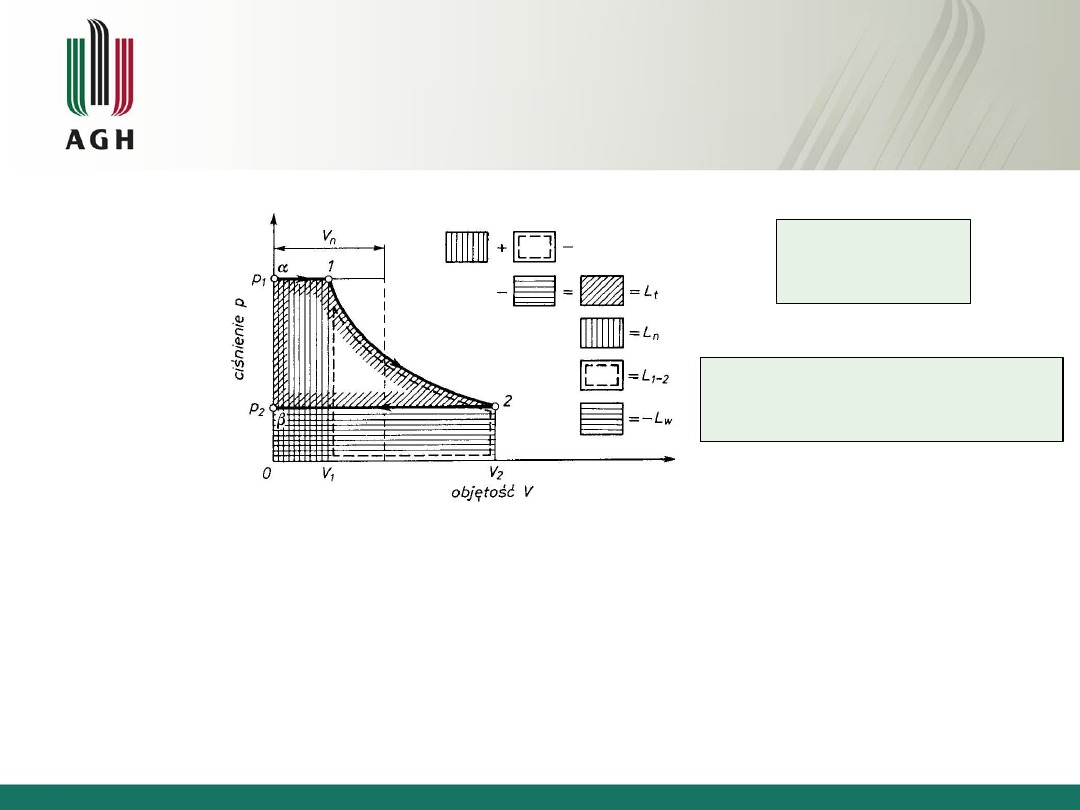
Praca
techniczna
2
1
2
1
p
p
V
Vdp
L
m
t
Vdp
dL
t
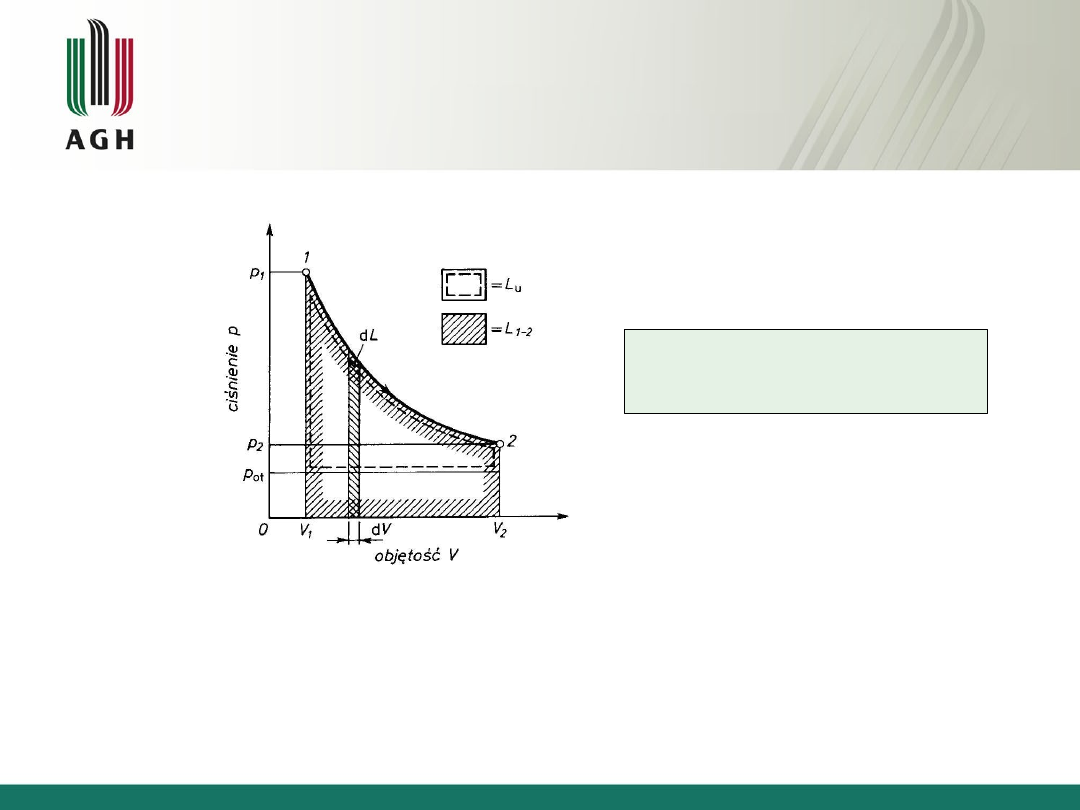
Praca
użyteczna
1
2
2
1
V
V
p
L
L
ot
u
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
Wyszukiwarka
Podobne podstrony:
harmonogram HIP sem III 13 14 Mechatronika
gleba 1-14, PW, SEM III, Gleboznawstwo, Egzamin
temat 14, ZiIP, inne kierunki, politechnika, sem III, ang
sem VI FŚ k-z 03, UCZELNIA ARCHIWUM, UCZELNIA ARCHIWUM WGiG, WGiG Rok III sem VI (2013-2014), sem VI
Laboratorium elektroniki - Ćwiczenie 03, Politechnika Lubelska, Studia, sem III, materiały, Teoria O
ODL II sem termin2 14 07 03
MOJE 3ok, Budownictwo UZ sem. III
Funkcjonowanie klasycznego systemu MRP, Materiały dla ZiP, sem III
Elektrowrzeciono, Studia, Studia sem III, Uczelnia
TEST OGÓLNY BHP rozwiązania, Polibuda MBM PWR 2012-2016, Sem. III, Ergonomia i BHP
TwarKwasZasad, PG, rok2, sem III, sprawka z chemii
materialoznastwo-sciaga, ZiIP, inne kierunki, politechnika, sem III, z pena
pn 14 03 11 łożysko konia
ODL I sem termin2 14 02 07
więcej podobnych podstron