ALKACYMETRIA
Rozpuszczanie - fizyczny proces mieszania się dwóch lub więcej faz w wyniku którego powstaje roztwór.
Roztwór - jednorodny, jednofazowy układ dwu- lub wieloskładnikowy, którego skład można zmieniać w określonym przedziale w sposób ciągły.
Okluzja - rozpuszczenie gazu w ciele stałym
Amalgamat - rozpuszczenie cieczy w ciele stałym
Roztwór nasycony - roztwór znajdujący się w stanie równowagi z substancją nie rozpuszczoną.
Roztwór przesycony - roztwór w którym stężenie substancji rozpuszczonej jest większe, niż wynika to z jej rozpuszczalności w danej temperaturze; układ nietrwały - nadmiar substancji wytrąca się a roztwór wraca do stanu równowagi
Roztwarzanie - przeprowadzanie trudno rozpuszczalnej substancji do roztworu w wyniku nieodwracalnej reakcji chemicznej.
STOPIEŃ DYSOCJACJI
Stopień dysocjacji - stosunek liczby cząsteczek zdysocjowanych do ogólnej liczby cząsteczek elektrolitu (przed dysocjacją) w danej objętości.
![]()
n - liczba cząsteczek zdysocjowanych
N - całkowita (początkowa) liczba cząsteczek
Stopień dysocjacji zależy od:
rodzaju rozpuszczalnika (np. HCl w wodzie dysocjuje lepiej niż w benzenie - wykazuje większy stopień dysocjacji)
stężenia substancji rozpuszczonej (ilości rozpuszczalnika) - im bardziej rozcieńczony roztwór tym wyższy stopień dysocjacji
temperatury - możliwe zmniejszenie (np. HCl) lub zwiększenie (np. H2O) stopnia dysocjacji wraz ze wzrostem temperatury
obecności innych elektrolitów w roztworze
ELEKTROLITY |
||
słabe (α<0,05) |
średniej mocy (0,05<α<0,3) |
mocne (α >0,3) |
- część kwasów nieorganicznych (H2SO3, H2CO3, HCN, HBO3) - część zasad nieorganicznych (roztwór amoniaku, większość wodorotlenków metali 2- i 3-wartościowych) - hydrazyna, hydroksyloamina - kwasy i zasady organiczne (z wyj. kwasów sulfonowych i szczawiowego) |
- H3PO4 - H3AsO4 - Mg(OH)2 |
- prawie wszystkie sole (wyj. niektóre sole Hg, Cd, Zn) - część kwasów nieorganicznych (HCl, HNO3, HClO4, H2SO4, HBr, HI) - wodorotlenki potasowców, wapniowców i srebra |
STAŁA DYSOCACJI
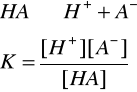
Stała dysocjacji - stosunek iloczynu stężeń molowych jonów, na które rozpadł się dany elektrolit, do stężenia cząsteczek niezdysocjowanych w stanie równowagi dynamicznej:
nie zależy od stężenia
zależy od temperatury (w danej temperaturze wielkość stała - rośnie wraz ze wzrostem temperatury) oraz rodzaju rozpuszczalnika
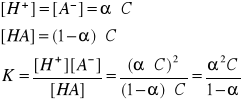
ZALEŻNOŚĆ MIĘDZY STAŁĄ, STOPNIEM DYSOCACJI I STĘŻENIEM = prawo rozcieńczeń Ostwalda:
![]()
Dla elektrolitów słabych (α<0,05) możemy przyjąć, że 1 - α ≈ 1 i wtedy: K = α2C, a
Prawo rozcieńczeń Ostwalda - stopień dysocjacji słabego elektrolitu jest odwrotnie proporcjonalny do pierwiastka kwadratowego ze stężenia tego elektrolitu w roztworze i wprost proporcjonalny do pierwiastka kwadratowego ze stałej dysocjacji.
stopień dysocjacji zależy od stałej dysocjacji i początkowego stężenia molowego roztworu
Stała dysocjacji jest wielkością stałą jeżeli zwiększymy stężenie jednego ze zdysocjowanych jonów, zmniejszy się stężenie drugiego jonu, a zwiększy się stężenie cząsteczek niezdysocjowanych (COFNIĘCIE DYSOCJACJI), np. po dodaniu mocnego kwasu do słabego kwasu (zwiększamy stężenie H+) część jonów H+ ponownie połączy się z jonami A- (zmniejszy się stężenie A-) tworząc cząsteczki HA (zwiększy się ich stężenie).
Podobnie jeżeli zwiększymy stężenie A- (np. do roztworu słabego kwasu dodajemy pewną ilość jego soli)
AKTYWNOŚĆ JONÓW
Stężone roztwory mocnych elektrolitów zachowują się tak, jakby nie były całkowicie zdysocjowane (w przeciwieństwie do roztworów rozcieńczonych), ponieważ jony ulegają wzajemnemu przyciąganiu i odpychaniu się elektrostatycznemu (nie mają pełnej swobody ruchów).
Rozcieńczanie większe odległości między jonami słabnie wzajemne przyciąganie i jony mogą poruszać się swobodniej rośnie stopień dysocjacji
Wyższe stężenie mniejsze odległości między jonami rosną siły przyciągania elektrostatycznego maleje energia kinetyczna jonów (zmniejsza się ich aktywność) odchylenia w wartościach stałej dysocjacji
W stężonych roztworach jony są otoczone innymi jonami przeciwnego znaku tworzy się chmura (atmosfera) jonowa o przeciwnym znaku, która w polu elektrostatycznym porusza się w innym kierunku niż jony zasadnicze i hamuje ich ruch.
AKTYWNOŚĆ (aktywne stężenia) - pozorne stężenie jonu, efektywnie przejawiające się podczas pomiaru (czyli stężenie tych jonów, które nie są skrępowane przez chmurę jonową i oddziaływania międzycząsteczkowe czy też inne siły)
dla roztworów rozcieńczonych i roztworów słabych elektrolitów aktywność = stężenie (duże odległości między jonami i brak krępowania ruchów)
w pozostałych przypadkach: aktywność < stężenie
![]()
Zależność między aktywnością a stężeniem:
a - aktywność
C - stężenie
f - współczynnik aktywności (charakteryzuje stopień skrępowania ruchów jonów lub cząsteczek) - im wyższy tym mniejsze skrępowanie (w roztworach rozcieńczonych = 1)
Współczynnik aktywności: ![]()
z - ładunek jonu
μ - siła jonowa - miara natężenia pola elektrostatycznego panującego w roztworze (połowa sumy iloczynów stężeń molowych poszczególnych jonów i kwadratów ich ładunków):
Po podstawieniu aktywności zamiast stężenia do wzoru na stałą dysocjacji otrzymujemy termodynamiczna stałą dysocjacji:
ILOCZYN JONOWY WODY
Woda jest słabym elektrolitem, który nieznacznie dysocjuje:
Jon wodorowy występuje wyłącznie w postaci jonu uwodnionego (wiąże co najmniej 2 cząsteczki wody z wytworzeniem mostku wodorowego):
Dla uproszczenia stosuje się symbol H+ lub H3O+ w reakcjach kwas-zasada)
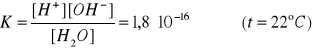
Stała dysocjacji wody:
Ponieważ woda jest słabym elektrolitem, możemy przyjąć, że [H2O] = 1 i wtedy:
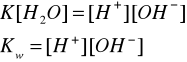
Kw - iloczyn jonowy - wartość stała w danej temperaturze, określa zależność między stężeniami jonów H+ i OH- bez względu na to czy pochodzą one z wody, czy też z kwasu bądź zasady.
Obliczenie wartości Kw:
masa 1 litra wody jest równa ok. 1000g
masa molowa wody: 18 g/mol
w związku z tym:
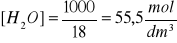
Kw = K [H2O] = 1,8 ∙ 10-16 ∙ 55,5 = 10 -14
Kw = [H+] [OH-] = 10 -14
[H+] = [OH-]
[H+] [OH-] = [H+]2 = 10 -14
[H+] = 10 -7
Iloczyn jonowy wody jest wartością stałą więc dodatnie któregoś z jonów (H+ lub OH-) spowoduje zmniejszenie stężenia drugiego jonu.
Roztwór kwaśny [H+] > 10-7 [OH-] < 10 -7 [H+] > [OH-]
Roztwór zasadowy [H+] < 10-7 [OH-] > 10 -7 [H+] < [OH-]HHHHHkł
Roztwór obojętny [H+] = 10-7 [OH-] = 10 -7 [H+] = [OH-]HHHHHkł
WYKŁADNIK WODOROWY (pH)HHHHHkł
Wykładnik stężenia jonów wodorowych (pH) - logarytm dziesiętny stężenia jonów wodorowych ze znakiem przeciwnym.
[H+] = 10-pH
lg[H+] = - pH
pH = - lg[H+]
[H+] [OH-] = 10 -14
pH + pOH = 14
pH = 14 - pOH
pOH = 14 - pH
Zamiast stężenia w dokładniejszych badaniach stosuje się aktywność:
TEORIE KWASOWO-ZASADOWE:
Teoria Broensteda-Lowry'ego:
kwas - substancja, która posiada zdolność ODDAWANIA protonu innej substancji (protonodawca, donor protonów, dysprotyd)
kwasy cząsteczkowe
kwasy anionowe (np. HSO4-)
kwasy kationowe (np. NH4+)
zasada - substancja posiadająca zdolność PRZYŁĄCZANIA protonu (protonobiorca, akceptor protonu, emprotyd
zasady cząsteczkowe
zasady anionowe (np.CN- i ClO-)
zasady kationowe
reakcja kwas-zasada polega na przeniesieniu protonu z cząsteczki kwasu do cząsteczki zasady (jest to proces odwracalny):
Kwasy i zasady nie występują samodzielnie lecz w postaci sprzężonych par - każdemu kwasowi odpowiada sprzężona z nim zasada (z ładunkiem elektrycznym o jednostkę mniejszym), a każdej zasadzie odpowiada sprzężony z nią kwas (z ładunkiem o jednostkę większym)
proton nie może występować w roztworze w stanie wolnym - ulega przeniesieniu do cząsteczki innej, silniejszej zasady. W procesie tym uczestniczą dwie sprzężone pary kwas-zasada
przemiana proteolityczna - reakcja kwas-zasada przebiegająca w rozpuszczalniku protonowym (wg teorii Broensteda są to m.in. reakcje dysocjacji, hydrolizy, zobojętniania)
rozpuszczalnik amfiprotyczny (amfiprotolityczny) - może występować zarówno jako donor jak i akceptor protonów, np.
woda: H2O + H2O ↔ H3O+ + OH-
ciekły amoniak: NH3 + NH3 ↔ NH4+ + NH2-
moc kwasów i zasad zależy od rodzaju rozpuszczalnika
w ciekłym amoniaku dysocjują kwasy, które są słabe w roztworze wodnym, np., H2S i HCN,
zasady słabe w środowisku wodnym (anilina, mocznik) są słabym kwasami w środowisku amoniaku
w bezwodnym kwasie mrówkowym HCl jest słabym kwasem a mocznik mocną zasadą
kwas octowy w wodzie słaby kwas; w amoniaku mocny kwas; w bezwodnym H2SO4 zasada
rozpuszczalnik ZASADOWY silnie przyłącza proton: ropuszczone w nim kwasy są mocniejsze, a zasady słabsze
rozpuszczalnik KWASOWY słabo przyłącza proton (łatwiej go oddaje): rozpuszczone w nim kwasy są słabsze, a zasady silniejsze
Teoria rozpuszczalnikowa Franklina
rozszerzenie teorii Bronsteda na rozpuszczalniki nieprotonowe (ciekły NH3, SO2)
rozpuszczalniki niewodne ulegają autodysocjacji z utworzeniem kationu i anionu
kwas - substancja, która zwiększa stężenie charakterystycznego dla rozpuszczalnika KATIONU
zasada - substancja, która zwiększa stężenie charakterystycznego dla rozpuszczalnika ANIONU
reakcja zobojętniania - prowadzi do powstawania soli i odtworzenia rozpuszczalnika
Teoria Lewisa
kwas - substancja, która może przyjąć jedną lub więcej par elektronowych od innego atomu (grupy atomów) z wytworzeniem wiązania koordynacyjnego -AKCEPTOR pary elektronowej, np.:
BCl3,
SO3
kationy metali (im większy ładunek i mniejszy promień tym mocniejszy kwas)
zasada - substancja, która posiada wolną parę elektronową i może ją przekazać - DONOR pary elektronowej, np. NH3, H2O
reakcja zobojętniania - utworzenie wiązania koordynacyjnego kosztem pary elektronowej pochodzącej od zasady (następuje jej uwspólnienie)
Teoria Usanowicza:
kwas - związek chemiczny odszczepiający kation, przyłączający anion lub elektrony
zasada - związek chemiczny przyłączający kation, odszczepiający anion lub elektrony
ROZTWORY BUFOROWE
Roztwory bufrowe - roztwory, które utrzymują poziom pH na określonym, stałym poziomie mimo wprowadzenia do nich niewielkich ilości mocnych kwasów lub zasad bądź też rozcieńczenia roztworu wodą.
Wykorzystanie buforów:
utrzymanie stałego pH roztworu (np. przy wytrącaniu osadów)
uzyskanie całkowitego wytrącenia osadu
zapobiega wytrącaniu się niepożądanych substancji
kolorymetryczne oznaczanie pH roztworu
Skład buforów:
słaby kwas i jego sól z mocną zasadą (np. CH3COOH i CH3COONa)
słaba zasada i jej sól z mocnym kwasem (np. NH3∙H2O i NH4Cl)
Mechanizm działania:
bufor słabego kwasu i jego soli z mocną zasadą:
stała dysocjacji słabego kwasu:
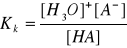
aniony A- pochodzące z dysocjacji soli powodują zmniejszenie dysocjacji słabego kwasu (stężenie H3O+ musi się zmniejszyć aby Kk pozostało stałe - jony te łączą się ze sobą tworząc cząsteczki HA, czyli cofają dysocjację)
[HA] = Ck (stężenie słabego kwasu - bo prawie nic nie dysocjuje)
[A-] = Cs (bo mocna sól prawie całkowicie dysocjuje)
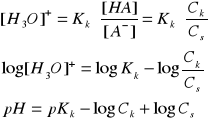
z powyższego wzoru wynika, że pH zależy od stałej dysocjacji słabego kwasu oraz stosunku stężeń tego kwasu i sprzężonej z nim zasady
jeżeli dodamy mocnego kwasu, to jony H3O+ będą łączyły się z anionami A- tworząc cząsteczki HA w skutek czego stosunek [HA]/[A-] zwiększy się nieznacznie, a zmiana ta nie będzie miała wpływu na pH roztworu
jeżeli dodamy mocnej zasady to jony OH- z niej pochodzące przereagują ze słabym kwasem dając jony A- (zmiana stosunku stężeń również będzie zbyt mała by wpłynąć na pH roztworu) OH- + HA ↔ A- + H2O
bufor słabej zasady i jej soli z mocnym kwasem:
stała dysocjacji słabej zasady:
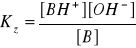
[BH]+ = Cs (praktycznie cała sól dysocjuje)
[B] = Cz (dysocjacja zasady zahamowana przez obecność kationów z soli)
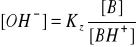
z kolei z równania na iloczyn jonowy wody wyprowadzamy zależność:
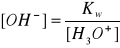
przyrównując dwa powyższe równania otrzymujemy:
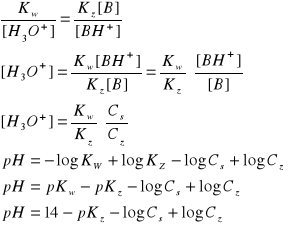
pH roztworu zależy od stałej dysocjacji słabej oraz stosunku stężeń soli i słabej zasady (jego zmiany podczas dodawania niewielkiej ilośc mocnego kwasu lub zasady są nieznaczne i nie mają wpływu na pH)
Zgodnie z teoria Broensteda do obliczania pH buforu można użyć poniższego wzoru:
Rozcieńczenie roztworu buforowego nie wpływa na zmianę jego pH, ponieważ jednocześnie zmniejsza się stężenie soli jak i kwasu/zasady, czyli ich wzajemny stosunek nie ulegnie zmianie.
Wpływ temperatury na pH buforu:
bufor słabego kwasu i jego soli brak
bufor słabej zasady i jej soli następuje zmiana (wartość Kw zależna od temperatury)
Przykłady innych buforów:bufor fosforanowy: NaH2PO4 i NaHPO4:
NaHCO3 i H2CO3:Pojemność buforowa - liczba moli mocnej zasady lub kwasu, która musi być dodana do 1 litra roztworu, aby spowodować zmianę pH o jednostkę.
przy dodawaniu mocnego kwasu/zasady pojemnośc buforowa zmniejsza się (sól zostaje przeprowadzona w słaby kwas lub odwrotnie)
im większe stężenie buforu tym większa jest jego pojemność buforowa, wynika to ze wzoru van Slyke'a:maksymalna wartość pojemności buforowej wynosi: β = 0,58 ∙C
wskazują punkt zobojętnienia, tzw. punkt nasycenia równoważnikowego
dysocjacja wskaźnika:
stała dysocjacji wskaźnika (zależna od temperatury, ale nie od stężeń jonów):
w przypadku wskaźnika KWASOWEGO:
[Ind-] / [HInd] > 10 widoczna barwa jonów wskaźnika
[Ind-] / [HInd] < 0,1 widoczna tylko barwa cząsteczek niezdysocjowanych
stosunek między 0,1 a 10 widoczna barwa pośrednia
jednobarwne
jedna odmiana barwna, druga bezbarwna (np. fenoloftaleina)
stężenie wskaźnika ma duży wpływ na intensywnośc zabarwienia
dwubarwne
2 lub więcej odmian mają zabarwienie (np. oranż metylowy)
w granicach zakresu wskaźnikowego następuje zmiana odcienia zabarwienia pośredniego
odcień zabarwienia zależy w większym stopniu od pH niż stężenia wskaźnika
ftaleina fenolokarbonowa
wzór chemiczny:
pH < 8,1 bezbarwna
8,1<pH<10 różowa
pH>10 buraczkowoczerwona
0,1% roztwór w 70% etanolu
sól sodowa kwasu dimetyloaminoazobenzenosulfonowego)
wzór chemiczny:pH<3,1 czerwono-pomarańczowy (kationy o strukturze chinoidowej)
3,1 < pH < 4,4 cebulkowy
pH > 4,4 żółty (postać azowa - jony)
kationy o strukturze chinoidowej:
0,1% roztwór wodny
wskaźnik zasadowy
sól sodowa kwasu dimetyloaminoazokarbonowegopH < 4,2 czerwona
4,2 < pH < 6,2 pomarańczowa
pH > 6,2 żółta
0,2% roztwór w 90% etanolu
oranż metylowy i indygokarmin (kwas sodowa kwasu indygosulfonowego)
wskaźnik Tashiro (czerwień metylowa i błękit metylenowy)
błękit tymolowy i czerwień krezolowa
fenoloftaleina i zieleń metylowa między pH 8 a 9 (zielony szary szaroniebieski fioletowy)
wskaźnik uniwersalny Bogena (fenoloftaleina + czerwień metylowa + dimetyloaminoazobenzen + błękit bromotymolowy + błękit tymolowy)
papierki lakmusowe
papierki z czerwienią Kongo (do mocnych i średnio mocnych kwasów)
papierki kurkumowe (do mocnych zasad)
papierki z fenoloftaleiną (do mocnych i średnio mocnych zasad)
papierki uniwersalne
papierki lifanowe (do dokładniejszego określania pH)
ujemny - punkt końcowy przed punktem równoważnikowym - otrzymujemy wyniki za małe
dodatni - punkt końcowy po punkcie równoważnikowym - otrzymujemy wyniki za duże
bardzo szybki przebieg reakcji między substancją oznaczaną a wprowadzanym roztworem
przebieg stechiometryczny, zgodny z równaniem
titrant nie wchodzi w reakcje z innymi substancjami obecnymi w roztworze
konieczna obecność wskaźniki umożliwiającego określenie punktu końcowego miareczkowania
Podział według typu reakcji zachodzącej podczas miareczkowania:
alkacymetria - opiera się na reakcjach kwas-zasada
alkalimetria - używamy mianowanego roztworu zasady do oznaczania kwasu
acydymetria - używamy mianowanego roztworu kwasu do oznaczania zasady
kompleksometria - opiera się na tworzeniu trwałych, rozpuszczalnych związków kompleksowych
kompleksonometria - odczynnikiem miareczkującym jest komplekson
oznaczanie cyjanków (Ag+ + 2CN- Ag(CN)2-)
merkurymetria - wykorzystuje tworzenie się kompleksowych związków rtęciowych
precypitomeria (metody wytrąceniowe) - jony łączą się w związki trudno rozpuszczalne
argentometria - opiera się na tworzeniu trudno rozpuszczalnych związków srebra
redoksymetria - wykorzystuje reakcje utleniania-redukcji
nadmanganianometria - jako utleniacz służy KMnO4
cerometria - Ce(SO4)2
chromianometria - K2Cr2O7 lub K2CrO4
bromianometria - KBrO3
tytanometria - reduktor: związek tytanu trójwartościowego
jodometria - stosuje się roztwory utleniaczy (I2 lub KIO3) oraz reduktorów (Na2S2O3, kwas arsenawy)
Podział według sposobu indykacji punktu równoważnikowego
metody z indykacją wzrokową
metody z indykacją instrumentalną:
potencjometria
konduktometria
miareczkowanie amperometryczne
miareczkowanie fotokolorymetryczne
Podział według sposobu przeprowadzania miareczkowania:
miareczkowanie bezpośrednie
oznaczany składnik miareczkuje się roztworem mianowanym danego odczynnika;
potrzebny tylko 1 roztwór mianowany
miareczkowanie odwrotne -
do oznaczanego składnika dodaje się mianowany roztwór odczynnika w nadmiarze, a następnie odmiareczkowuje się nie zużytą część odczynnika za pomocą innego roztworu mianowanego
potrzebne 2 roztwory mianowane
stosowany jeżeli reakcja zachodzi powoli (red-oks, kompleksowanie) lub gdy trudno dobrać odpowiedni wskaźnik dla miareczkowania bezpośredniego
miareczkowanie podstawieniowe - miareczkuje się podstawnik, a nie substancję oznaczaną
PODSTAWNIK - produkt reakcji składnika oznaczanego i jakiegokolwiek odczynnika
np. oznaczając jony żelazowe, miedziowe metodą jodometryczną miareczkujemy jod, który wydzielił się podczas reakcji jodku potasu z oznaczaną substancją, a nie samą tą substancję
miareczkowanie pośrednie - chcąc oznaczyć anion/kation dla którego nie możemy znaleźć odczynnika miareczkującego wytrącamy go w postaci osadu, a następnie rozpuszczamy i miareczkujemy kation/anion z którym interesujący nas jon jest związany
ściśle określony wzór chemiczny odpowiadający rzeczywistości
łatwość otrzymywania, suszenia, oczyszczania i przechowywania w stanie czystym
BRAK higroskopijności
nie ulega zmianom na powietrzu (wietrzeniu, utlenieniu)
czystość
reakcja z roztworem mianowanym przebiega ściśle stechiometrycznie
ma możliwie dużą masę (w celu zmniejszenia błędu przy ważeniu)
Miareczkowanie mocnego kwasu mocną zasadą
:osiągnięcie punktu równoważnikowego jest równoznaczne z rzeczywistym zobojętnieniem roztworu (pH = 7)
skok miareczkowania - gwałtowna zmiana wartości pH roztworu w pobliżu punktu równoważnikowego spowodowana dodaniem 1 kropli roztworu mianowanego (większy dla roztworów stężonych)
krzywa miareczkowania - wykres zależności pH roztworu od ilości zużytego roztworu mianowanego
procent zmiareczkowania - zużyty procent całkowitej ilości roztworu mianowanego potrzebny do nasycenia równoważnikowego
należy tak dobrać wskaźnik, aby zmiana barwy nastąpiła w tym samym zakresie pH co skok miareczkowania
Miareczkowanie słabego kwasu mocną zasadą:
w punkcie równoważnikowym odczyn roztworu jest zasadowy, ponieważ słaba zasada sprzężona z kwasem i powstająca w wyniku jego reakcji z mocną zasadą reaguje z wodą dając jony OH-krzywa miareczkowania jest bardziej stroma zmniejszanie się stężenia H+ spowodowane jest nie tylko ich zobojętnianiem przez OH-, ale także cofaniem się dysocjacji kwasu octowego w miarę zwiększania się stężenia CH3COO- pochodzących z soli
stosunkowo niewielki skok miareczkowania (oranż nie może być wskaźnikiem)
CH3COOH i NaOH
Miareczkowanie słabej zasady mocnym kwasem:
w punkcie równoważnikowym odczyn roztworu jest kwasowy, ponieważ w reakcji słabej zasady z mocnym kwasem powstaje słaby kwas, który ulega protolizie z wodą z wytworzeniem jonów H3O+krzywa miareczkowania podobna jak wyżej ale o odwrotnym kierunku
nie można zastosować fenoloftaleiny (najlepiej czerwień metylową)
amoniak i HCl
Miareczkowanie kwasów i zasad wieloprotonowych:
krzywa miareczkowania posiada tyle punktów równoważnikowych ilu protonowy jest kwas
jeżeli pomiędzy dwoma pośrednimi punktami równoważnikowymi jest mała różnica to nie ma wyraźnego skoku miareczkowania i potrzeba bardzo specyficznego wskaźnika (o wąskim zakresie zmiany barwy)
H3PO4 i NaOH
H3PO4 może być miareczkowany jako kwas jedno- lub dwuzasadowy (wyraźne skoki miareczkowania)brak wyraźnego skoku przy III PR (miareczkowanie bezpośrednie jest niemożliwe)
Substancje do nastawiania miana roztworu HCl:bezwodny Na2CO3:
podczas miareczkowania wytwarza się kwas węglowy, który zakwasza środowisko - niepewność przy ustalaniu PK pod koniec miareczkowania roztwór ogrzewamy do wrzenia aby pozbyć się CO2
boraks - czteroboran sodowy: Na2B4O7 ∙ 10 H2OH3BO3 zakwasza roztwór do pH ok. 5 wskaźnik = czerwień metylowa
pozostawianie suchego boraksu na powietrzu jest niebezpieczne, ponieważ przyłącza on CO2, który później z wodą tworzy kwas węglowy (mocniejszy od borowego), który dalej reaguje z boraksem dając kwas borowy i węglan sodowy
szczawian sodu po rozłożeniu w podwyższonej temperaturze na sodę: Na2C2O4 Na2CO3 + CO
wodorowęglan potasowy (KHCO3)tlenek rtęciowy HgO
czteroboran potasowy K2B4O7 ∙ 4 H2O
ustalić jodometrycznie na podstawie reakcji: (dla roztworów b. rozcieńczonych)
oznaczenie wagowe - wytrącenie HCl w postaci AgCl
Substancje do nastawiania miana roztworu NaOH:
kwas solny
wodoroftalan potasowy - C6H4(COOH)COOK - miareczkowanie wobec fenoloftaleiny lub błękitu tymolowego
kwas benzoesowy - C6H5COOH - używa się roztworu kwasu w etanolu i miareczkuje wobec fenoloftaleiny
kwas szczawiowy (COOH)2∙2H2O - wobec fenoloftaleiny
wodorojodan potasowy KH(IO3)2
wodorowinian potasu COOH ∙ CHOH ∙ CHOH ∙ COOK - wobec fenoloftaleiny na gorąco
siarczan hydrazyny - N2H4 ∙ H2SO4
Trwałość mianowanego roztworu NaOH:
zmiana miana spowodowana pochłanianiem CO2 z powietrza oraz rozpuszczaniem szkła
rozpuszczanie szkła:
produkty: krzemionka (wytrąca się jako kłaczkowaty osad), Ca(OH)2 (pozostaje w roztworze lub wytrąca się jako CaCO3), NaOH (pozostaje w roztworze i zwiększa miano)
przechowywanie roztworu w odpowiednim szkle, wyparafinowanych butlach lub butlach polietylenowych
pochłanianie CO2 zanieczyszczenie roztworu Na2CO3: 2NaOH + CO2 Na2CO3 + H2O
miareczkowanie z oranżem - nie ma wpływu (1 mol węglanu otrzymuje się z 2 moli NaOH; zobojętnia on 2 mole HCl czyli tyle samo ile zobojętniłyby 2 mole NaOH)
miareczkowanie z fenoloftaleiną zmniejszenie molowości roztworu (zobojętnienie tylko do NaHCO3 - 1 mol Na2CO3 zobojętnia 1 mol HCl a nie 2)
nie wlewać roztworu z biurety do butli
otwierać tylko wtedy kiedy trzeba
zabezpieczyć od góry rurką z wapnem sodowanym
Oznaczanie NaOH:
wskaźnik: oranż metylowy
titrant: roztwór HCl
zmiana barwy: żółta cebulkowa
Oznaczanie H2SO4:
wskaźnik: oranż metylowy
titrant: NaOH
zmiana barwy: cebulkowa żółta
jeżeli NaOH jest wolny od węglanu to można miareczkować wobec fenoloftaleiny do pojawienia się słaboróżowego zabarwienia (nie znikającego po pół minuty)
Oznaczanie CH3COOH:
rozcieńczamy świeżo przegotowaną wodą destylowaną
wskaźnik: fenoloftaleina
titrant: NaOH (bez węglau)
do jasnoróżowego zabarwienia
Oznaczanie Na2CO3 obok NaOH
Oznaczanie NaHCO3 obok Na2CO3
Oznaczenie soli amonowych metodą formalinową:
zobojętnić formaldehyd (zwykle jest zakwaszany kwasem mrówkowym) dodawać NaOH dopóki nie będzie jasnoróżowego zabarwienia fenoloftaleiny
titrant: roztwór NaOH (bez węglanów)
wskaźnik: fenoloftaleina
do jasnoróżowego zabarwienia odczekać minutę dodać 5 ml formaldehydu i jeżeli znowu się odbarwi to jeszcze raz do zabarwienia
Oznaczanie soli amonowych metodą destylacyjną
do roztworu soli amonowej dodać w nadmiarze mocnej zasady i podgrzać:wydzielony amoniak absorbuje się w znanej ilości H2SO4:
nadmiar H2SO4 miareczkować roztworem NaOH
znając objętość kwasu wiemy ile było amoniaku i możemy obliczyć ile było soli
miano kwasu nadchlorowego nastawiamy na wodoroftalan potasu rozpuszczony w bezwodnym kwasie octowym wobec fioletu krystalicznego do zmiany barwy z niebieskiej na niebieskozielonąmiareczkować roztwór aniliny w bezwodnym kwasie octowym
- dodatek H+ przesuwa równowagę w lewo
- dodatek OH- przesuwa równowagę w prawo
- dodatek H+ równowaga w lewo
- dodatek OH- równowaga w prawo
lub
dCz - nieskończenie mały przyrost stężenia zasady
d(pH) - nieskończenie mały przyrost pH
ΔB - dodana ilość mocnej zasady (w molach na litr)
ΔpH - skończony przyrost pH
Jeżeli do roztworu dodano kwas to we wzorze należy umieścić minus (przed ΔB i ΔpH)
Kk - stała dysocjacji kwasu
C - stężenie ogólne buforu
WSKAŹNIKI pH
Wskaźniki pH - związki, które mają właściwość zmiany barwy w zależności od pH roztworu, nazywamy wskaźnikami pH. Są słabymi kwasami lub zasadami organicznymi, których jony mają inne zabarwienie niż cząsteczki niezdysocjowane.
Zastosowanie:
Mechanizm działania:
HInd, IndOH - cząsteczki niezdysocjowane
Ind+, Ind- - jon wskaźnika
- dodatek H+ przesuwa równowagę w lewą stronę (zmniejsza się stężenie jonów Ind- co hamuje dysocjację)
- dodatek OH- przesuwa równowagę w prawą stronę (OH- wiążą H+ w wodę co przyspiesza dysocjację)
- barwa jonów Ind- jest inna niż cząsteczek niezdysocjowanych, więc można określić środowisko (kwasowe/zasadowe)
- barwa wskaźnika zależy od stosunku stężeń obu jego form:
Jeżeli [H+] = KHInd to [Ind-] = [HInd] wskaźnik zdysocjował w połowie i ma barwę pośrednią.
Wykładnik wskaźnika - pH, wobec którego obie formy wskaźnika występują w roztworze w równych ilościach.
Oko ludzkie zauważa zmianę barwy, jeżeli jedna z barw dominuje nad drugą o ok. 10%. Dlatego, jeżeli:
Zakres wskaźnikowy - przedział pH w którym zachodzą widoczne zmiany barwy roztworu wskaźnika.
Podział wskaźników:
FENOLOFTALEINA
ORANŻ METYLOWY (metylooranż, heliantyna)
CZERWIEŃ METYLOWA
Wskaźniki mieszane - mieszanina dwóch wskaźników albo wskaźnika z barwnikiem. Zawężają zakres pH w jakim zachodzi zmiana barwy. Przykłady:
- zasadowy: żółtozielony
- kwasowy: fioletowy
- przy pH = 4 - szary
- pH = 5,2 - czerwonofioletowy
- pH = 5,4 - brudnoniebieski
- pH = 5,6 - brudnozielony
- między pH 8,2 a 8,4 różowy fioletowy
- pH = 2 czerwony
- pH = 4 pomarańczowy
- pH = 6 żółty
- pH = 8 zielony
- pH = 10 niebieski
Papierki wskaźnikowe - paski bibuły nasączone odpowiednimi wskaźnikami, służące do przybliżonego określania pH i jakościowego wykrywania kwasów i zasad
ANALIZA MIARECZKOWA
Analiza miareczkowa - do roztworu zawierającego oznaczaną substancję wprowadza się niewielkimi porcjami równoważną chemicznie ilość odczynnika w postaci roztworu mianowanego (titrantu), tzn. roztworu o dokładnie znanym stężeniu. Zawartość oznaczanej substancji (w gramach) oblicza się na podstawie dokładnie zmierzonej objętości titrantu.
Punkt równoważnikowy (nasycenia równoważnikowego) - moment, w którym została doprowadzona ilość odczynnika równoważna chemicznie ilości składnika oznaczanego.
Punkt końcowy miareczkowania - moment, w którym wskaźnik zmienia barwę. Powinien pokrywać się z punktem równoważnikowym. W rzeczywistości jest inaczej.
Błąd miareczkowania - różnica pomiędzy punktem końcowym miareczkowania a punktem równoważnikowym.
Cechy reakcji używanych w analizie miareczkowej:
KLASYFIKACJA METOD MIARECZKOWANIA
METODY OKSYDYMETRYCZNE - titrantem jest roztwór utleniacza:
METODA REDUKTOMETRYCZNA - titrantem jest roztwór reduktora:
METODA OKSYDY- REDUKTOMETRYCZNA:
ROZTWÓR MIANOWANY - roztwór o dokładnie znanym stężeniu przedstawiony z dokładnością czwartego miejsca po przecinku.
Miano - stężenie roztworu mianowanego wyrażone liczbą gramów danej substancji zawartej w 1 ml roztworu lub też liczbą gramów substancji oznaczanej odpowiadającej 1 ml roztworu. Najczęściej wyraża się je molowością roztworu mianowanego.
Substancja podstawowa (wzorcowa) - związek chemiczny, którego roztwór jest miareczkowany roztworem mianowanym w celu wyznaczenia jego miana.
Cechy substancji podstawowej:
ALKACYMETRIA
MIANOWANE ROZTWORY HCl i NaOH
a następnie wydzielony jod odmiareczkować mianowanym roztworem tiosiarczanu sodowego (miareczkowanie podstawnikowe):
OZNACZENIA ALKACYMETRYCZNE:
METODA WARDERA |
METODA WINKLERA |
1) miareczkowanie kwasem solnym wobec fenoloftaleiny (zobojętniamy oba związki jednocześnie) 2) odbarwienie fenoloftaleiny = zobojętnienie całego NaOH i połowy Na2CO3 NaOH + HCl NaCl + H2O Na2CO3 + HCl NaHCO3 + NaCl 3) dalsze miareczkowanie kwasem solnym wobec oranżu metylowego 4) zmiana żółty cebulkowy = zobojętnienie drugiej połowy Na2CO3 NaHCO3 + HCl NaCl + H2O + CO2
a - objętość HCl zużyta wobec fenoloftaleiny b - objętość HCl zużyta wobec oranżu zobojętnienie NaOH = a - b zobojętnienie Na2CO3 = 2b
- dobre wyniki tylko jeśli Na2CO3 jest znacznie mniej niż NaOH - nie zostawiać roztworu w otwartej kolbie (pochłanianie CO2 - więcej węglanu kosztem NaOH) |
PEWNIEJSZA 1) pierwszą próbkę miareczkujemy HCl wobec oranżu metylowego do barwy cebulkowej (całkowite zobojętnienie NaOH i Na2CO3) - zużywamy a ml kwasu 2) do drugiej próbki dodajemy nadmiar BaCO3 - wytrącenie jonów CO32- 3) w roztworze drugiej próbki zostaje NaOH, który miareczkujemy kwasem solnym wobec fenoloftaleiny - zużywamy b ml kwasu
zobojętnienie NaOH = b zobojętnienie Na2CO3 = a - b
Nie mieszać zbyt energicznie (zapobieganie pochłonięciu CO2, który wytrąci się jako BaCO3 - ubytek węglanu) Nie dodawać kwasu dużymi porcjami - zużyje się go na rozkład BaCO3
|
METODA WARDERA |
METODA WINKLERA |
1) miareczkowanie HCl wobec fenoloftaleiny 2) odbarwienie = zobojętnienie połowy węglanu (HCl najpierw reaguje z CO32-) Na2CO3 + HCl NaHCO3 + NaCl (w roztworze mamy już tylko węglan) 3) miareczkowanie z oranżem metylowym 4) żółty cebulkowy = zobojętnienie NaHCO3
a - objętość HCl zużyta wobec fenoloftaleiny b - objętość HCl zużyta wobec oranżu zobojętnienie węglanu - 2a zobojętnienie wodorowęglanu b - a |
1) pierwszą próbkę miareczkujemy wobec oranżu metylowego = zobojętnienie wszystkiego - a ml 2) do drugiej próbki dodajemy NaOH (b ml) w nadmiarze (przeprowadzamy wodorowęglan w węglan) 3) wytrącamy węglan w postaci BaCO3 4) odmiareczkowanie nadmiaru NaOH wobec fenoloftaleiny (c ml)
zobojętnienie wodorowęglanu b - c zobojętnienie węglanu: a - (b - c) - od objętości zużytej do zobojętnienia wszystkiego odejmujemy to co zużyto na zobojętnienie samego wodorowęglanu czyli b - c |
Reakcja jonów amonowych z aldehydem mrówkowym w wyniku czego powstaje urotropina i równoważna (do jonów amonowych) ilość jonów H+ (tyle ile powstanie H+ tyle było jonów amonowych)
2 NH3 + H2SO4 (NH4)2SO4
MIARECZKOWANIE ALKACYMETRYCZNE W ŚRODOWISKU BEZWODNYM
Stosowane do oznaczania kwasów i zasad, które w wodzie wykazują zbyt słabą dysocjację by można było je oznaczyć tradycyjną metodą miareczkowania alkacymetrycznego.
ROZPUSZCZALNIKI ORGANICZNE |
||
aprotolityczne |
amfiprotolityczne (znaczny moment dipolowy) |
|
brak lub znikomy moment dipolowy - nasycone węglowodory aromatyczne - 1,4-dioksan - CCl4, CHCl3 - chlorobenzen BRAK DYSOCJACJI kwasów i zasad, ponieważ rozpuszczalniki te nie tworzą jonów |
- alkohole - aminy - niższe kwasy tłuszczowe biorą udział w reakcji zobojętniania dobre ośrodki dysocjacji |
|
|
protonofilne - większe powinowactwo do protonów (ciekły NH3, NH2∙NH2, aminy) |
protonogenne - łatwo oddają protony (bezwodny kwas octowy, mrówkowy, siarkowy, ciekły H2F2) |
Metody: potencjometryczne, konduktometryczna, amperometryczna
Stosowane wskaźniki: fiolet metylowy i fiolet krystaliczny
Zalety: prostota, wygoda, duża dokładność oznaczeń, szybkość
Miareczkowanie aniliny kwasem nadchlorowym
- titrant: kwas nadchlorowy
- wskaźnik: fiolet krystaliczny
- zmiana barwy: niebieski niebieskozielony
![]()
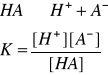
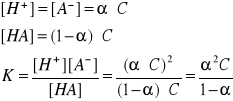
![]()
![]()
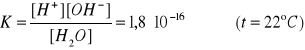
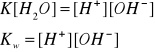
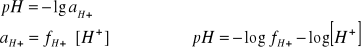
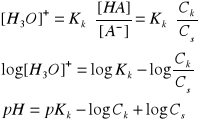
Wyszukiwarka
Podobne podstrony:
Precypitometria i kompleksometria (1), rok numero deux, chemia analityczna, I semestr
pytania organiczna 2. rok, rok numero deux, chemia organiczna, koła ze skryptu
WF-Zagadnienia Egz-22.05.2014, rok numero uno, chemia nieorganiczna
WF-Irok-Tok-09.12.2013, rok numero uno, chemia nieorganiczna
sprawozdanie 5 - miareczkowanie NaOH, Studia, I rok, II semstr, Chemia analityczna, sprawozdania
narzady zmyslow, rok numero deux, fizjologia, semy+ćwiki
labolatorium 4 - indetyfikacja ktionow i anionow, Studia, I rok, II semstr, Chemia analityczna, spra
Alkacymetria1, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia analityczna, 1.Alkacymetria
Alkacy redoksy, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia analityczna, 1.Alkacymetria
Podział mieszanin chemicznych, Science ^^, Farmacja, 1 rok, Chemia, ćwiczenia, Semestr II
Zasady nazewnictwa wybranych klas zwi-zk-w organicznych, STUDIA PŁ, TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIA
WSPOLCZESNE WYZWANIA CHEMII ANALITYCZNEJ, Chemia środków bioaktywnych i kosmetyków, Chemia analitycz
ĆWICZENIE 9, Studia TOŚ, chemia analityczna-labor. semestr III
ZAGADNIENIA TEORETYCZNE ĆW.7-8, Studia TOŚ, chemia analityczna-labor. semestr III
pytania do kolokwium z analizy wagowej i alkacymetrii, chemia analityczna
EGZAMIN TESTOWY Z CHEMII ANALITYCZNEJ SEMESTR III-1, PK, chemia, analityczna
kolos 2, studia, studia I rok, z dziennych od Majki, drugi semestr, chemia, chemiczna analiza instru
cwiczenie11, Płyta farmacja Poznań, II rok, chemia analityczna, ćwiczenia
więcej podobnych podstron