Ćwiczenie nr 5
Temat: Pomiar pH metodą potencjometryczną
Rok II
Grupa
Zespół:
I. Cel ćwiczenia:
Teoretyczne i praktyczne zapoznanie się z metodą potencjometryczną pomiaru pH.
Sporządzenie krzywych miareczkowania mocnego kwasu mocną zasadą i słabego kwasu mocną zasadą.
Wyznaczenie punktu równoważnikowego metodą analityczną.
Obliczenie wartości pH roztworu w czasie miareczkowania mocnego kwasu mocną zasadą.
II. Część teoretyczna:
Pojęcie pH zostało wprowadzone do chemii przez Søren Sørensen w 1909 r jako miara kwasowości roztworów i oznaczało pierwotnie ujemny logarytm ze stężenia jonów wodorowych:
pH = -log c[H+]
gdzie cH+ oznacza stężenie molowe (mol/dcm3) jonów wodorowych w roztworze.
Obecnie pH określa się w odniesieniu do aktywności jonów wodorowych, pojęcia wprowadzonego przez G. N. Lewisa,
![]()
gdzie fH+ oznacza współczynnik aktywności jonów wodorowych.
Miareczkowanie - to chemiczna technika analizy ilościowej polegająca na dodawaniu roztworu titranta z biurety kroplami do roztworu zwanego analitem. Pomiar objętości wkroplonego titrantu, który reaguje ilościowo z oznaczaną substancją, umożliwia określenie dokładnego stężenia określonego związku chemicznego w analicie.
Miareczkowanie potencjometryczne - polega na pomiarze zmian SEM ogniwa złożonego z elektrody wskaźnikowej i elektrody odniesienia w funkcji dodanego titranta.
Przykładem może być potencjometryczne miareczkowanie kwasu zasadą. Analizę przeprowadza się przez dodanie małymi porcjami zasady (titranta) do badanej próbki mieszanej np. przy użyciu mieszadła magnetycznego lub zwykłej pałeczki szklanej. Pomiar prowadzi się wobec elektrody pH-czułej (np. elektrody szklanej) jako elektrody wskaźnikowej. Uzyskuje się wynik w postaci zależności SEM elektrody pH od objętości dodanego titranta. Taka zależność może zostać łatwo przekształcona w zależność pH od objętości dodanego titranta.
Pomiary pH metodą potencjometryczną nie pozwalają na określenie ani stężenia jonów wodorowych, ani ich aktywności. Wynika to stąd, że SEM ogniwa zależy nie tylko od potencjałów obu elektrod, lecz również od potencjału dyfuzyjnego, którego wielkość w warunkach pomiaru pH jest bliżej nieokreślona.
W metodzie potencjometrycznej pomiar pH sprowadza się do wyznaczenia SEM odpowiedniego ogniwa, w którym potencjał jednej elektrody nie zależy od aktywności jonów wodorowych, natomiast potencjał drugiej elektrody zmienia się proporcjonalnie do pH. Pierwszą z tych elektrod przyjęto nazywać elektrodą porównawczą lub odniesienia, drugą - wskaźnikową lub pomiarową. Jako elektrody porównawczej używa się najczęściej elektrody kalomelowej, elektrody chlorosrebrowej oraz standardową elektrodę wodorową. Wśród elektrod, których potencjał zależy od aktywności jonów wodorowych, należy wymienić elektrody: antymonową, chinhydronową i szklaną.
Pomiary pH wykonuje się najczęściej przy pomocy kombinowanej elektrody szklanej, w której elektroda szklana i elektroda odniesienia znajdują się w jednej obudowie, przy czym jako elektrody porównawczej używa się zwykle elektrody chlorosrebrowej. Elektroda chlorosrebrowa jest to metaliczne srebro (w formie drutu lub płytki) pokryte warstwą chlorku srebra AgCl(s) zanurzonego w nasyconym roztworze chlorku potasu. Jej potencjał standardowy związany z reakcją elektrodową: ![]()
Ważnym zastosowaniem pH-metrów jest wykorzystanie ich do miareczkowania potencjometrycznego. Krzywe miareczkowania, będące wykresami zmian pH roztworu w funkcji objętości odczynnika miareczkującego, mają kształt litery S. Punkt równoważnikowy (P.R.) określa maksymalna wartość nachylenia powyższej krzywej tj. ![]()
. Punkt ten można wyznaczyć graficznie lub analitycznie.
III. Wykonanie ćwiczenia:
Ćwiczenie składa się z dwóch części. W pierwszej należy wyznaczyć pH kilku roztworów buforowych oraz roztworów buforowych, do których dodano niewielkie ilości mocnego kwasu lub zasady. W drugiej części na podstawie pomiarów pH w trakcie miareczkowania mocnego kwasu mocną zasadą, i słabego kwasu mocną zasadą należy sporządzić odpowiednie krzywe miareczkowania.
IV. Opracowanie wyników pomiarów:
Wyniki pomiarów i obliczeń dla roztworów buforowych
Stężenie CH3COOH, c m |
Stężenie CH3COONa, c0 M |
Stężenie HCl, M |
Stężenie NaOH, M |
pH obliczone |
PH zmierzone |
0.1 |
0.1 |
|
|
4,76 |
4,59 |
0.2 |
0.1 |
|
|
4,46 |
4,03 |
0.4 |
0.1 |
|
|
4,16 |
3,77 |
0.1 |
0.1 |
0.03 |
|
4,49 |
4,24 |
0.1 |
0.1 |
|
0.03 |
5,03 |
4,84 |
Wartości pH badanych roztworów buforowych obliczamy korzystając ze wzoru:
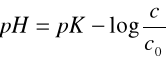
gdzie pK = -log(1.75*10-5), c - stężenie kwasu octowego, c0 - stężenie octanu sodu;
5ml 0,1mol CH3COOH, 5ml 0,1mol CH3COONa, 40ml H2O
![]()
10ml 0,1mol CH3COOH, 5ml 0,1mol CH3COONa, 35ml H2O
![]()
20ml 0,1mol CH3COOH, 5ml 0,1mol CH3COONa, 25ml H2O
![]()
4. 5ml 0,1mol CH3COOH, 5ml 0,1mol CH3COONa, 3ml 0,01 HCl, 37ml H2O
![]()
5. 5ml 0,1mol CH3COOH, 5ml 0,1mol CH3COONa, 3ml 0,01 NaOH, 37ml H2O
![]()
W roztworach buforowych stosujemy słabe kwasy, np. octowy, które nie w pełni dysocjują:
CH3COOH ↔ CH3COO- + H+
oraz soli mocnej zasady, np. sodowej, użytego słabego kwasu, która dysocjuje całkowicie:
CH3COONa → CH3COO- + Na+
Wnioski:
Na podstawie zmierzonych pH dla roztworów buforowych, oraz buforów do których dodano niewielkie ilości mocnego kwasu lub zasady wywnioskowaliśmy, że im większe stężenie kwasu (i jonów wodorowych), tym niższe pH. Natomiast gdy dodamy niewielką ilość mocnego kwasu wartość pH ulegnie obniżeniu. Natomiast gdy dodamy niewielką ilość mocnej zasady wówczas wartość pH ulegnie zwiększeniu. Dodanie do roztworów buforowych niewielkich ilości mocnych kwasów lub mocnych zasad nie zmienia pH roztworu w tak znaczny sposób jak miałoby to miejsce w czasie dodawania ich do czystej wody.
Dzieje się tak ponieważ mocny kwas reaguje z kationem sodu ze zdysocjowanego octanu sodu wypierając słabszy kwas, który słabiej dysocjuje:
CH3COO- + Na+ + HCl → Na+ + Cl- + CH3COOH
a w przypadku dodania mocnej zasady reaguje z nią zdysocjowana część słabego kwasu:
CH3COO- + H+ + NaOH → CH3COO- + Na+ + H2O
Wyniki miareczkowania kwasu solnego i octowego przy pomocy 0.1 M NaOH
miareczkowanie kwasu solnego |
|
|
|
||
Lp. |
V NaOH [cm3] |
pH |
dV |
dpH |
dpH/dV |
1 |
0 |
1,03 |
|
|
|
2 |
5 |
1,08 |
5 |
0,05 |
0,01 |
3 |
10 |
1,11 |
5 |
0,03 |
0,006 |
4 |
15 |
1,14 |
5 |
0,03 |
0,006 |
5 |
20 |
1,18 |
5 |
0,04 |
0,008 |
6 |
25 |
1,22 |
5 |
0,04 |
0,008 |
7 |
30 |
1,47 |
5 |
0,25 |
0,05 |
8 |
35 |
1,81 |
5 |
0,34 |
0,068 |
9 |
38 |
2,09 |
3 |
0,28 |
0,093333 |
10 |
39 |
2,28 |
1 |
0,19 |
0,19 |
11 |
40 |
2,56 |
1 |
0,28 |
0,28 |
12 |
40,2 |
2,69 |
0,2 |
0,13 |
0,65 |
13 |
40,4 |
2,81 |
0,2 |
0,12 |
0,6 |
14 |
40,6 |
2,37 |
0,2 |
-0,44 |
-2,2 |
15 |
40,8 |
3,23 |
0,2 |
0,86 |
4,3 |
16 |
41 |
3,71 |
0,2 |
0,48 |
2,4 |
17 |
41,2 |
5,79 |
0,2 |
2,08 |
10,4 |
18 |
41,4 |
7,4 |
0,2 |
1,61 |
8,05 |
19 |
41,6 |
10,01 |
0,2 |
2,61 |
13,05 |
20 |
41,8 |
10,66 |
0,2 |
0,65 |
3,25 |
21 |
42 |
10,96 |
0,2 |
0,3 |
1,5 |
22 |
42,2 |
11,19 |
0,2 |
0,23 |
1,15 |
Zachodzi tu reakcja zobojętniania:
HCl + NaOH → NaCl + H2O
Jonowo
H+ + Cl- + Na+ + OH- → Na+ + Cl- + H2O
miareczkowanie kwasu octowego 0,1 M NaOH |
|
||||
Lp. |
V NaOH [cm3] |
pH |
dV |
dpH |
dpH/dV |
1 |
0 |
2,8 |
|
|
|
2 |
5 |
3,71 |
5 |
0,91 |
0,182 |
3 |
10 |
4,15 |
5 |
0,44 |
0,088 |
4 |
15 |
4,44 |
5 |
0,29 |
0,058 |
5 |
20 |
4,71 |
5 |
0,27 |
0,054 |
6 |
25 |
5,03 |
5 |
0,32 |
0,064 |
7 |
28 |
5,3 |
3 |
0,27 |
0,09 |
8 |
30 |
5,46 |
2 |
0,16 |
0,08 |
9 |
30,2 |
5,5 |
0,2 |
0,04 |
0,2 |
10 |
30,4 |
5,52 |
0,2 |
0,02 |
0,1 |
11 |
30,6 |
5,54 |
0,2 |
0,02 |
0,1 |
12 |
30,8 |
5,58 |
0,2 |
0,04 |
0,2 |
13 |
31 |
5,61 |
0,2 |
0,03 |
0,15 |
14 |
31,2 |
5,64 |
0,2 |
0,03 |
0,15 |
15 |
31,4 |
5,66 |
0,2 |
0,02 |
0,1 |
16 |
31,6 |
5,71 |
0,2 |
0,05 |
0,25 |
17 |
31,8 |
5,74 |
0,2 |
0,03 |
0,15 |
18 |
32 |
5,79 |
0,2 |
0,05 |
0,25 |
19 |
32,2 |
5,82 |
0,2 |
0,03 |
0,15 |
20 |
32,4 |
5,87 |
0,2 |
0,05 |
0,25 |
21 |
32,6 |
5,9 |
0,2 |
0,03 |
0,15 |
22 |
32,8 |
5,95 |
0,2 |
0,05 |
0,25 |
23 |
33 |
6,01 |
0,2 |
0,06 |
0,3 |
24 |
33,2 |
6,08 |
0,2 |
0,07 |
0,35 |
25 |
33,4 |
6,14 |
0,2 |
0,06 |
0,3 |
26 |
33,6 |
6,24 |
0,2 |
0,1 |
0,5 |
27 |
33,8 |
6,31 |
0,2 |
0,07 |
0,35 |
28 |
34 |
6,43 |
0,2 |
0,12 |
0,6 |
29 |
34,2 |
6,58 |
0,2 |
0,15 |
0,75 |
30 |
34,4 |
6,77 |
0,2 |
0,19 |
0,95 |
31 |
34,6 |
7,11 |
0,2 |
0,34 |
1,7 |
32 |
34,8 |
8,08 |
0,2 |
0,97 |
4,85 |
33 |
35 |
10,16 |
0,2 |
2,08 |
10,4 |
34 |
35,2 |
10,82 |
0,2 |
0,66 |
3,3 |
35 |
35,4 |
11,09 |
0,2 |
0,27 |
1,35 |
36 |
35,6 |
11,26 |
0,2 |
0,17 |
0,85 |
Zachodząca reakcja zobojętniania:
CH3COOH + NaOH → CH3COONa + H2O
Jonowo
CH3COO- + H+ + Na+ + OH- → CH3COO- + Na+ + H2O
Z danych otrzymanych z doświadczenia wykreślamy dwie krzywe miareczkowania.
Metoda pochodnej. W tej metodzie oblicza się przyrosty pH przypadające na jednostkę objętości dodanego odczynnika. ![]()
Otrzymuje się w ten sposób wykres którego maksimum zrzutowane na oś odciętych wyznacza objętość odczynnika odpowiadającą PK miareczkowania.
Punkt końcowy miareczkowania dla mocnego kwasu wyniósł 41,6 cm3 NaOH, przy pH=7,11 a dla słabego kwasu 35 cm3 NaOH, przy pH=8,08 . Różnica względem teoretycznej objętości titranta przy miareczkowaniu HCl może być spowodowana niedokładnym odmierzeniem ilości kwasu, zanieczyszczeniem kwasu w słoju, z którego byłą pobierana próbka lub niedokładnymi wskazaniami pH-metru.
Z na podstawie obliczeń wykonaliśmy wykres teoretycznej krzywej miareczkowania 40cm3 0,1 M kwasu chlorowodorowego. Przy obliczeniach pH powyżej 7 skorzystaliśmy z iloczynu jonowego wody.
Teoretyczna krzywa miareczkowania mocnego kwasu mocną zasadą
V. Wnioski:
Dzięki temu doświadczeniu poznaliśmy zasady pomiaru pH metodą potencjometryczną. Również ćwiczenie pozwoliło nam utrwalić zasady miareczkowania alkacymetrycznego. W pierwszej części ćwiczenia wyznaczaliśmy pH kilku roztworów buforowych oraz takich buforów do których zostały dodane mocne kwasy lub zasady, co pozwoliło nam przypomnieć zasadę działania buforów. Druga część zadania polegała na miareczkowaniu mocnego kwasu mocną zasadą i słabego kwasu mocną zasadą. Na podstawie danych wyznaczyliśmy krzywe miareczkowania. Do wykonania tych krzywych skorzystaliśmy z dwóch metod: graficznej i analitycznej. Za ich pomocą wyznaczyliśmy punkty końcowe miareczkowania. Obie te metody dały nam przybliżoną objętość NaOH w której następował PK. Przyczyny różnic między teorią a praktyką zostały wymienione wyżej. Na podstawie ćwiczenia możemy wywnioskować, iż metoda miareczkowania potencjometryczna jest metodą dość dokładną. Dokładność ta jest tym większa im podczas miareczkowania stosujemy mniejsze porcje dodawanego odczynnika. Uzyskuje się przy tym więcej punktów na wykresie co powoduje, że punkt końcowy miareczkowania jest wyznaczony z większą dokładnością, a przebieg krzywej jest obarczony mniejszym błędem.
V NaOH [cm3] |
Ilość jonów H+ w r-rze |
V r-ru VHCl+VNAOH |
Stężenie H+ mol/dm3 |
pH |
0 |
0,004 |
40 |
0,1 |
1,00 |
5 |
0,0035 |
45 |
0,077778 |
1,11 |
10 |
0,003 |
50 |
0,06 |
1,22 |
15 |
0,0025 |
55 |
0,045455 |
1,34 |
20 |
0,002 |
60 |
0,033333 |
1,48 |
25 |
0,0015 |
65 |
0,023077 |
1,64 |
30 |
0,001 |
70 |
0,014286 |
1,85 |
35 |
0,0005 |
75 |
0,006667 |
2,18 |
35,2 |
0,00048 |
75,2 |
0,006383 |
2,19 |
35,4 |
0,00046 |
75,4 |
0,006101 |
2,21 |
35,6 |
0,00044 |
75,6 |
0,00582 |
2,24 |
35,8 |
0,00042 |
75,8 |
0,005541 |
2,26 |
36 |
0,0004 |
76 |
0,005263 |
2,28 |
36,2 |
0,00038 |
76,2 |
0,004987 |
2,30 |
36,4 |
0,00036 |
76,4 |
0,004712 |
2,33 |
36,6 |
0,00034 |
76,6 |
0,004439 |
2,35 |
36,8 |
0,00032 |
76,8 |
0,004167 |
2,38 |
37 |
0,0003 |
77 |
0,003896 |
2,41 |
37,2 |
0,00028 |
77,2 |
0,003627 |
2,44 |
37,4 |
0,00026 |
77,4 |
0,003359 |
2,47 |
37,6 |
0,00024 |
77,6 |
0,003093 |
2,51 |
37,8 |
0,00022 |
77,8 |
0,002828 |
2,55 |
38 |
0,0002 |
78 |
0,002564 |
2,59 |
38,2 |
0,00018 |
78,2 |
0,002302 |
2,64 |
38,4 |
0,00016 |
78,4 |
0,002041 |
2,69 |
38,6 |
0,00014 |
78,6 |
0,001781 |
2,75 |
38,8 |
0,00012 |
78,8 |
0,001523 |
2,82 |
39 |
1E-04 |
79 |
0,001266 |
2,90 |
39,2 |
8E-05 |
79,2 |
0,00101 |
3,00 |
39,4 |
6E-05 |
79,4 |
0,000756 |
3,12 |
39,6 |
4E-05 |
79,6 |
0,000503 |
3,30 |
39,8 |
2E-05 |
79,8 |
0,000251 |
3,60 |
40 |
8E-09 |
80 |
1,00E-07 |
7,00 |
40,2 |
3,216E-12 |
80,2 |
4,01E-11 |
10,40 |
40,4 |
1,616E-12 |
80,4 |
2,01E-11 |
10,70 |
40,6 |
1,0827E-12 |
80,6 |
1,34E-11 |
10,87 |
40,8 |
8,1608E-13 |
80,8 |
1,01E-11 |
11,00 |
41 |
6,561E-13 |
81 |
8,10E-12 |
11,09 |
41,2 |
5,4945E-13 |
81,2 |
6,77E-12 |
11,17 |
41,4 |
4,7328E-13 |
81,4 |
5,81E-12 |
11,24 |
41,6 |
4,1616E-13 |
81,6 |
5,10E-12 |
11,29 |
41,8 |
3,7174E-13 |
81,8 |
4,54E-12 |
11,34 |
42 |
3,362E-13 |
82 |
4,10E-12 |
11,39 |
45 |
1,445E-13 |
85 |
1,70E-12 |
11,77 |
50 |
8,1E-14 |
90 |
9,00E-13 |
12,05 |
55 |
6,0167E-14 |
95 |
6,33E-13 |
12,20 |
60 |
5E-14 |
100 |
5,00E-13 |
12,30 |
65 |
4,41E-14 |
105 |
4,20E-13 |
12,38 |
70 |
4,0333E-14 |
110 |
3,67E-13 |
12,44 |
75 |
3,7786E-14 |
115 |
3,29E-13 |
12,48 |
80 |
3,6E-14 |
120 |
3,00E-13 |
12,52 |
Dane i obliczenia do teoretycznej krzywej miareczkowania
Początkowa ilość kwasu: 40ml
Stężenie kwasu: 0,1M
Ilość jonów H+ w roztworze: 0,004mola
Od początku miareczkowania do punktu przed punktem równoważnikowym korzystaliśmy z równania:
![]()
Np. po dodaniu 5ml NaOH
![]()
Po dodaniu 20ml NaOH
![]()
Od punktu równoważnikowego (pH=7) korzystaliśmy przy obliczeniach z iloczynu jonowego wody (10-14) oraz stężenia jonów OH-
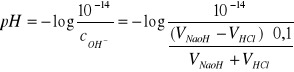
Np. po dodaniu 40,2ml NaOH
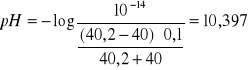
Po dodaniu 45ml NaOH
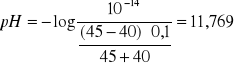
6
Wyszukiwarka
Podobne podstrony:
Chemia fizyczna - sprawozdanie 2-1, Chemia Fizyczna
Chemia fizyczna - sprawozdanie (4-1), Chemia Fizyczna
Fizyczna27m, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
SPRAWOZ4, Chemia fizyczna AGH laborki, lab 12
Sprawozdanie damiana nr 1, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i
poprawa II 25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna
Chfizyczna5, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
5.5L, technologia chemiczna, chemia fizyczna, sprawozdania z chemi fizycznej, 5.5
ćw 2 - reakcje oscylacyjne - sprawozdanie, Chemia fizyczna
moje 4, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, Ch
wfizyczna9, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł
chemia fizyczna-ćwiczenie 22, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczn
fizyczna 20, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
fizyczna25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł
Sprawozdanie (cechy fizyczne), Prywatne, Uczelnia, Budownictwo, II Semestr, Materiały Budowlane, mat
Wstęp teoretyczny, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i anality
więcej podobnych podstron