K O N D U K T O M E T R I A
Konduktometria polega na pomiarze przewodnictwa elektrycznego, które jest odwrotnością oporności elektrycznej roztworu pomiędzy dwiema obojętnymi elektrodami. Przepływ prądu przez roztwory elektrolitów podlega prawu Ohma wg. którego natężenie prądu jest wprost proporcjonalne do przyłożonego napięcia U, a odwrotnie proporcjonalne do oporu R, jaki roztwór stawia prądowi. Opór przewodnika R zależy od jego długości l, przekroju s i rodzaju materiału, z którego wykonano przewodnik:
![]()
gdzie: ρ , Ω ⋅ cm, jest tzw. oporem właściwym
l - oznacza odległość między elektrodami
s - powierzchnię elektrod
Dla elektrolitów zwykle podaje się przewodnictwo elektryczne (konduktancję) , G:
![]()
Jednostką przewodnictwa jest simens:
S = Ω-1![]()
Odwrotność oporu właściwego nazywamy przewodnictwem właściwym S⋅cm-1 lub
Ω-1⋅cm-1. Zależność między przewodnictwem elektrolitycznym a przewodnictwem właściwym jest następująca:
![]()
Po przekształceniu wzoru na przewodnictwo właściwe ![]()
otrzymujemy:
![]()
![]()
Stosunek ![]()
, cm-1, oznacza się symbolem k i nazywa stałą naczynka elektrolitycznego lub pojemnością oporową naczynka.
Przewodnictwo roztworu zawierającego 1 gramorównoważnik jonów pomiędzy elektrodami o powierzchni s (cm2) odległymi od siebie o 1 cm, a więc zamykającymi
objętość V, 1 litra roztworu nazywamy przewodnictwem równoważnikowym Λx albo λx.
![]()
gdzie: N oznacza liczbę gramorównoważników jonów w 1 litrze roztworu. Jeden gramorównoważnik to ilość jonów, która niesie ładunek jednego Faradaya F = 96500 kulombów (C).
Przewodnictwem molowym nazywamy przewodnictwo elektryczne, jakie wykazuje warstwa elektrolitu w przestrzeni między dwiema elektrodami oddalonymi od siebie o 1 cm
i o takiej objętości V, aby znajdował się w niej 1 mol substancji:
![]()
,
gdzie: c - oznacza stężenie molowe, mol ⋅ l-1.
Wymiarem przewodnictwa molowego jest S ⋅ cm2 ⋅ mol-1. Graniczna wartość do jakiej dąży przewodnictwo molowe, gdy stężenie elektrolitu dąży do zera, nazywa się granicznym przewodnictwem molowym, ![]()
.
Zgodnie z prawem Kohlrauscha o niezależnej wędrówce jonów, graniczne przewodnictwo molowe danego elektrolitu jest równe sumie granicznych przewodnictw jonowych ![]()
(kationu i anionu w rozcieńczeniu nieskończenie wielkim).
![]()
Ruchliwością (elektryczną) jonu u, nazywamy szybkość z jaką jon porusza się pod wpływem pola elektrycznego o jednostkowym natężeniu, V ⋅ cm-1.
Pomiędzy ruchliwością jonów w roztworze nieskończenie rozcieńczonym
a granicznym przewodnictwem molowym zachodzi następująca zależność:
![]()
,
gdzie: F - oznacza stałą Faradaya, 96500 C.
W rozcieńczeniu nieskończenie dużym, gdy przewodnictwo równoważnikowe osiąga wartość maksymalną ![]()
, elektrolit rozpada się całkowicie na jony (α=1). W mniejszych rozcieńczeniach, tzw. stężeniach skończonych, słabe elektrolity nie są całkowicie zdysocjowane, a w mocnych elektrolitach, które są zdysocjowane, występują oddziaływania międzyjonowe zmniejszające przewodnictwo, gdyż tworzą się solwatowane pary jonowe, które nie uczestniczą w przewodnictwie. Przy założeniu, że przewodnictwa jonowe nie zależą od stężenia, wyraził Arrhenius przewodnictwo molowe w skończonych stężeniach za pomocą następującej zależności uwzględniającej stopień dysocjacji α.
![]()
Stopień dysocjacji można zatem obliczyć jako stosunek przewodnictwa równoważnikowego w danym stężeniu do przewodnictwa równoważnikowego w rozcieńczeniu nieskończenie dużym:
![]()
Na podstawie pomiaru przewodnictwa właściwego można wyznaczyć rozpuszczalność soli trudno rozpuszczalnych w wodzie. Nasycone roztwory takich soli są tak bardzo rozcieńczone, że ich przewodnictwo jest praktycznie równe przewodnictwu granicznemu w rozcieńczeniu nieskończenie dużym. Ponieważ wartość ![]()
równa jest sumie przewodnictw poszczególnych jonów, można na podstawie znajomości przewodnictwa właściwego wyznaczyć stężenie równoważnikowe c z następującego równania:
![]()
Zmiany przewodnictwa występujące przy zmianie stężenia roztworów oraz przy zastępowaniu jonów o określonej ruchliwości jonami o innej ruchliwości są wykorzystywane w praktyce analitycznej w miareczkowaniu konduktometrycznym bardzo słabych kwasów
i zasad oraz bardzo rozcieńczonych mocnych kwasów i zasad.
Przykład 1. Graniczne przewodnictwa molowe w temperaturze 25oC wynoszą odpowiednio dla NH4OH, NH4Cl i KOH 271,7⋅10-4 Ω-1⋅m2⋅mol-1 , 150,5⋅10-4 Ω-1⋅m2⋅mol-1, 271,0⋅10-4
Ω-1⋅m2⋅mol-1. Obliczyć graniczne przewodnictwo molowe KCl.
Na podstawie prawa Kohlrauscha, które stwierdza, że graniczne przewodnictwo molowe elektrolitu jest równe sumie granicznych molowych przewodnictw jonowych λo (kationu i anionu w rozcieńczeniu nieskończenie wielkim), można ułożyć następujące równania:
![]()
(1)
![]()
(2)
![]()
(3)
Z równań (2) i (3) można wyznaczyć graniczne przewodnictwa jonowe ![]()
oraz ![]()
.
![]()
(4)
![]()
(5)
Dodając stronami równania (4) i (5) otrzymuje się graniczne przewodnictwo molowe ![]()
![]()
![]()
Po uwzględnieniu równania (1) otrzymujemy:
![]()
Przykład 2. Obliczyć graniczne przewodnictwo równoważnikowe AgIO3 na podstawie znanych granicznych przewodnictw równoważnikowych NaIO3, CH3COONa, CH3COOAg równych w temp. 25oC odpowiednio 91,1 S⋅cm2⋅mol-1, 91,0 S⋅cm2⋅mol-1, 102,8 S⋅cm2⋅mol-1.
Z prawa Kohlrauscha przewodnictwo równoważnikowe elektrolitu ![]()
jest sumą granicznych równoważnikowych przewodnictw jonowych kationu ![]()
i anionu ![]()
:
![]()
![]()
S⋅cm2⋅mol-1 (1)
![]()
S⋅cm2⋅mol-1 (2)
![]()
S⋅cm2⋅mol-1 (3)
Odejmując równanie drugie od sumy pierwszego i trzeciego otrzymujemy:
![]()
czyli: ![]()
Przykład 3. W roztworze rozcieńczonym ruchliwość jonów Na+ wynosi 5,19⋅10-4 cm2⋅
V-1⋅s-1, a anionu CH3COO- wynosi 4,24⋅10-4 cm2⋅V-1⋅s-1. Obliczyć graniczne przewodnictwa jonowe oraz liczby przenoszenia jonów „t” Na+ i CH3COO-.
Zależność między ruchliwością jonu (uo) a jego przewodnictwem molowym (λo)
w roztworach nieskończenie rozcieńczonych wyraża wzór:
![]()
,
gdzie: F - oznacza stałą Faradaya, 96500 C.
![]()
S⋅cm2⋅mol-1
![]()
S⋅cm2⋅mol-1
Dla jonów o tych samych ładunkach i stężeniu można zastosować uproszczony wzór na obliczenie liczby przenoszenia (t) jonu Na+ i CH3COO-:
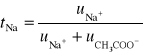
![]()
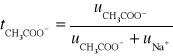
![]()
![]()
Przykład 4. Obliczyć ruchliwość jonów CH3COO- i Na+ oraz graniczne przewodnictwo molowe CH3COONa w roztworze nieskończenie rozcieńczonym, jeżeli graniczne jonowe przewodnictwo jonów CH3COO- wynosi 40,90 S⋅cm2⋅mol-1, a jonów Na+ 50,10 S⋅cm2⋅mol-1. Z zależności między ruchliwością jonu a jego przewodnictwem ![]()
, gdzie ![]()
oznacza ruchliwość jonu w roztworze nieskończenie rozcieńczonym, F - oznacza stałą Faradaya, 96500 C obliczamy dla danych jonów:
![]()
![]()
![]()
Graniczne przewodnictwo molowe można obliczyć w dwojaki sposób:
na podstawie prawa Kohlrauscha:
![]()
na podstawie zależności między ruchliwością jonów w roztworach nieskończonych
i granicznym przewodnictwem molowym:
![]()
![]()
Przykład 5. Obliczyć graniczne przewodnictwo równoważnikowe jonów ![]()
CH3COO-, SO42- i C2O42-, jeżeli graniczne przewodnictwo molowe jonów ![]()
wynosi w temp.25oC odpowiednio 40,90; 159,60; 147,0 S⋅cm2.
Przewodnictwo równoważnikowe jest powiązane z przewodnictwem molowym zależnością:
![]()
(1)
gdzie: ![]()
- przewodnictwo równoważnikowe elektrolitu
![]()
, ![]()
- ładunek kationu lub anionu
![]()
, ![]()
- liczba kationów lub anionów powstałych z dysocjacji jednej cząsteczki
elektrolitu.
Analogicznie do równania (1) graniczne przewodnictwa równoważnikowe jonów λxo można obliczyć:
![]()
![]()
![]()
Przykład 6. Przewodnictwo właściwe roztworu LiNO3 wynosi 7,92⋅10-3 S⋅cm-1. W jakiej odległości powinny być ustawione elektrody, aby przewodnictwo roztworu wynosiło 5 mS, powierzchnia elektrod wynosi 5 cm2.
Z przekształcenia prawa Ohma wyznaczamy wartość l:
![]()
,
gdzie: R - oznacza opór przewodnika
G - przewodnictwo elektryczne,
![]()
- przewodnictwo właściwe
s - powierzchnię elektrod,
l - odległość elektrod względem siebie,
![]()
![]()
Przykład 7. Przewodnictwo molowe 0,5 mol/l roztworu siarczanu potasu w 25oC wynosi 162,7 ![]()
. Obliczyć przewodnictwo właściwe i równoważnikowe w tej temperaturze.
Z przekształcenia wzoru na graniczne przewodnictwo molowe ![]()
wyznaczamy przewodnictwo właściwe (![]()
):
![]()
![]()
Przewodnictwo równoważnikowe λ obliczamy ze wzoru ![]()
, gdzie N - oznacza stężenie normalne związku, tzn. liczbę gramorównoważników w 1 litrze roztworu:
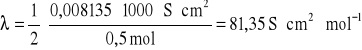
Przykład 8. pH roztworu CH3COOH o stężeniu 0,05 mol/l w temp.25oC wynosi 3,02. Ruchliwości jonów H+ i CH3COO- wynoszą odpowiednio 36,2⋅10-8 i 4,2⋅10-8⋅m2⋅V-1⋅s-1. Obliczyć przewodnictwo właściwe roztworu kwasu, wynik podać w Ω-1m-1.
Zależność między ruchliwością jonów w roztworach nieskończenie rozcieńczonych
a granicznym przewodnictwem molowym wyraża wzór:
![]()
![]()
gdzie: F - stała Faradya, 96500 C,
![]()
- ruchliwość jonu w roztworze nieskończenie rozcieńczonym, stąd:
![]()
Z wartości pH obliczamy stężenie [H+]:
pH = -log[H+]; [H+] = 10-3,02 = 9,55 ⋅ 10-4 mol/l
Stała dysocjacji kwasu octowego wynosi:
![]()
Stopień dysocjacji kwasu octowego obliczamy z przekształconego równania opisującego prawo rozcieńczeń Ostwalda:
![]()
gdzie: α - oznacza stopień dysocjacji
c - stężenie molowe, mol/l
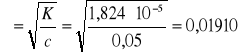
Stopień dysocjacji α można wg Arrheniusa powiązać z przewodnictwem molowym za pomocą równania:
![]()
, (1)
gdzie: ![]()
- oznacza przewodnictwo molowe przy danym stężeniu elektrolitu
![]()
- graniczne przewodnictwo molowe.
Po przekształceniu wzoru (1) przewodnictwo molowe kwasu octowego wynosi:
Λ = α ⋅ Λo = 0,01910 ⋅ 0,038986 = 7,4463 ⋅ 10-4 m2⋅V-1⋅mol-1
Z przekształcenia wzoru na przewodnictwo molowe elektrolitu:
![]()
gdzie: ![]()
- przewodnictwo właściwe,
c - stężenie molowe, mol/l
Otrzymujemy:
![]()
![]()
Przykład 9. Przewodnictwo właściwe w temp. 25oC nasyconego wodnego roztworu SrSO4 wynosi 1,48⋅10-4 S⋅cm-1 iloczyn rozpuszczalność SrSO4 wynosi 2,7⋅10-7, graniczne przewodnictwo równoważnikowe ½ Sr2+ wynosi 59,5⋅S⋅cm2⋅mol-1, a liczba przenoszenia 0,425. Obliczyć przewodnictwo właściwe wody, z której sporządzono roztwór.
Graniczne przewodnictwo molowe można obliczyć z zależności:
![]()
gdzie: t - oznacza liczbę przenoszenia
![]()
Stężenie jonów SrO4 w nasyconym roztworze jest równe jego rozpuszczalności ![]()
= S.
![]()
Przewodnictwo właściwe rozpuszczonej soli ![]()
obliczamy następująco:
![]()
Przewodnictwo właściwe wody, z której sporządzono roztwór nasycony SrSO4 jest różnicą między przewodnictwem właściwym roztworu i rozpuszczonej soli:
![]()
![]()
Przykład 10. Obliczyć liczbę przenoszenia Ag+, jeżeli graniczne przewodnictwo równoważnikowe AgCl wynosi 138 S⋅cm2⋅mol-1, a ruchliwość jonów Ag+ i Cl- wynosi odpowiednio 6,94⋅10-4 cm2/V⋅s oraz 7,37⋅10-4 cm2/ V⋅s.
Ponieważ ![]()
, dlatego:
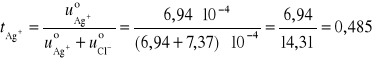
Przykład 11. Obliczyć liczby przenoszenia jonów K+ i SO42- w roztworze nieskończenie rozcieńczonym, jeżeli graniczne przewodnictwa równoważnikowe odpowiednich jonów wynoszą 73,5 S⋅cm2⋅mol-1 i 79,80 S⋅cm2⋅mol-1.
Obliczamy graniczne przewodnictwo molowe roztworu K2SO4, ![]()
oraz liczby przenoszenia jonów t uwzględniając ładunek (z) i stężenie molowe jonu c:
![]()
![]()
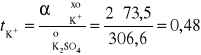
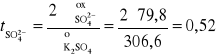
Przykład 12. Opór roztworu nasyconego PbSO4 wynosi 19400 Ω, mierzony w naczynku, którego pojemność oporową wyznaczono stosując 0,01 mol/l KCl. Przewodnictwo właściwe KCl wynosiło 520 S⋅cm-1, opór tego samego naczynka napełnionego wodą, z której sporządzono roztwór wynosił 459000 Ω. Obliczyć iloczyn rozpuszczalności PbSO4 oraz rozpuszczalność PbSO4 w mol/l i mg/l, jeżeli przewodnictwo właściwe 0,01 m/l KCl wynosi 0,001413 S⋅cm-1 w temp. 25oC, graniczne przewodnictwa równoważnikowe jonów ½ Pb2+ i ½ SO42- wynoszą odpowiednio 71,2 S⋅cm2⋅mol-1 oraz 79,8 S⋅cm2⋅mol-1.
Ze wzoru na stałą naczynka obliczamy przewodnictwo właściwe roztworu:
![]()
![]()
![]()
![]()
Przewodnictwo właściwe rozpuszczonej soli PbSO4 wynosi ![]()
:
![]()
Graniczne przewodnictwo molowe PbSO4 obliczamy na podstawie prawa Kohlrauscha:
![]()
gdzie: ![]()
oznaczają odpowiednio graniczne przewodnictwa równoważnikowe jonów
Pb2+ i SO42-.
![]()
Stężenie PbSO4 w nasyconym roztworze jest równe jego rozpuszczalności i obliczamy na podstawie wzoru:
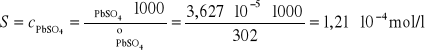
Iloczyn rozpuszczalności PbSO4 wynosi:
![]()
Rozpuszczalność w mg/l wynosi:
![]()
Przykład 13. Obliczyć stężenie AgI w nasyconym roztworze tej soli oraz iloczyn rozpuszczalności AgI, jeżeli przewodnictwo właściwe nasyconego roztworu AgI
w temp.18oC wynosi 5,19⋅10-6 Ω-1m-1, przewodnictwo właściwe wody, z której sporządzono roztwór wynosi 5,0⋅10-6 Ω-1m-1, graniczne przewodnictwa równoważnikowe
w temp.18oC wynoszą odpowiednio dla HNO3, AgNO3 i HI: 376,6⋅10-4, 115,6⋅10-4
i 381,1⋅10-4 Ω-1m2mol-1.
Graniczne przewodnictwo równoważnikowe roztworu AgI obliczamy
z następujących równań (1-3):
![]()
(1)
![]()
(2)
![]()
(3)
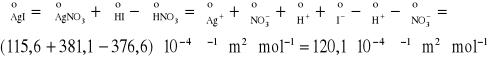
Przewodnictwo właściwe roztworu ![]()
jest sumą przewodnictwa właściwego rozpuszczonej soli (![]()
) i przewodnictwa właściwego wody (![]()
), z której sporządzono roztwór:
![]()
Po przekształceniu wzoru obliczamy przewodnictwo właściwe rozpuszczonej soli ![]()
:
![]()
Ponieważ w przypadku soli trudno rozpuszczalnych roztwór nasycony można traktować jako roztwór nieskończenie rozcieńczony, więc stężenie tego roztworu obliczamy
z przekształcenia następującej zależności:
![]()
gdzie: ![]()
- oznacza graniczne przewodnictwo molowe AgI,
![]()
- oznacza przewodnictwo właściwe roztworu AgI
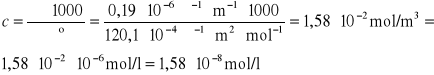
Stężenie AgI w nasyconym roztworze jest równe jego rozpuszczalności:
![]()
![]()
Iloczyn rozpuszczalności AgI, ![]()
wynosi:
![]()
Przykład 14. Obliczyć przewodnictwo właściwe nasyconego roztworu AgCl, w temp. 25oC w Ω-1m-1. Przewodnictwo właściwe wody, z której przygotowano roztwór wynosi 0,86⋅10-4 Ω-1m-1, wartości granicznych przewodnictw molowych AgNO3, HCl i HNO3 wynoszą odpowiednio 1,33⋅10-2, 4,26⋅10-2, 4,21⋅10-2 Ω-1⋅m2⋅mol-1, iloczyn rozpuszczalności AgCl wynosi 1,7⋅10-10.
Graniczne przewodnictwo molowe AgCl otrzymujemy odejmując równanie drugie od sumy pierwszego i trzeciego:
![]()
(1)
![]()
(2)
![]()
(3)
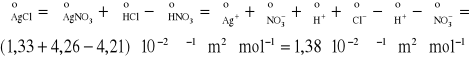
![]()
Stężenie AgCl w nasyconym roztworze jest równe jego rozpuszczalności i obliczamy
w następujący sposób:
![]()
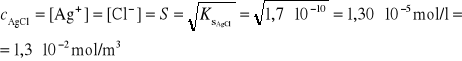
Ze wzoru na graniczne przewodnictwo molowe można obliczyć przewodnictwo właściwe rozpuszczonej soli AgCl.
![]()
![]()
Przewodnictwo właściwe nasyconego roztworu AgCl jest sumą przewodnictwa właściwego wody destylowanej użytej do przygotowania roztworu nasyconego i przewodnictwa właściwego rozpuszczonej soli AgCl.
![]()
![]()
Przykład 15. Przewodnictwo równoważnikowe w temp.25oC roztworu kwasu octowego
o stężeniu 1,82⋅10-4 mol/l wynosi 90,0 S⋅cm2⋅mol-1. Obliczyć stałą dysocjacji. Graniczne przewodnictwa jonów H+ i CH3COO- wynoszą odpowiednio 349,82 S⋅cm2⋅mol-1
i 40,90 S⋅cm2⋅mol-1.
Obliczamy graniczne przewodnictwo molowe z prawa Kohlrauscha:
![]()
![]()
Z prawa Ostwalda stała dysocjacji (K) wyrażona jest wzorem:
![]()
![]()
Przykład 16. Przewodnictwo właściwe nasyconego roztworu wodnego La2(C2O4)3
w temp.25oC, wynosi 9,63⋅10-7 S⋅cm-1, a wody, z której sporządzono roztwór 2,71⋅10-7 S⋅cm-1. Graniczne przewodnictwa równoważnikowe jonów 1/3 La3+ i ½ C2O42- wynoszą odpowiednio 69,7 i 24,0 S⋅cm2⋅mol-1. Obliczyć iloczyn rozpuszczalności La2(C2O4)3.
Graniczne przewodnictwo molowe La2(C2O4)3 obliczamy z prawa Kohlrauscha:
![]()
Z różnicy między przewodnictwem właściwym roztworu i wody obliczamy przewodnictwo właściwe rozpuszczonej soli La2(C2O4)3
![]()
Stężenie La2(C2O4)3 równe rozpuszczalności S wynosi:
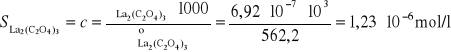
![]()
⇔ ![]()
Ponieważ [La3+] = 2S oraz [C2O42-] = 3S, stąd:
![]()
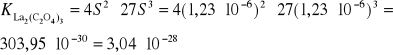
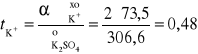
Wyszukiwarka
Podobne podstrony:
Gazy doskonałe i rzeczywiste. Lotność, Technologia Chemiczna AGH, inne, Chemia fizyczna
INŻ K 3, Technologia Chemiczna AGH, inne, Inżynieria chemiczna i procesowa, Pęd
cwiczenie 34, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, chemia fizyczna
izomeria optyczna, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, chemia fizyczna
04 struktury ok, Technologia chemiczna pw, 1rok, chemia kolosy egz
02 rozkład ok, Technologia chemiczna pw, 1rok, chemia kolosy egz
07 reszta ok, Technologia chemiczna pw, 1rok, chemia kolosy egz
chemia nieorganiczna egzamin, Technologia chemiczna pw, 1rok, chemia kolosy egz
Elektrony w polu... - odp, Technologia chemiczna pw, 1rok, chemia kolosy egz
chemia1PRACA DOMOWA5, Technologia chemiczna pw, 1rok, chemia kolosy egz
redox, Technologia chemiczna pw, 1rok, chemia kolosy egz
06 reakcje2 ok, Technologia chemiczna pw, 1rok, chemia kolosy egz
REAKCJE, Technologia chemiczna pw, 1rok, chemia kolosy egz
otrzymywanie, Technologia chemiczna pw, 1rok, chemia kolosy egz
01 otrzymywanie ok, Technologia chemiczna pw, 1rok, chemia kolosy egz
gontarz I termin, Technologia chemiczna pw, 1rok, chemia kolosy egz
CAŁOŚĆ, Technologia chemiczna pw, 1rok, chemia kolosy egz
chemia1PRACA DOMOWA4, Technologia chemiczna pw, 1rok, chemia kolosy egz
Ćwiczenie 4 - destylacja, Technologia INZ PWR, Semestr 3, Chemia Fizyczna, Chemia fizyczna - Laborat
więcej podobnych podstron