ELEKTROCHEMIA
Jeżeli w roztworze elektrolitu zanurzy się płytkę metalową, to na granicy faz metal/roztwór wytwarza się charakterystyczna różnica potencjału elektrycznego.
Zjawisko to spowodowane jest przechodzeniem jonów metalu z fazy metalicznej do roztworu oraz procesem odwrotnym - przyjmowaniem przez powierzchnię metalu jonów z roztworu. Wskutek wysyłania przez powierzchnię metalu pewnej liczby jonów dodatnich do roztworu ładuje się ona ujemnie. Pojawiające się w wyniku tego w roztworze jony dodatnie stopniowo gromadzą się w pobliżu ujemnie naładowanej powierzchni metalu. W ten sposób ustala się pewna równowaga i na granicy faz metal/roztwór tworzy się podwójna warstwa elektryczna.
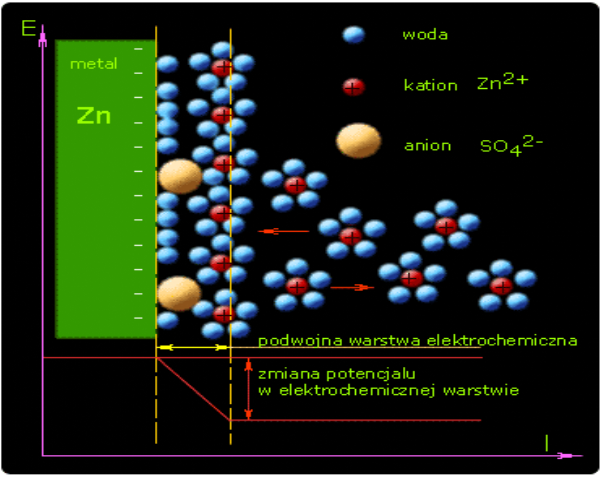
Jeżeli metal zanurzony do roztworu wykazuje małą aktywność chemiczną (jak np. metale szlachetne) - następuje proces przeciwny: dodatnie jony z roztworu osadzają się na jego powierzchni, która ładuje się dodatnio, a warstwa roztworu najbliższa powierzchni metalu ładuje się ujemnie.
Układ składający się z metalu zanurzonego w roztworze elektrolitu nazywa się umownie elektrodą lub półogniwem. Potencjał elektryczny na granicy metal/roztwór nazywa się potencjałem elektrody.
Zależność tę ujmuje wzór Nernsta:
dla elektrody, na której zachodzi reakcja elektrodowa:
wzór Nernsta ma postać (postać uproszczona) :
gdzie: ε - potencjał elektrody
εo - standardowy (normalny) potencjał elektrody
R - stała gazowa T - temperatura bezwzględna
z - ładunek jonu aMz+ - aktywność kationów [mol/dm3]
F - stała Faradaya - czyli ładunek potrzebny do wydzielenia na elektrodzie 1/z moli substancji, gdzie z jest liczbą elektronów występujących w równaniu reakcji elektrodowej; F równa się 96 500 C ⋅ mol.
Dla:
powstawanie podwójnej warstwy elektrycznej na granicy faz metal/roztwór
Jeżeli elektrody są zanurzone w roztworze o niewielkim stężeniu we wzorze Nernsta zamiast aktywności stosuje się stężenia.
Dwie elektrody połączone przewodnikiem elektrolitycznym stanowią ogniwo elektrochemiczne (galwaniczne).
W ogniwie na jednej elektrodzie następuje redukcja kationów do metalu:
M Iz+ + z e → MI
a na drugiej - przechodzenie jonów metalu do roztworu (utlenianie):
MII → M IIz+ + z e
Razem:
Potencjały poszczególnych elektrod:
2,303 R T
ε1 = ε1o + --------------- log aM I z+
z F
2,303 R T
ε2 = ε2o + --------------- log aM II z+
z F
Różnica pomiędzy potencjałami elektrod tworzących ogniwo jest siłą motoryczną tego ogniwa E (SEM):
Siła elektromotoryczna ogniwa może być mierzona metodą, w której nie następuje pobór prądu, np. metodą kompensacyjną.
2,303 RT aMIIz+
E = (ε1o - ε2o) - ------------ log -------
z ⋅ F aM Iz+
Eo
standardowa siła elektromotoryczna ogniwa
Dla roztworów rozcieńczonych:
gdzie:
CM IIz+ - stężenie molowe jonów przy elektrodzie dodatniej
CM Iz+ - stężenie molowe jonów przy elektrodzie ujemnej
W każdym ogniwie elektrochemicznym zachodzą procesy utlenienia - redukcji:
na anodzie (-) - zachodzi utlenianie
na katodzie (+) - zachodzi redukcja
a ruch elektronów w obwodzie zewnętrznym łączącym obie elektrody zachodzi od anody → katody.
Według tzw. konwencji sztokholmskiej ogniwo zapisuje się za pomocą schematu:
anoda (-) II katoda (+)
(strona lewa) (strona prawa)
klucz elektrolityczny
eliminuje różnicę potencjałów na granicy dwu roztworów, pojawiającą się jeżeli liczby przenoszenia kationów i anionów w roztworach stykających się nie są równe. W kluczach elektrolitycznych stosuje się roztwory KCl, KNO3, NH4NO3 dla których potencjał dyfuzyjny jest równy zero).
Przykładem może być ogniwo Daniela:
(-) Zn I ZnSO4 II CuSO4 I Cu (+)
E (SEM) takiego ogniwa:
dla ogniwa Daniela:
Praca ogniwa elektrochemicznego opisana termodynamicznie wynosi:
przy założeniu, że: zostaje rozpuszczony 1 mol Zn i na katodzie wydzieli się 1 mol Cu, a procesowi będzie towarzyszył przepływ naboju z⋅F, praca W równa jest zmianie entalpii swobodnej:
Z równania izotermy reakcji van`t Hoffa:
CZn2+
ΔG = - RT ln Kc + RT ln ----------
cCu2+
gdzie: Kc - stała równowagi procesu elektrodowego:
Zn + Cu2+ ↔ Zn2+ + Cu
CZn2+
- 2⋅ E⋅F = - RT ln Kc + RT ln -------
CCu2+
dla stężeń jednostkowych:
2 Eo F = RT ln Kc
czyli: RT
Eo = ------ ln Kc
2 F
Znając potencjał normalny można obliczyć potencjał elektrody w roztworze jej jonów o dowolnym stężeniu oraz stałą rownowagi reakcji procesu elektrodowego.
Potencjał standardowy elektrody wyznacza się mierząc siłę elektromotoryczną ogniwa zbudowanego z tej elektrody (o jednostkowym stężeniu jonów) i elektrody o znanym potencjale (np. względem standardowej elektrody wodorowej). Tak wyznaczone wartości potencjałów standardowych (normalnych) ułożone wg rosnącego potencjału noszą nazwę szeregu potencjałów normalnych elektrod (a w przypadku elektrod metalicznych - szeregu napięciowego metali).
Wielkość potencjału standardowego elektrody tworzonej przez dane pierwiastki jest ściśle związana z właściwościami redukującymi tych pierwiastków.
Ujemna wartość potencjału wskazuje na dużą skłonność danej elektrody do oddawania jonów do roztworu, w wyniku czego ładuje się ona ujemnie.
Dodatni potencjał związany jest z tendencją danej elektrody do oddawania elektronów a nie jonów dodatnich.
Szereg potencjałów normalnych pozwala na określenie przebiegu niektórych reakcji redoks pomiędzy jonami w roztworach. Metale o bardziej ujemnym potencjale wypierają z roztworów jony metali tworzących elektrody o potencjale bardziej dodatnim.
Kawałek metalu, włożony do roztworu zawierającego jony innego metalu, może rozpuszczać się samorzutnie, powodując wydzielanie tego drugiego metalu z roztworu. Na przykład: blaszka cynkowa lub gwóźdź żelazny umieszczone w roztworze soli miedziowej powodują odkładanie się warstwy metalicznej miedzi i przechodzenie cynku lub żelaza do roztworu. Odwrotnie, blaszka miedziana umieszczona w roztworze soli cynkowej czy żelazowej nie powoduje wydzielania się metalicznego cynku.
|
Atomy metali położonych powyżej wodoru (którego potancjał εo = 0,000V) - tzw. metale nieszlachetne, wypierają go z roztworów jego związków (np. kwasów czy wody); natomiast metale leżące poniżej wodoru (tzw. metale szlachetne) są wypierane z ich soli przez wodór atomowy.
|
Do przypomnienia:
ELEKTRODY I-go i II - go RODZAJU, POTENCJOMETRIA, ELEKTRODY PORÓWNAWCZE I WSKAŹNIKOWE.
Standardowa (normalna) elektroda wodorowa
OGNIWO STĘŻENIOWE - zbudowane z dwu jednakowych elektrod zanurzonych do roztworów o różnych stężeniach. Rozróżnia się ogniwa stężeniowe z przenoszeniem i bez przenoszenia.
Przykładem ogniwa stężeniowego bez przenoszenia może być:
Ag (-) I AgNO3 II AgNO3 I Ag+
C1 C2
Reakcja elektrodowa:
Ag + Ag+(2) ↔ Ag + Ag+(1)
lub: Ag+(2) ↔ Ag+(1)
jony Ag+ będą wędrowały z roztworu o stężeniu wyższym (c2) do roztworu o stężeniu niższym (c1), a SEM takiego ogniwa będzie zależała od stosunku stężeń tych jonów.
W ogniwie stężeniowym z przenoszeniem roztwory oddzielone są membraną, która uniemożliwia mieszanie się roztworów, a jedynie pozwala na wędrówkę jonów z jednego roztworu do drugiego.
RUCHLIWOŚĆ I LICZBY PRZENOSZENIA JONÓW
Ruchliwości kationów i anionów nie są jednakowe i oznacza się je uk (u+) i ua (u-). Ruchliwość jonów wzrasta z rozcieńczeniem i ma wartość maksymalną dla roztworu nieskończenie rozcienczonego, co nazywa się
graniczną ruchliwością jonu: uo+ i uo-.
Z ruchliwością jonów związane jest przewodnictwo molowe danego elektrolitu:
LICZBY PRZENOSZENIA JONÓW:
liczba przenoszenia jonu jest to stosunek ładunku przenoszonego przez ten jon do całkowitego ładunku przenoszonego przez wszystkie jony elektrolitu;
dla kationu: t+ = q+ / q
dla anionu: t - = q- / q
Suma liczb przenoszenia kationów i anionów elektrolitu równa się 1.
POTENCJAŁY OKSYDACYJNO-REDUKCYJNE ELEKTROD
Jeżeli chemicznie obojętny metal zostanie zanurzony do roztworu, w którym zachodzi proces redoks:
Oks + n e ↔ Red
to potencjał takiej elektrody równa się:
gdzie: aoks - aktywność formy utlenionej
ared - aktywnośc formy zredukowanej
Jeżeli w procesie redoks biorą udział jony H3O+ to potencjał redoks takiej elektrody zależy od pH roztworu.
Wartości normalnych potencjałów redoks nie tylko dla metali, ale też dla anionów są stablicowane i ułożone w szeregu.
Substancje o niskich potencjałach redoks są silnymi reduktorami, a te o wysokich potencjałach redoks - silnymi utleniaczami.
Substancja o wyższym potencjale redoks zdolna jest utlenić każdą substancję o niższym potencjale redoks.
Potencjał redoks jest miarą zdolności do pobierania lub oddawania elektronów przez układ i decyduje o kierunku samorzutnej reakcji redoks.
ELEKTROLIZA
Przepływ prądu przez elektrolit powoduje zachodzenie w nim różnych procesów redoks, przy czym podczas tych reakcji wymiana elektronów zachodzi nie bezpośrednio między reagentami, lecz za pośrednictwem elektrod zanurzonych do elektrolitu.
Ogół procesów zachodzących w elektrolicie pod wpływem przepływu prądu elektrycznego nazywa się elektrolizą.
Na przykład, przepływ prądu przez roztwór HCl powoduje zachodzenie reakcji:
na katodzie: H+ + e H redukacja
H + H H2
na anodzie: Cl- Cl + e utlenianie
Cl + Cl Cl2
W wyniku tych reakcji podczas elektrolizy powstają określone produkty.
W elektrolizie elektrody mają przeciwny znak [katoda (-), anoda (+)] aniżeli w ogniwie elektrochemicznym, ale i tu obowiązuje zasada:
na katodzie zawsze zachodzi redukcja, na anodzie - zawsze zachodzi utlenianie.
Zastosowanie elektrolizy: m.in. otrzymywanie czystych metali (np. Na, Ca) przez elektrolizę ich stopionych soli lub tlenków (np. Al), otrzymywanie gazów (np. H2, Cl2, O2 ), pokrywanie metali warstwami innych metali w celach ochronnych lub ozdobnych.
Ilościowo proces elektrolizy opisują prawa Faraday`a:
Do przypomnienia:
OGNIWA ELEKTROCHEMICZNE JAKO ŻRÓDŁA ENERGII ELEKTRYCZNEJ
W dziewiętnastym wieku, aż do wynalezienia prądnicy prądu elektrycznego, ogniwa elektrochemiczne były głównym żródłem energii elektrycznej. Obecnie jednym z najczęściej używanych jest m.in.:
Ogniwo Leclanche`go:
elektroda cynkowa zanurzona do roztworu NH4Cl i chlorku cynku
elektroda grafitowa pokryta sproszkowanym MnO2
Schemat:
Zn (-) I NH4Cl + ZnCl2 I MnO2 + C (+)
Procesy elektrodowe zachodzące w tym ogniwie:
(-) Zn Zn2+ + 2 e utlenianie - anoda
(+) 2 NH4+ + 2 e 2 NH3 + H2 redukacja - katoda
Ogniwa łączy się w baterie, które stosuje się do zasilania różnych urządzeń elektrycznych, np. latarek kieszonowych. Są to nieowracalne źródła prądu.
AKUMULATORY
Sa to urządzenia do odwracalnej zamiany energii chemicznej w elektryczną. Dzieli się je na :
Akumulatory kwasowe:
np. akumulator ołowiowy -
elektrodę dodatnią stanowi ditlenek ołowiu
elektrodę ujemną - gąbczasty ołów
elektrolitem jest ~38% roztwór H2SO4.
Źródłem energii są reakcje:
Elektroda (-): Pb + SO42- PbSO4 + 2 e - utlenianie-anoda
Elektroda (+): PbO2 + 4 H+ + SO42- + 2 e PbSO4 + 2 H2O
redukcja - katoda
Sumarycznie: Pb + PbO2 + 2 H2 SO4 2 PbSO4 + 2 H2O
W wyniku tych reakcji akumulator sie rozładowuje - elektrolit się rozcieńcza, a obie elektrody pokrywają się nierozpuszczalnym osadem PbSO4. Przebieg reakcji odwrotnych czyli ładowanie akumulatora następuje pod wpływem prądu przyłożego do elektrod ze źródła zewnętrznego; SEM naładowanego akumulatora wynosi 2,2,V, przy obniżeniu do 1,8 V akumulator musi zostać naładowany.
Akumulator zasadowy, np. żelazowo - niklowy (Edisona):
elektroda dodatnia - tlenek niklowy
elektroda ujemna - metaliczne żelazo
elektrolit: ~20% roztwór KOH
Reakcje zachodzące podczas pracy akumulatora:
(+) Ni2O3 + H2O + 2e 2 NiO + 2 OH-
(-) Fe + 2 OH- FeO + H2O + 2 e
sumarycznie:
Ni (OH)3 + Fe 2 Ni(OH)2 + Fe (OH)2
SEM tego akumulatora jest stała, niezalezna od stężenia elektrolitu i mniej wrażliwa na długi okres przechowywania.
OGNIWA PALIWOWE
Jest to nowa generacja źródeł energii elektrycznej, wytwarzanej dzięki reakcjom elektrochemicznym zachodzącym w procesie utleniania paliwa (H2, CO, CH4, hydrazyna, metanol i in.). Utlenianie zachodzi na elektrodach odpornych na korozję i równocześnie katalizujacych proces (np. platynowych).
Przykładem takiego ogniwa jest ogniwo wodorowo - tlenowe o schemacie:
H2 (g), Ni(s) I przewodnik jonowy I Ni(s), O2 (g)
elektrolit - jonowymienna membrana z polimeru sulfono-fluoro-
węglowego lub stężony (100%) H3PO4.
Reakcja elektrodowa:
2 H2 (g) + O2 (g) 2 H2O (c )
Aby zapewnić odpowiednią szybkość procesów elektrodowych, ogniwo musi pracować w temp. 120 - 200oC. Proces rozpoczyna się od otrzymania czystego wodoru - jako paliwo używa się gaz ziemny, naftę, metanol, odsiarczony biogaz (bez CO). Wodór jest bardzo wybuchowy, więc muszą być zachowane specjalne warunki bezpiecznego jego gromadzenia. Do tego celu stosuje się m.in. stop niklu z lantanem (w stosunku molowym 5 : 1), który pod zwiększonym ciśnieniem pochłania znaczne ilości wodoru, uwalniane po ogrzaniu lub po obniżeniu ciśnienia. Powstająca woda jest oddestylowywana z elektrolitu i może służyć do innych celów. W niektórych projektach służy do elektrolitycznego wytwarzania wodoru i tlenu stosowanych jako reagenty w ogniwie.
schemat ogniwa paliwowego
SEM pojedynczego ogniwa wynosi ok. 1 wolta lub mniej, a natężenie prądu elektrycznego w obwodzie zależy od powierzchni elektrod. Napięcie można zwiększać łacząc szeregowo wiele ogniw pojedynczych, np. w plastry przekładane membranami nieprzepuszczalnymi dla elektrolitu, lecz przewodzącymi prąd elektryczny. Stos kilku niewielkich ogniw może dostarczyć moc paru watów, zaś wiele ogniw o powierzchni ok. metra kwadratowego jest w stanie wygenerować setki kilowatów.
Obecnie ogniwa paliwowe są jeszcze zbyt drogie, aby mogły konkurować z konwencjonalnymi źródłami energii elektrycznej, niemniej znajdują i teraz zastosowanie, np. do zasilania niewielkich obiektów cywilnych (jak szpitale, biura, prototypowe samochody) i wojskowych, w pojazdach kosmicznych, łodziach podwodnych itp. Badania nad tymi urządzeniami są bardzo zaawansowane i na pewno w niedalekiej przyszłości ogniwa te mogą zastąpić dotychczas stosowane źródła nergii elektrycznej.
Wielkość potencjału elektrody zależy od:
♦ rodzaju metalu ♦rodzaju elektrolitu ♦ temperatury
♦ aktywności (stężenia) jonów w roztworze
M → M z+ + z e
2,303 R T
ε = εo + ------------- log aM z+
z F
aMz+ = 1 ε = εo
M Iz+ + MII → MI + M IIz+
E = ε1 - ε2
2,303 R T CM IIz+
E = Eo - ----------------- log -------
z ⋅ F CM Iz+
granica faz
metal/ roztwór
E = εk - εa
E = εCu - εZn
W = - z ⋅E ⋅ F
Δ G = - z⋅ E⋅ F
ΔG = ΔGo = - RT ln Kc
RT RT
E = Eo + --------- ln CCu2+ - ---------- ln CZn2+
2 F 2F
Ruchliwością jonu nazywa się prędkość, którą ma jon w polu elektrycznym o różnicy potencjałów 1 V/cm
λ = α ⋅ F ( u+ + u-) = α ⋅ F ⋅ u+ + α ⋅ F ⋅ u-
molowe przewodnictwa jonowe
2,303 R T aoks ε = εo + ----------- log --------
z F ared
Reakcja redoks może przebiegać samorzutnie , gdy utleniaczem będzie forma utleniona pary redoks o wyższym potencjale, natomiast reduktorem będzie forma zredukowana pary redoks o niższym potencjale redoks.
Masa substancji m wydzielona na elektrodzie jest proporcjonalna do natężenia I prądu przepływającego przez elektrolit i czasu t trwania elektrolizy: m = k . I . t
k -- współczynnik elektrochemiczny, charakterystyczny dla danej
substancji
Ponieważ: ładunek q = I . t m = q . k
II. Stosunek masy molowej M substancji wydzielonej na elektrodzie do
iloczynu (k . z ) jest wielkością stałą:
M
------ == const F
k . z stała Faraday`a
z - liczba elektronów wymieniana z elektrodą
Równowaga w roztworach elektrolitów: stała i stopień dysocjacji, prawo Ostwalda, rodzaje elektrolitów, przewodnictwo właściwe i molowe, teoria elektrolitów mocnych, iloczyn jonowy wody, pH, pOH, bufory, hydroliza soli, stała i stopień hydrolizy.
Wyszukiwarka
Podobne podstrony:
5 Wiazania chemiczne, Budownictwo PK, Chemia, Chemia nieorganiczna od Marysi
WRZENIE I KRZEPNICIE ROZTWORW, Budownictwo PK, Chemia, Chemia nieorganiczna od Marysi
BIOPIERWIASTKI 19.11 (22.11), Budownictwo PK, Chemia, Chemia nieorganiczna od Marysi
KINETYKA CHEMICZNA, Budownictwo PK, Chemia, Chemia nieorganiczna od Marysi
1 Wprowadzenie – podstawowe pojęcia, Budownictwo PK, Chemia, Chemia nieorganiczna od Marysi
ROWNOWAGI, Budownictwo PK, Chemia, Chemia nieorganiczna od Marysi
SYSTEMATYKA ZWIAZKOW NIEORGANICZNYCH 5.11 (8.11), Budownictwo PK, Chemia, Chemia nieorganiczna od Ma
UKŁADY KOLOIDALNE (22.01), Budownictwo PK, Chemia, Chemia nieorganiczna od Marysi
6 Zależność właściwości substancji od rodzaju wiązania chemicznego, Budownictwo PK, Chemia, Chemia n
ADSORPCJA JONOWYMIENNA (22.01), Budownictwo PK, Chemia, Chemia nieorganiczna od Marysi
4 Układ okresowy pierwiastków, Budownictwo PK, Chemia, Chemia nieorganiczna od Marysi
ściaga+chemia, Budownictwo PK, Chemia Budowlana
TEST z 22.01.09 pytania, Budownictwo PK, chemia
wzór Sprawozdanie, budownictwo sem3, Chemia, materiały od prowadzącej
zadania rachunkowe rok akad. 2011 2012, budownictwo sem3, Chemia, materiały od prowadzącej
Zaliczenie-11.05 rozwiazania, PK, chemia, nieorganiczna, nieorg zadania lab
zal termin3, PK, chemia, nieorganiczna, nieorg zadania lab
Woda zarobowa, budownictwo pk, sem 1, chemia
Korozja betonu, budownictwo pk, sem 1, chemia
więcej podobnych podstron