WIELKOŚCI CHARAKTERYZUJĄCE METODY ANALITYCZNE
CZUŁOŚĆ - stosunek różnicy sygnału do różnicy stężeń (Δy/Δc); sygnał: np. natężenie prądu, napięcie, jednostka emisji)
DOKŁADNOŚĆ - stopień zgodności wyniku otrzymanego do wyniku rzeczywistego
PRECYZJA - rozrzut wyników
WYKRYWALNOŚĆ - dotyczy działań jakościowych (np. wykrywanie pierwiastków w próbce)- najmniejsza ilość pierwiastka, którą możemy wykryć daną metodą
OZNACZALNOŚĆ - pojęcie ilościowe. Najmniejsza ilość pierwiastka, którą możemy oznaczyć daną metodą
POWTARZALNOŚĆ - precyzja pomiaru w obrębie jednego laboratorium dla danej metody przy zastosowaniu tej samej aparatury, tych samych odczynników
ODTWARZALNOŚĆ - precyzja metody w badaniach między laboratoryjnych
SELEKTYWNOŚĆ - mówi o tym, ze dana metoda nadaje się do oznaczania kilku pierwiastków czy związków chemicznych
SPECYFICZNOŚĆ - mówi nam o tym, że dana metoda (odczynnik) nadaje się do oznaczania jednego pierwiastka czy związku chemicznego
SPECJACJA - określenie form występowania danego pierwiastka
POBÓR PRÓBEK
Próbka reprezentacyjna to taka która odzwierciedla jakościowy i ilościowy skład partii materiału .
Partia materiału jest to całkowita ilość materiału, którą należy ocenić na podstawie analizy chemicznej.
Partia materiału (produktu) jest to ilość produktu tej samej jakości w jednakowych opakowaniach lub nie opakowanego, przedstawiona jednorazowo odbiorcy przez dostawcę lub wytwórcę.
PARTIA MATERIAŁU PRÓBKI PPIERWOTNE (JEDNOSTKOWE)PRÓBKA OGÓLNA (SUMA PRÓBEK PIERWOTNYCH)PRÓBKA LABOLATORYJNAPRÓBKA ANALITYCZNA (n=6 ilość pomiarów)
Próbka laboratoryjna - próbka przygotowana z próbki ogólnej reprezentująca właściwości partii materiału, przeznaczona do przeprowadzenia badań laboratoryjnych, opakowana i przechowywana w sposób zapewniający jej identyczność.
Próbka analityczna - część próbki laboratoryjnej przeznaczona całkowicie do konkretnego oznaczania.
1) Z partii materiału pobieramy tzw. próbki pierwotne czyli jednostkowe. Zsypujemy je na jedno miejsce i ugniatamy próbkę ogólną (musi być dobrze wymieszana). Następnie rozsypujemy ja na kilka kupek (małe stożki)Pobieramy co drugi stożek a pozostałość mieszamy i ponownie usypujemy stożki. Postępujemy w ten sposób aż nasza próbka zostanie pomniejszona do odpowiednich rozmiarów.
2) Usypujemy z całości duży stożek z którego pobieramy wierzchołek (zakreskowane), pozostałość ponownie usypujemy i pobieramy wierzchołek itd. Aż próbka będzie pomniejszona.
3) Pobieramy 2 części (zakreskowane), pozostałe części się miesza, usypuje się stożek i postępuje jak powyżej.
PRZEPROWADZANIE PRÓBEK STAŁYCH DO R-RU
Rozpuszczenie - proces fizyczny w którym nasza badana substancja ulega rozproszeniu pod wpływem rozpuszczalnika (woda,metanol-rozp.polarne; heksan,toluen,chloroform-niepolarne)
Roztwarzanie - proces chemiczny (zachodzi reakcja)
Fe + 2HCl FeCl2 + H2
Kwasy stosowane do roztwarzania (kolejność stosowania):
HCl - nie utleniający( chlorki dobrze rozpuszczalne w wodzie; z As, Pb, Sb, Hg, Sn, Cd tworzy lotne chlorki, z Fe, Al., Zn tworzy kompleksy);
HNO3- utleniający (łatwy do usunięcia) większość azotanów łatwo rozpuszczalna w wodzie - tworzą się tlenki azotu;
H2SO4 - na zimno, rozcieńczony - nie utleniający, na gorąco i stężony - utleniający;
HF - tworzy liczne kompleksy, przez co ułatwia roztwarzanie, z krzemem tworzy lotny SiF4 który się ulatnia; reaguje z krzemionką- nie stosować naczyń szklanych!
HCLO4 - nie tworzy kompleksów z metalami, chlorany VII łatwo rozpuszczalne. W analizie organicznej NIEBEZPIECZNY (w szczególności tłuszcze) - reakcje wybuchowe
Wodorotlenki rzadziej są stosowane ponieważ tworzą trudno rozpuszczalne wodorotlenki.
Roztwarzanie przeprowadza się w naczyniach otwartych, można prowadzić również w bombach teflonowych (metalowy pancerz z grzałką w środku) - układ zamknięty.
3) Stapianie
Ma na celu przeprowadzenie próbki w substancje rozpuszczalne, ewentualnie roztwarzane. Stosujemy topniki (zachodzi reakcja chemiczna). Jeżeli próbka ma charakter kwaśny stosujemy topniki alkaliczne (Na2CO3, Na2CO3 + K2CO3, Na2CO3 + Na2B4O7, Na2CO3 + Na2O2, NaOH), jeżeli zasadowy - topniki kwaśne
4) Mineralizacja
W wyniku tego procesu pozbywamy się materii organicznej i otrzymujemy substancję wyłącznie mineralną (np. CCO2, HH2O, nN2)
Rozróżniamy:
mineralizację suchą - spalenie próbki, pozbycie się w wyniku spalenia części organicznej, pozostaje mineralny popiół. Metody tej nie można stosować w analizie śladowej i przy niskich stężeniach Pb, Cd, Hg, Sb, Sn bo tworzą lotne chlorki, a temp nie powinna przekraczać 500C, a w tej temp nie zawsze można przeprowadzić mineralizację.
mineralizacja mokra z udziałem kwasów utleniających. Badaną próbkę zalewamy stężonym kwasem (najczęściej azotowym, czasem jest wspomagany kwasem siarkowym lub H2O2) - zawsze w podanej kolejności! Bo inaczej próbka pokryje się węglikiem i kolejne porcje stężonego kwasu nie penetrowałyby próbki (może się zapalić). Trwa nawet kilka dni - roztwór musi być klarowny, najlepiej bezbarwny lub lekko żółty.
Kolba Schőnigera: do kolby wprowadzamy czysty tlen (po wyjąciu korka ze spiralą), na dno wprowadzamy r-ór pochłaniający lotne produkty, zamykamy zwykłym korkiem. Nasączamy pasek bibuły substancją którą badamy, wkładamy ja do spirali z Pt, podpalamy pasek i szybko zamykamy [przygotowaną kolbę. Związki siarki i chloru (które się utleniają) są pochłaniane przez r-ór na dnie kolby.
mineralizacja mokra mikrofalowa - polega na tym, że próbka ogrzewana jest za pomocą skupionej wiązki promieni w piecach mikrofalowych, które pozwalają na mineralizację do 10 próbek. Taka mineralizacja trwa około pół godziny, otrzymuje się dobrze klarowne r-ry, bezbarwne lub lekko żółte w zależności od składu związku
TECHNIKI WYDZIELANIA ANALITÓW:
analit - to co oznaczamy
matryca - to co towarzyszy próbce (tego nie oznaczamy)
PRÓBKI ŚRODOWISKOWE (gleba, woda wodociągowa, powierzchniowa, ścieki, gazy: odlotowe, spalinowe, atmosfera)
Najczęściej do tego celu stosuje się ekstrakcję:
korzyści:
- przeniesienie agalitów do matrycy o znacznie prostszym składzie niż matryca pierwotna próbki, czyli do czystych rozpuszczalników lub gazów nośnych
- zmniejszenie interferencji na dalszych etapach analizy
- możliwość podniesienia agalitu w matrycy odbierającej (wzbogacenie, natężenie)
wady
- możliwość straty części agalitu
- możliwość zanieczyszczenia próbki
- wydłużenie czasu trwania cyklu analitycznego
2) PRÓBKI GAZOWE
a) ekstrakcja do fazy stałej
- próbkę przepuszcza się przez sorbenty (np. filtry, rurki sorbacyjne wypełnione węglem aktywnym)
- sita molekularne o różnej wielkości por
- węgiel : zatrzymuje substancje polarne; węgiel grafitowy- niepolarne
- polimery o różnej generacji
Analit znajduje się na sorbencie- następnie prowadzi się ekstrakcje w odpowiednim rozpuszczalniku
b) mikroekstrakcja do fazy stałej - jeśli mamy mikrozanieczyszczenia próbek gazowych , stosujemy włókno szklane pokryte filtrem polimetylosiloksanem
c) ekstrakcja do fazy ciekłej - polega na przepuszczeniu strumienia próbki gazowej przez płuczkę lub zestaw płuczek wypełnionych r-rem pochłaniającym
d) ekstrakcja membranowa - anality dyfundują z medium gazowego poprzez cienką membranę (silikonową, teflonową) do strumienia gazu nośnego mywającego membranę
3) PRÓBKI CIEKŁE
a) ekstrakcja do fazy ciekłej (ekstrakcja ciecz - ciecz). Obowiązuje tu prawo podziału Nernsta k=c1/c2
Rozpuszczalnik który używamy do ekstrakcji musi słabo rozpuszczać się w wodzie, powinien posiadać dużą lotność (ułatwi to jego odparowanie), powinien być wysokiej czystości (aby nie zanieczyszczać próbki)
wady
- duże zużycie rozpuszczalników
- wysoka toksyczność większości rozpuszczalników
- konieczność odparowania rozpuszczalnika
- mała selektywność procesu ekstrakcji
- powstawanie emulsji
- konieczność utylizacji dużej ilości rozpuszczalników
b) ekstrakcja do fazy gazowej (analiza fazy nadpowierzchniowej). Próbkę umieszcza się w naczyniu, ogrzewa się je. Nad powierzchnia wydostają się anality, pobiera się próbkę i wprowadza do chromatografu gazowego
c) ekstrakcja do fazy stałej (spe) - zestaw do tej ekstrakcji składa się z kolumienek wypełnionych sorbentem (np. żel krzemionkowy)
zalety
- możliwość izolacji i wzbogacenia lotnych i nielotnych agalitów
- możliwość przechowywania analitów przez dłuższy czas
- drastyczne zmniejszenie używanych rozpuszczalników
- wyeliminowanie problemów z tworzeniem się emulsji
- szeroki wybór sorbentów
4) PRÓBKI STAŁE
a) ekstrakcja do fazy gazowej - analiza fazy nadpowierzchniowej
b) ekstrakcja do fazy ciekłej - techniki klasyczne ciało stałe-ciecz: próbkę odwadniamy i wlewamy odpowiednią ilość rozpuszczalnika, wytrząsamy w mechanicznych wytrząsarkach, sączymy albo wirujemy i oddzielamy osad od ekstraktu.
Ponadto stosuje się jeszcze ultradźwięki albo mikrofale.
OZNACZANIE
wody
- woda higroskopijna (zaadsorbowana, ściśle skondensowana na powierzchni próbki)- oznaczamy przez wysuszenie próbki
- woda krystalizacyjna - woda, która wykrystalizowała razem z osadem np. CuSO4, Na2SO4 x 10H2O - oznaczamy przez suszenie w temp. 120-150C
- woda konstytucyjna- woda wydzielająca się przy rozkładzie termicznym niektórych substancji np. Ca(OH)2CaO + H2O ; 2NaHSO4 NaS2O7 + H2O
siarczan baru
Ba2+ +SO42-BaSO4 ; BaSO4 + 4C BaS + 4CO↑ ; BaS + H2SO4BaSO4 + H2S↑
Po spaleniu próbki osad (BaSO4) powinien być biały, (a nie szary), ponieważ C redukuje (już w temp. 600C) BaSO4 do Bas, można temu zapobiec dodając po wyprażeniu H2SO4 zgodnie z reakcją (3).
szczawianu wapnia
Ca2+ + C2O42- + H2O CaC2O4·H2O ==>(1100-1200C) CaO + Co + CO2 + H2O
Stopniowo ogrzewamy (nie wkładamy od razu do pieca nagrzanego do 1100-1200) w przeciwnym wypadku z naszej próbki nic nie zostanie (reakcja 2). W eksykatorze trzymamy nie dłużej niż 30min, ponieważ CaO będzie chłoną wodę z wypełnienia eksykatora.
magnezu
Mg2+ + NH4+ + HPO42- + 7H2OMgNH4PO4·6H2O + H3O+
MgNH4PO4·6H2O (1000C) Mg2P2O7 + 2NH3 + 13H2O
Nie można przekroczyć 1100C ponieważ pirofosforan rozłoży się. Jeżeli zamiast białego osadu powstaną „perełki” oznaczenie należy powtórzyć
Magnez można oznaczyć również w postaci kompleksu ( 8- hydroksyhinolina ; toksyna)
Mg2+ + 2C9H6NOH Mg(C6H6NO)2 + 2H+
Ph>9 reakcja przebiega ilościowo, powstaje żółtozielony osad który tylko suszymy (105C), nie prażymy. Powyżej 105C powstaje osad bezwodny- niebezpieczeństwo rozkładu
srebra
Ag+ + Cl- AgCl↓ ==> AgCl(światło) Ag↓ + ½Cl2
Powstaje biały serowaty osad. Suszymy w temp 130C. AgCl należy chronić przed światłem ponieważ się rozkłada (reakcja2)
żelazo (w postaci wodorotlenku)
Fe3+ + 3(NH3·H2O) + xH2O Fe(OH)3 · xH2O + NH4
Fe(OH)3 · xH2O - prażymy, oznaczamy jako Fe2O3
Powstaje kłaczkowaty osad, ogrzewamy (ale nie doprowadzamy do wrzenia bo powstanie śluzowaty osad, który źle się sączy). Prażymy w temp 1100C, jeżeli przekroczymy 1100C to osad się rozłoży wg reakcji: Fe2O3 4Fe3O4 + O2↑
WYTRĄCANIE Z ROZTWORÓW HOMOGENICZNYCH
(CH3)2SO4 + 4H2O 2CH3OH + 2H3O+ + SO42- rozkłada sie powoli
(CH3)2C2O4 + 4H2O 2CH3OH + 2H3O+ + C2O4-2
IO3- + 5I- + 3H2O 3I2 + 6OH-
CH2CSNH2 + 2H2O CH3COO- + NH4+ + H2S↑
CO(NH2)2 CO2↑ + NH3↑
ANALIZA ŚLADOWA
Jest działem analizy chemicznej, który zajmuje się wykrywaniem lub oznaczaniem składników próbki występujących w ilościach bardzo małych, tj. 0,01%
Ma zastosowanie w następujących dziedzinach:
- energetyka atomowa - oznaczanie zanieczyszczeń w paliwach jądrowych i materiałach reaktorowych (U, Zr, Mg, Al., Be)
- elektronika( mikroelektronika) - analiza materiałów półprzewodnikowych prostych jak Si i Ge,
- ochrona środowiska - badanie czysto sci powietrza, wód ścieków, gleb.
- biologia - oznaczanie zawartości toksycznych pierwiastków w materiałach biologicznych ( płyny ustrojowe, tkanki, kości)
- przemysł spożywczy (ochrona zdrowia) - oznaczanie śladowych pierwiastków toksycznych w żywności (np. w mięsie, mleku, owocach)
- metalurgia- oznaczanie zawartości pierwiastków wpływających na właściwości fizyczne metali i stopów
- geologia - badanie minerałów, skał i rud
- kryminologia - np. zawartość niektórych pierwiastków w pociskach
- archeologia - np. analiza starych zapraw budowlanych która umożliwia ustalenie z jakiego okresu pochodzi badany obiekt
Jednostki:
10-4% 1μg/g 1mg/kg 1ppm
10-7% 1ng/g 1μg/kg 1ppb
10-10% 1pg/g 1ng/kg 1ppt
10-13 1fg/g 1pg/kg ppg
Podstawowe założenia:
- prawidłowe przygotowanie próbki (straty i zyski agalitów)
- odpowiednio przygotowane laboratorium (atmosfera pomieszczenia, sprzęt, aparatura)
- rzetelne wzorce i materiały odniesienia
Ogólny schemat analizy śladowej:
pobieranie, rozdrabianie, mieszanie - nie używamy odczynników cz.d.a (czyste do analizy)
mineralizacja, roztwarzanie. Stosuje się mineralizację mokrą, nie wolno stapiać próbki
wzbogacenie, oznaczanie. Trzeba uważać na lotność analitu w trakcie odparowywania rozpuszczalnika
KONTAMINACJA - nie zamierzone wprowadzenie analitu z zewnątrz do próbki. Pierwiastki ulegające kontaminacji : Fe, Zn, Pb, Al., Si, Ca.
Pierwiastki nie sprawiające trudności w analizie śladowej to : Au, Te, Ga, Be.
ŚLEPA PRÓBKA - musi mieć co najmniej dwa rzędy mniej analitu niż w badanej próbce
W analizie śladowej używa się naczyń kwarcowych (mają duży współczynnik rozszerzalności cieplej, są bardzo). Lepiej jednak korzystać z naczyń z tworzywa sztucznego np. teflonu Naczynie używane do analizy może zanieczyszczać lub zatrzymywać analit (zachodzi sorpcja składników śladowych na ściankach naczynia), dlatego należy rozważnie dobierać szkło do analizy śladowej.
Do analizy śladowej powinna być używana woda: demineralizowana , przedestylowana z aparatury kwarcowej
Nie musimy usuwać z analitu pierwiastka, który nam przeszkadza, możemy przekształcić go w związek, który nie będzie wpływał na dalszą analizę - MASKOWANIE
SPECJACJA
Jest to rozróżnianie różnych form danego pierwiastka
ANALIZA SPECJACYJNA - wykrywanie i oznaczanie poszczególnych form danego pierwiastka (by dowiedzieć się o formach bezpiecznych i niebezpiecznych). Np. niektóre związki arsenu występujące w próbkach biologicznych: arsenian (III) AsO2-, arsenian (V) AsO43-, kwas monometyloarsenowy CH3AsO(OH)2, tlenek trimetyloarsyny (CH3)3AsO
Analiza specjacyjna stosowana jest przede wszystkim do:
1) określania toksycznego i ekotoksycznego działania poszczególnych pierwiastków
2) poznania pełnych cykli biogeochemicznych poszczególnych pierwiastków
3) kontrola jakości produktów żywnościowych
4) badania leków i produktów farmaceutycznych
Typy analizy specjacyjnej:
specjacja przesiewowa - należy wykryć i oznaczyć jedną formę analitu, np. ze względu na jej szczególnie wysoką ekotoksyczność lub rolę jaką odgrywa w cyklu biochemicznym
specjacja dystrybucyjna - dotyczy głównie próbek biologicznych- np. oznaczanie zawartości metali w poszczególnych częściach roślin
specjacja grupowa - polega na oznaczeniu określonej grupy związków w próbce, np. oznaczanie występowanie różnych form Hg
specjacja indywidualna - najtrudniejsza forma specjacji, ma na celu rozróżnienie i oznaczenie wszystkich indywiduów chemicznych zawierających w swoim składzie dany pierwiastek
specjacja fizyczna - rozróżnianie ze względu na formy fizyczne, np. czy analit jest lotny czy zaadsorbowany
Schemat postępowania analitycznego dla specjacji metali w wodzie:
Oznaczamy:
- wolne jony metali
- metale związane labilnie z ligandami organicznymi
- metale związanie trwale z ligandami organicznymi
- metale związane labilnie z ligandami nieorganicznymi
- metale związanie trwale z ligandami nieorganicznymi
- metale zaadsorbowane na materii organicznej
- metale zaadsorbowane na materii nieorganicznej
ANALIZA WAGOWA - GRAWIMETRIA
Opiera się na pomiarze masy. Oznaczanie jakiegoś składnika na podstawie osadu, np. oznaczamy Si z SiF4
ZAGADNIENIA TEORETYCZNE:
Wpływ na postać osadu ma szybkość następujących procesów:
Agregacja - proces tworzenia się agregatu, polegający na łączeniu się poszczególnych zarodków w skupienia. Przez agregat należy rozumieć grupę cząstek (skupienie cząstek) utrzymujących się razem w sposób dowolny
Aglomeracja - proces tworzenia się i wzrostu agregatów, prowadzący ostatecznie do wydzielenia osadów złożonych z cząstek o większych wymiarach niż wymiary cząstek koloidalnych. Różnica pomiędzy agregacją i aglomeracją polega na tym, że utworzony w wyniku agregacji agregat może pozostać w roztworze, natomiast aglomeracja prowadzi do wydzielenia osadu
Rekrystalizacja - polega na przejściu pierwotnych skupień o nieuporządkowanej budowie w uporządkowaną sieć krystaliczną w wyniku przekrystalizowania lub na rozpuszczeniu małych kryształów i wzroście większych.
RODZAJE OSADÓW:
krystaliczny - osad złożony z cząstek o uporządkowanej budowie sieciowej, tworzący podczas rozpuszczania na ogół r-ry rzeczywiste
a) drobnokrystaliczne, np. BaSO4
b) grubokrystaliczne , np. MgNH4PO4
2) koloidowy - złożony z cząstek o nieuporządkowanej budowie sieciowej, tworzący podczas rozpuszczania na ogół r-ry koloidalne, tj. żele
a) serowate, np. AgCl
b) galaretowate np. Al.(OH)3
c) liofilowe(tzw. odwracalne, „chętnie” przyłączające cząstki rozpuszczalnika)
d) liofobowe (koloidy nieodwracalne, nie wykazujące powinowactwa do rozp)
PROCESY ZWIĄZANE Z OSADAMI KOLOIDOWYMI:
Peptyzacja - przeprowadzenie żelu, czyli świeżo strąconego osadu koloidowego, w zol pod wpływem przemywania czystym rozpuszczalnikiem. Polega na usunięciu z osadu zaadsorbowanych jonów koagulacyjnych - cząstki koloidalne odzyskują swój pierwotny ładunek i zaczynają się odpychać.
Koagulacja (flokulacja) polega na tworzeniu się i wzroście agregatów, prowadzacym ostatecznie do wydzielenia fazy stałej (żelu lub osadu) w skali makroskopowej. Odróżnia się koagulacje nieodwracalna (żelu lub osadu nie można przeprowadzić z powrotem w stan zolu) i odwracalną ( żel może być przeprowadzony z powrotem w stan zolu)
WSPÓŁSTRĄCANIE
Jest procesem nieodłącznie związanym ze strącaniem osadu. Jest to jednoczesne wytrącanie z r-ru związku rozpuszczalnego w danych warunkach wraz z trudno rozpuszczalnym osadem makroskładnika. W wyniku współstrącenia następuje zanieczyszczenie strącanego osadu substancjami, które w warunkach wytracenia są rozpuszczalne w r-rze.
Współstrącenie zachodzi w wyniku:
adsorpcji - zagęszczenia się substancji(adsorbatu) na powierzchni międzyfazowej (granicy dwóch faz) fazy skondensowanej lub płynnej (adsorbentu), wynikające z działania sił powierzchniowych. W wyniku adsorpcji zachodzi zatrzymanie łatwo rozpuszczalnych substancji znajdujących się w roztworze. Powoduje to zanieczyszczenie osadów.
okluzji - czyli proces włączania do osadu cząsteczek substancji obcych, zachodzący w czasie formowania osadu. Okluzja polega na ogół na adsorpcji obcych cząsteczek, które następnie na skutek szybkiej krystalizacji (szybkiego wzrostu kryształu) zostają zatrzymane w jego wnętrzu.
tworzenia kryształów mieszanych
Kryształ mieszany jest to kryształ, który oprócz zasadniczego, macierzystego składnika zawiera drugi składnik wbudowany i rozprowadzony w sieci krystalicznej macierzystego składnika.
Wytracania następczego (postrącanie) które polega na wytrącaniu na powierzchni osadu innej substancji, zazwyczaj o wspólnym jonie z osadem, zachodzącym na ogół w czasie powstawania osadu w kontakcie z r-rem macierzystym.
tworzenia określonych związków
ZAPOBIEGANIE WSPÓŁSTRĄCANIU
Aby zapobiec współstrąceniu, należy podczas wytrącania osadu odczynnik wytracający dodawać stopniowo w podwyższonej temp do energicznie mieszanych rozcieńczonych-rów, zawierających często dodatek substancji zwiększających rozpuszczalność osadu nie tylko w odpowiedniej postaci, lecz także czystości. W celu uwolnienia wytrąconych osadów od domieszek poddaje się je:
- starzenie osadu - zmiana właściwości osadu pozostającego w r-rze macierzystym w miarę upływu czasu. Zmiana ta może następować na skutek np. wzrostu kryształu, rekrystalizacji, straty wody lub współstrąconych jonów
- wytrącanie kilkakrotne (najczęściej 2-krotne) polega na odsączeniu osadu, przemyciu go w celu usunięcia większości domieszek, następnie rozpuszczeniu i powtórnym wytraceniu oznaczonego składnika
OZNACZANIE SIARCZANÓW W POSTACI BaSO4
Zasada metody polega na wytrąceniu siarczanu baru z gorącego, kwaśnego r-ru przez dodanie rozcieńczonego BaCl2
Wytrącanie osadu : SO42- + Ba2+ BaSO4
Wytrącamy na gorąco przy pomocy odczynnika strącającego BaCl2 małymi porcjami przy ciągłym mieszaniu. Jeżeli zbyt szybko dodamy BaCl2 nastąpi przesycenie r-ru w jednym miejscu i powstaną duże ilości zarodków krystalizacji (osad drobnokrystaliczny). Wytrącanie prowadzimy w podwyższonej temp, co powoduje wzrost rozpuszczalności osadu, małe kryształy rozpuszczają się w duże wzrastają. Osady drobnokrystaliczne adsorbują więcej zanieczyszczeń i źle się sączą. Mieszanie zapobiega przesyceniu miejscowemu. Osad po wytrąceniu ogrzewa się dalej, a następnie poddaje się starzeniu. Należy jeszcze sprawdzić odczynnikiem strącającym r-ór znad osadu.
Sączenie osadu
Wytrąconego osadu nie mieszamy, tylko najpierw zlewamy r-ór znad osadu (dekantacja). Stosujemy tylko lejki ilościowe, sączymy przy uzyciu bagietki.
Po odsączeniu osad przemywamy, należy uważać żeby nie rozpryskać osadu (używamy bagietki). Przemywamy aż do całkowitego usunięcia chlorków - Sprawdzenie całkowitego odmycia
Suszenie i prażenie
Sączek najpierw suszymy na szkiełku zegarkowym, a następnie przenosimy do wyprażonego (do stałej masy) wcześniej tygla Następnie sączek spalamy (na biały popiół) i wkładamy do pieca i prażymy.
Ważenie
Wszelkie ważenia przeprowadzamy na wadze analitycznej (dokładność pomiarów 0,0001), Sprawdzając wcześniej czy waga jest czysta oraz czy dobrze jest ustawiony punkt zerowy. Należy pamiętać o aretowaniu wagi (włączanie i wyłączanie) - wykonywać bardzo delikatnie
ANALIZA MIARECZKOWA
Jest działem analizy ilościowej, której podstawą jest miareczkowanie, a oznaczanie substancji prowadzi się najczęściej na podstawie mierzenia objętości r-ru, którym się miareczkuje (titrantu). Miareczkowanie jest procesem oznaczania substancji A przez stopniowe dodawanie do jej r-ru porcji substancji B (prawie zawsze jako titrantu), w warunkach umożliwiających stwierdzenie punktu końcowego, odpowiadającemu maksymalnemu przereagowaniu substancji A. Podstawą określenia ilości substancji A jest wyznaczenie ilości B potrzebnej do osiągnięcia punktu końcowego. Stosunek, w jakim reagują substancje A i B, znany jest ze stechiometrii reakcji lub innych danych.
Metody miareczkowe można podzielić według trzech podstawowych kryteriów:
Typu reakcji zachodzącej podczas miareczkowania i związku będącego titrantem
a) ALKACYMETRIA - polega na reakcji kwas - zasada i obejmuje dwa działy:
- alkalimetrię - oznaczanie substancji przez miareczkowanie mianowanym r-rem zasady
- acydymetrię - oznaczanie substancji przez miareczkowanie mianowanym r-rem kwasu
b) REDOKSYMETRIA polega na reakcji utleniania i redukcji obejmuje dwa działy:
- oksydymetrię - oznaczanie substancji przez miareczkowanie r-ami utleniaczy (mananometria, jodometria, bromianometria, jodanometria, chromianometria, cerometria)
- reduktometrię - oznaczanie substancji przez miareczkowanie r-rami reduktorów(ferrometria, tytanometria, askorbinometria)
c) KOMPLEKSOMETRIA polega na tworzeniu rozpuszczalnych, słabo dysocjowanych (trwałych) związków kompleksowych.
- kompleksonometria, w której titrantami są r-ry kompleksonów tworzących z metalem kompleksy chelatowe
- miareczkowanie kompleksometryczne- nie tworzą się kompleksy chylatowe (pierścieniowe)
d) MIARECZKOWANIA WYTRĄCENIOWE polegają na reakcji wytrącania trudno rozpuszczalnych osadów w wyniku łączenia jonów titrantu i substancji oznaczanej (argentometria, merkurometria)
2) Sposobu przeprowadzania oznaczenia miareczkowego
a) miareczkowania bezpośrednie polega na tym, że oznaczana substancja reaguje bezpośrednio z dodawanym titrantem . w miareczkowaniu tym używa się tylko jednego r-ru mianowanego (titrantu)
b) miareczkowania pośrednie polega na tym, że oznaczana substancja nie reaguje bezpośrednio z titrantem, lecz pośrednio (przez reakcje stechiometryczną) z inną substancją, którą się miareczkuje. Najczęściej stosowane jest:
- miareczkowanie odwrotne (odmiareczkowanie nadmiaru) polega na tym, że do badanego r-ru dodaje się odmierzoną ilość r-ru mianowanego w nadmiarze, a następnie nadmiar odmiareczkowuje się odpowiednio dobranym titrantem. Potrzebne są więc dwa r-ry mianowane: r-ór mianowany który dodaje się w nadmiarze i titrantu. Miareczkowanie to stosuje się w przypadku wolno przebiegających reakcji lub wówczas, gdy trudno jest dobrać odpowiedni wskaźnik do miareczkowania bezpośredniego, jak np. podczas oznaczania chlorków przez miareczkowanie r-rem AgNO3 w środowisku kwaśnym.
- miareczkowanie podstawieniowe (substytucyjne), plega na tym, że oznaczany składnik A uwalnia z odpowiedniego związku równoważną ilość składnika B, miareczkowaną następnie bezpośrednio. Miareczkuje się zatem nie oznaczany składnik, lecz jego podstawnik, tj. substancje będącą produktem reakcji oznaczanego składnika z odpowiednik odczynnikiem. Ten sposób miareczkowania stosuje się najczęściej w kompleksometrii.
3) sposobu wyznaczania punktu końcowego
PUNKT KOŃCOWY MIARECZKOWANIA (PK) jest to punkt miareczkowania, w który jakaś własność r-ru, np. barwa spowodowana dodaniem wskaźnika, wykazuje wyraźną zmianę, odpowiadającą dość ściśle punktowi równoważności. Jest to więc doświadczalnie ustalony koniec miareczkowania. Punkt końcowy może być określany wizualnie lub za pomocą metod instrumentalnych.
ALKACYMETRIA
Podstawowymi reakcjami w alkacymetrii są reakcje dysocjacji, zobojętnienia i hydrolizy
STAŁA DYSOCJACJI jest stosunkiem iloczynu stężeń jonów, na które dysocjuje dany elektrolit, do stężenia cząsteczek niezdysocjowanych w warunkach równowagi.
STOPIEŃ DYSOCJACJI jest to stosunek liczby cząsteczek dysocjowanych do ogólnej liczby cząsteczek danego elektrolitu przed dysocjacją.
Wielkości te określają moc kwasu lub zasady. Są charakterystyczne dla słabych kwasów i zasad; mocne kwasy i zasady oraz sole są zdysocjowane całkowicie.
REAKCJA ZOBOJĘTNIANIA - reakcja z której z kwasu i zasady powstaje sól i woda. Utworzenie soli obserwuje się dopiero po odparowaniu wody
REAKCJA HYDROLIZY - reakcja odwrotna do reakcji hydrolizy, czyli przebiega między wodą a solami słabych kwasów i mocnych zasad, solami mocnych kwasów i słabych zasad lub solami słabych kwasów i słabych zasad. W wyniku hydrolizy r-ór przyjmuje odczyn kwaśny lub zasadowy zależnie od rodzaju soli
STAŁA HYDROLIZY jest to stała równowagi reakcji hydrolizy. Dla soli słabego kwasu i mocnej zasady jest to Kh= Kw/KHA, dla soli mocnego kwasu i słabej zasady - iloraz iloczynu jonowego wody i stałej dysocjacji zasady.
STOPIEŃ HYDROLIZY określa ułamek całkowitego stężenia soli, która uległa hydrolizie. Zależy on od stałej dysocjacji kwasu lub zasady tworzących sól oraz od stężenia soli i zwiększa się wraz z rozcieńczeniem.
Wielkości te są charakterystyczne dla soli ulegających hydrolizie.
PROTOLIZA- reakcja wymiany protonu między kwasem oddającym proton i zasadą przyjmującą proton, termin ten jest synonimem reakcji kwas - zasada, przebiegającej w rozpuszczalniku protonowym, w którym - tak jak w wodzie - dysocjacja jest związana z przeniesieniem protonu z jednej cząsteczki do drugiej
WSKAŹNIKI KWASOWO-ZASADOWE
Inaczej wskaźniki pH są to związki, przeważnie organiczne, które zmieniają swoją barwę w określonym zakresie pH r-ru. SA stosowane do wyznaczania punktu końcowego miareczkowania alkacymetrycznego i określenia pH r-ru.
Zakres pH, w którym występuje przejściowe zabarwienie wskaźnika nazywa się zakresem zmiany barwy wskaźnika, np. dla fenoloftaleiny zakres ten leży w granicach pH 8-10,
Niektóre wskaźniki stosowane w alkacymetrii:
- oranż metylowy barwa postaci kwasowej - czerwona; zasadowej - żółta pH 3,1-4,4
- błękit tymolowy barwa postaci kwasowej - żółta; zasadowej - niebieska pH 8-9,6
-fenoloftaleina barwa kwasowej- bezbarwna; zasadowej-czerwonofioletowa pH 9,3-10,5
W zależności od związku miareczkowanego i titrantu można rozróżnić następujące warianty miareczkowania alkacymetrycznego:
- miareczkowanie mocnego kwasu mocną zasadą
- miareczkowanie mocnej zasady mocnym kwasem
- miareczkowanie słabego kwasu mocną zasadą
- miareczkowanie słabej zasady mocnym kwasem
- miareczkowanie słabego kwasu słabą zasadą i odwrotnie
W dwóch pierwszych przykładach miareczkowanie polega na tej samej podstawowej reakcji proteolizy . Ostatni przypadek praktycznie nie ma znaczenia, ponieważ mając możliwość wyboru rodzaju titrantu zawsze się wybiera mocny kwas lub mocną zasadę., dzięki czemu uzyskuje się lepsze wyniki
PROCENT ZMIARECZKOWANIA - stosunek ilości substancji miareczkowanej, która przereagowała z titrantem, do ilości tej substancji przed miareczkowaniem, wyrażony w procentach.
KRZYWA MIARECZKOWANIA alkacymetrycznego jest obrazem graficznym zależności pH r-ru do objętości dodawanego titrantu (ml lub % miareczkowania)
Skok miareczkowania - gwałtowna zmiana wartości pH w pobliżu punktu równoważności
ROZTWORY BUFOROWE pH - r-ry słabego kwasu i jego soli z mocną zasadą oraz słabej zasady i jej soli z mocnym kwasem, wykazujące stałe stężenie jonów wodorowych, które praktycznie nie ulega zmianie podczas rozcieńczenia lub po dodaniu niewielkich ilości mocnych kwasów lub zasad. Roztworami buforowymi mogą być również r-ry soli kwasów wieloprotonowych (KH2PO4). Wg teorii protonowej, r-ry buforowe są to układy zawierające sprzężoną parę kwas-zasada, których stężenia analityczne są wystarczająco duże i mogą być zmieniane niezależnie od siebie. R-ry buforowe zachowują podczas rozcieńczenia stałe pH, ponieważ zależy ono od stosunku stężeń składników r-ru buforowego a nie od ich bezwzględnych stężeń. Zabezpieczają przed zmianą pH zarówno na skutek dodania mocnego kwasu lub mocnej zasady.
Zdolność przeciwstawiania się wpływom zmieniającym pH - pojemność buforowa
SUBSTANCJE WZORCOWE I R-RY MIANOWANE
Substancja wzorcowa służy do przygotowania r-rów wzorcowych, czyli r-rów o dokładnie znanym stężeniu pierwiastka, jonu lub grupy pochodzącej z substancji użytej do sporządzenia tego r-ru, takie cech jak np. pH, przewodnictwo elektryczne, wzorcowa barwa, mętność dla takiego r-ru są dokładnie znane.
Roztwór mianowany jest to r-ór o dokładnie znanym stężeniu określonego składnika, przeznaczony do miareczkowania.
Mianowanie r-rów polega najczęściej na miareczkowaniu odważek substancji wzorcowych. Jest to sposób dokładniejszy niż miareczkowanie r-rów wzorcowych, gdyż przy oznaczaniu miana jednego r-ru za pomocą drugiego mianowanego r-ru może nastąpić sumowanie błędów.
W alkacymetrii jako titrantów używa się r-rów mocnych kwasów lub zasad, najczęściej jest to kwas solny i wodorotlenek sodu.
Kwas solny jest kwasem trwałym nie wykazującym własności utleniających, chlorki zaś są związkami na ogół dobrze rozpuszczalnymi. Rzadziej jest stosowany kwas siarkowy, który tworzy trudno rozpuszczalne sole z wapniowcami.
Miano r-rów kwasów ustala się najczęściej stosując jako substancje wzorcowe bezwodny węglan sodu (Na2CO3) i boraks (Na2B4O7 · 10H2O)
Przykład : mianowanie r-ru HCl
W naczyńku wagowy odważa się odpowiednią ilość Na2CO3 i przenosi ilościowo do kolby stożkowej, dodaje się wodę destylowaną oraz 2-3 krople oranżu metylowego i miareczkuje r-rem HCl z biurety. Miareczkowanie prowadzi się aż do pojawienia się barwy cebulkowej. Wykonuje się przynajmniej 3 oznaczenia
Do mianowania zasad jako substancje wzorcowe stosuje się kwas szczawiowy, wodoroftalan potasu, kwas benzoesowy i inne.
Kwas szczawiowy jest najczęściej stosowany, można łatwo otrzymać go w stanie czystym, nie jest higroskopijny.
Wodoroftalan potasu jest substancja niehigroskopijną i można go otrzymać w bardzo czystej postaci.
Przykład: mianowanie r-ru NaOH
W celu ustalenia miana NaOH przygotowuje się odważki kwasu szczawiowego, rozpuszcza się je w wodzie destylowanej, dodaje 3 krople fenoloftaleiny i miareczkuje r-rem NaOH do chwili pojawienia się bladoróżowego zabarwienia, utrzymującego się w ciągu pół minuty. Należy wykonać co najmniej 3 oznaczenia
REDOKSYMETRIA
Podstawą tego działu analizy miareczkowej są reakcje utleniania i redukcji.
REAKCJA REDUKCJI tj przyłączania elektronów można schematycznie zapisać :
Ox1 + n1e Red1 gdzie: Ox1-postać utleniona, Red - postać zredukowana
Schemat ten przedstawia układ utleniająco - redukujący zwany redoks.- układ zawierający dwa jony w których ten sam pierwiastek ma różne stopnie utlenienia, np. Fe3+ i Fe2+. Aby zachodziła reakcja utleniania i redukcji muszą istnieć w r-rze dwa układy redoks o przemianach zachodzących w kierunkach przeciwnych. Przeciwny redukcji będzie układ odpowiadający utlenieniu: Red2 Ox2 + n2e
Podstawowe znaczenie w redoksymetrii ma POTENCJAŁ REDOKS- charakteryzuje on w pewnym sensie powinowactwo postaci utlenionej układu do elektronów. Im wyższy potencjał tym silniejszym utleniaczem jest dany układ. Różnica potencjałów redoks dwóch elektrod jest równa sile elektromotorycznej ogniwa. Potencjał redoks jest więc potencjałem elektrody platynowej lub z innego metalu szlachetnego zanurzonej w r-rze zawierającym układ redoks. Potencjał redoks takiego półogniwa opisuje równanie Ernsta: ![]()
gdzie : Eo- potencjał normalny danego układu redoks
Ponieważ nie można obliczyć ani wyznaczyć bezwzględnych wielkości potencjałów, mierzy się je w stosunku do pewnego potencjału wzorcowego - elektroda wodorowa (Eo elektrody wodorowej jest równe 0)
WSKAŹNIKI REDOKS
Koniec miareczkowania w redoksymetrii może być stwierdzony różnymi sposobami. Często na koniec miareczkowania wskazuje zabarwienie r-ru, występujące na skutek dodania nadmiaru silnie zabarwionego titrantu (w przypadku gdy produkty reakcji są bezbarwne lub słabo zabarwione)np. miareczkowanie r-rem KMNO4 (różowe zabarwienie), r-rem Ce(SO4)2 (żółte zabarwienie). W innych przypadkach miareczkowań wizualnych stosuje się wskaźniki redoks - substancje barwne, które tworzą układy redoks, przy czym postać utleniona wskaźnika jest inaczej zabarwiona niż postać zredukowana. Wskaźnik redoks zmienia barwę w punkcie lub blisko punktu równoważności
Znając obszar zmiany barwy wskaźnika (albo jego potencjał normalny) można przewidzieć jego barwę w r-rze o określonym potencjale redoks. Możemy więc tak dobrać wskaźnik, aby obszar zmiany jego barwy przypadł na wartość potencjału równoważności miareczkowania. Przykładowe wskaźniki: czerwień obojętna (zredukowana - bezbarwna, utleniona- czerwona), błękit Nilu (bezbarwna-niebieska).
Oprócz wskaźników redoks odwracalnych, w których przejścia między różnie zabarwioną postacią zredukowaną i utlenioną są odwracalne, stosowane są również wskaźniki redoks nieodwracalne. Przy określonym potencjale redoks ulegają one nieodwracalnej reakcji z równoczesną zmianą barwy. Np. oranż metylowy, który służy jako wskaźnik do miareczkowania Sb3+ za pomocą KBrO3, nadmiar bromianu powoduje nieodwracalne odbarwienie wskaźnika
KRZYWA MIARECZKOWANIA redoks jest wykresem zmian potencjału redoks zachodzących w czasie miareczkowania na skutek zmian stosunku stężeń postaci utlenionej i zredukowanej .Zmiany potencjału redoks można określić z pomiarów potencjału lub obliczyć teoretycznie na podstawie wzoru Nernasta .
MANGANOMETRIA
Jest działem oksydymetrii, w którym oznaczanie substancji prowadzi się za pomocą miareczkowania r-rem KMnO4, który należy do najsilniejszych utleniaczy stosownych w metodach oksydymetrycznych. Jest substancją zabarwioną co sprawia że nie wymaga stosowania wskaźników do określenia końca miareczkowania. Może być stosowany do oznaczania związków organicznych i nieorganicznych, w środowisku kwaśnym jak i zasadowym. Nie można go otrzymać w postaci dostatecznie czystej, aby mógł być używany jako substancja wzorcowa do bezpośrednio przygotowanego r-ru mianowanego. Kryształy KMnO4 są na powierzchni zanieczyszczone MnO2, który należy usunąć (pozostawia się r-ór KMnO4 na kres dwóch tygodni przed użyciem). R-ór KMnO4 powinien być przechowywany w butelce z ciemnego szkła, zamkniętej korkiem szklanym (kawałki gumowego korka oraz światło mogą przyspieszyć redukcje)
Mianowanie r-ru KMnO4 szczawianem sodu:
Sporządza się r-ry szczawianu wapnia bezpośrednio przed miareczkowaniem (są nietrwałe) - odważa się odpowiednią ilość Na2C2O4 i rozpuszcza w wodzie, dodaje się H2SO4 rozcieńczony (1:4) i ogrzewa do temp. 70C. Tak przygotowany r-ór miareczkuje się KMnO4. Początkowo wprowadza się r-ór z biurety małymi porcjami, czekając aż kolejna porcja się odbarwi, a następnie miareczkuje się, w sposób ciągły, stale mieszając. Pod koniec miareczkowania dodaje się kroplami r-r nadmanganianu, aż do wystąpienia trwałego (w ciągu 30s) zabarwienia różowego.
Przykład: oznaczanie jonów wapnia
R-ór wapnia rozcieńcza się wodą destylowaną a następnie dodaje stężonego HCl oraz kilka kropli oranżu metylowego, następnie ogrzewa się do wrzenia. Do wrzącego r-ru dodaje się szczawianu amonu oraz r-ór amoniaku do wyczuwalnego zapachu i zmiany zabarwienia wskaźnika na żółto. Odstawia się na 2h na łaźnie wodną. Następnie sączy się przez twardy sączek a osad przemywa się wodą do zaniku obecności jonów szczawianowych w przesączu (sprawdzenie wycieku w reakcji z CaCl2)
Sączek z osadem przenosi się do zlewki w której prowadzono strącanie, przykleja do ścianki i spłukuje się osad wodą, dodaje się r-ór kwasu siarkowego i ogrzewa do ok. 70C. Gorący r-ór miareczkuje się mianowanym KMnO4 do pojawienia się różowego zabarwienia. Wtedy wrzuca się do r-ru przyklejony sączek (za pomocą bagietki) i dalej miareczkuje aż r-ór zabarwi się na kolor jasno różowy.
JODOMETRIA
Substancje oznacza się za pomocą miareczkowania mianowanym r-rem jodu (oksydymetria) lub odmiareczkowania wydzielonego jodu - miareczkowanie wydzielonego jodu najczęściej r-rem tiosiarczanu (reduktometria).
Substancje które oznacza się jodometrycznie można podzielić na dwie grupy:
- substancje których potencjały utleniające są niższe od potencjału układu I2/2I- - reakcja redukcji jodu przez oznaczane substancje
- substancje o potencjale utleniającym wyższym od potencjały układu I2/2I-, które utleniają jony I- do wolnego jodu.
Nastawianie miana tiosiarczanu na K2Cr2O7
Dichromian potasu można otrzymać w bardzo czystej postaci, toteż jest on dobrą substancja wzorcową. R-ry wodne K2Cr2O7 odznaczają się nieograniczoną trwałością. Nastawienie miana prowadzi się w następujący sposób: do kolby stożkowej wprowadza się wodę destylowaną, r-ór jodku potasu oraz r-ór H2SO4 oraz odważkę dichromianu potasu. Tak przygotowany r-ór odstawia się na 15 minut w ciemne miejsce, a następnie odmiareczkowuje się wydzielony jod r-rem tiosiarczanu sodu, dodając pod koniec miareczkowania skrobie i dalej miareczkuje do zmiany zabarwienia z ciemnogranatowej na zieloną (jasno niebieską).
Przykład: oznaczanie jonów miedzi
Miedź oznacza się jodometrycznie metoda pośrednią. Do lekko kwaśnego r-ru dodaje się nadmiar KI. Miedź redukuje się do miedzi (I), utleniając jony jodkowe do jodu, który miareczkuje się Na2S2O3.
R-ór zawierający miedź rozcieńcza się wodą, dodaje się H2SO4 , r-ór KSCN oraz r-ór Ki i po upływie 15 minut miareczkuje się r-rem tiosiarczanu sodu wobec skrobi do zmiany zabarwienia r-ru z granatowego na różowawy.
CHROMIANOMETRIA
Jest metodą oznaczania substancji za pomocą miareczkowania mianowanym r-rem dwuchromianu, najczęściej K2C2O7, który ma właściwości pierwotnej substancji wzorcowej, a jego wodne r-ry należą do najtrwalszych r-rów mianowanych, ale jest słabszym utleniaczem od KKnO4.
Przykład: oznaczanie żelaza
Do badanego dodaje się HCl, a następnie podgrzewa do ok. 70C unikając wrzenia. Do gorących r-rów wprowadza się kroplami r-ór SnCl2 do zaniku żółtego zabarwienia, po czym dodaje się jeszcze dwie krople nadmiaru tego odczynnika. R-ór ochładza się do temp pokojowej, dodaje HgCl2 (powinien pojawić się biały jedwabisty osad, jak się wydzieli szary z kropelkami rtęci oznaczenie powtórzyć!). Po około 3 minutach r-ór się rozcieńcza i dodaje stężony H2SO4, kwas fosforowy oraz 6-8 kropli difenyloaminy (wskaźnik) i miareczkuje r-rem dichromianu do zmiany barwy r-ru z zielonej (barwa pojawi się podczas dodawania titranta) na granatowo-niebieską.
KOMPLEKSOMETRIA
Jest to dział analizy miareczkowej, w którym oznacza się substancje za pomocą miareczkowania, w czasie którego następuje utworzenie rozpuszczalnych i słabo dysocjowanych kompleksów. W zależności od rodzaju tworzącego się kompleksu, miareczkowania kompleksometryczne można podzielić na takie, w których tworzą się kompleksy niechelatowe (kompleksy utworzone przez ligandy jednofunkcyjne) jednomiejscowe i kompleksy chylatowe, utworzone przez ligandy wielofunkcyjne (wielokleszczowe) - miareczkowanie chelatometryczne.
Do metod polegających na tworzeniu kompleksów niechelatowych (miareczkowanie kompleksometryczne niechelatometryczne) zalicza się np. argentometryczne oznaczenie cyjanków i oznaczenia merkurymetryczne- roztworem podstawowym jest Hg(NO3)2,
metoda tą można oznaczyć bardzo małe ilości chlorków, np. w wodzie wodociągowej
Kompleksometria umożliwia oznaczanie metodami bezpośrednimi i pośrednimi niemal wszystkich pierwiastków układu okresowego z wyjątkiem gazów szlachetnych, niektórych pierwiastków grupy V (N, P) i VI (Se, Te, Po) oraz Be, B i Si.
PODSTAWY TEORETYCZNE
ATOM CENTRALNY - atom lub jon będący ośrodkiem koordynacji (najczęściej jon metalu z grupy metali przejściowych). Dookoła atomu centralnego koordynowane są LIGANDY - jony lub cząsteczki połączone bezpośrednio wiązaniem koordynacyjnym z atomem centralnym.
LICZBA KOORDYNACJI - liczba wiązań utworzonych przez atom centralny, czyli liczba ligandów, które są zgrupowane w kompleksie prostym, dookoła atomu centralnego (najczęściej = 4 i 6) - liczba koordynacji wiąże się z przestrzenną strukturą kompleksu.
KOMPLEKSY CHELATOWE (pierścieniowe) - tworzą ligandy wielokleszczowe (wielofunkcyjne) które muszą oczywiście zawierać więcej niż jeden atom ligandowi (atom połączony bezpośrednio z atomem centralnym). Charakteryzują się tym przede wszystkim odczynniki organiczne. Jest to kompleks, w którym metal wchodzi w skład pierścienia utworzonego przez koordynację ligandu wielokleszczowego, czyli jest to cykliczny związek kompleksowy utworzony przez jon centralny i wielokleszowe ligandy.
STAŁA TRWAŁOŚCI - jest wielkością charakterystyczną dla kompleksów, podobnie jak stała dysocjacji dla kwasów lub zasad, potencjał utleniający dla układów redoks. Za kompleksy trwałe uważa się te, które praktycznie nie ulegają w r-rze dysocjacji, charakteryzują się dużymi wartościami stałych trwałości.
KOMPLEKSY LABILNE - kompleksy, w których ligandy można łatwo zastąpić innymi grupami, ponieważ charakteryzują się one dużą szybkością wymiany ligandów.
KOMPLEKSY BIERNE- kompleksy, które nie ulegają reakcji podstawienia lub ulegają jej z trudnością, ponieważ charakteryzuje je dość małą szybkość wymiany ligandów.
Reakcje wypierania (podstawiania) mają bardzo duże znaczenie w kompleksometrii, ponieważ podczas oznaczania kompleksometrycznego wobec wskaźników metalochromowych zachodzi wymiana ligandów (anion wskaźnika zostaje wyparty przez anion kompleksonu).
Kompleksy stosowane w oznaczeniach kompleksometrycznych powinny mieć odpowiednią trwałość i być labilne.
KOMPLEKSONY - grupa kwasów aminopolikarboksylowych, pochodnych kwasu iminodioctowego. Charakterystycznym ugrupowaniem kompleksonów jest atom N połączony z dwoma grupami karboksymetylowymi : - N=(CH2COOH)2. Tworzą bardzo trwałe związki kompleksowe niemal ze wszystkimi kationami wielowartościowymi. Najczęściej stosowany - komplekson III- EDTA - sól dwusodowa kwasu etylenodiaminatetraostowego; wersenian dwusodowy
KRZYWA MIARECZKOWANIA kompleksometrycznego przedstawia zmianę stężenia miareczkowanych jonów metalu, wyrażonego jako wykładnik stężenia jonów metalu (pM=-lg[Mn+]) w miarę dodawania r-ru mianowanego.
WSKAŹNIKI KOMPLEKSOMETRYCZNE:
wskaźniki redoks - oznaczanie wobec tych wskaźników polega na zmianie potencjału układu na skutek związania kationu w trwały kompleks
metalowskaźniki, które można podzielić
grupa I związki praktycznie bezbarwne, np. kwas salicylowy, które reagując z kationami tworzą barwne kompleksy
grupa II związki które reagując z kationem powodują zmętnienie, np. H2C2O4 dla Ca2+ tworzy zabarwione, nierozpuszczalne lub koloidalne laki
grupa III WSKAŹNIKI METALOCHROMOWE są to barwniki organiczne zdolne do tworzenia kompleksów z metalami, przy czym reakcji towarzyszy zmiana zabarwienia. Zmiany zabarwienia wskaźników tej grupy są ostrzejsze i wyraźniejsze niż wskaźników należących do grup poprzednich.
Najczęściej stasowane wskaźniki: czerń deriochromowa T, mureksyd, kalces
SPOSOBY MIARECZKOWANIA R-REM EDTA
Miareczkowanie bezpośrednie polega na stopniowym dodawaniu mianowanego r-ru EDTA do r-ru o odpowiednim pH, zawierającego oznaczany kation i wskaźnik aż do zmiany zabarwienia. Można oznaczyć m.in.:Mg, Ca, Zn, Cd, Ni, Pb.
Miareczkowanie odwrotne, czyli odmiareczkowanie, polega na dodaniu do r-ru zawierającego dany kation nadmiaru EDTA, który następnie odmiareczkowuje się mianowanym r-rem MgSO4 lub ZnSO4. następują tu zmiany barwy odwrotne niż w miareczkowaniu bezpośrednim, tzn. najpierw r-ór ma zabarwienie wolnego wskaźnika, a następnie punkcie końcowym - zabarwienie kompleksu z kationem, którego r-rem miareczkuje się. Stosuje się ją do oznaczenia m.in.: Mn(II), Pb(II), Al., Hg(II).
Miareczkowanie podstawieniowe polega na miareczkowaniu kationu wypartego z kompleksu. Metodę tę stosuje się przede wszystkim do oznaczenia jonów Ca2+ wobec czerni eriochromowej. Wapń tworzy z czernią kompleks zbyt mało trwały żeby można go było miareczkować bezpośrednio wobec wskaźnika.
Przykład: oznaczanie twardości całkowitej
Do badanej próbki wody dodaje się HCl , bufor amonowy oraz szczyptę czerni eriochromowej do uzyskania wyraźnego różowo-fioletowego zabarwienia r-ru. Miareczkuje się r-rem EDTA (kompleksonIII) do zmiany barwy r-r na niebieską.
Oprócz twardości całkowitej możemy oznaczyć twardość wapniową , węglanową oraz możemy oznaczyć zawartość jonów chlorkowych, niklu, żelaza, siarczanów.
MIARECZKOWE METODY WYTRĄCENIOWE. ARGENTOMETRIA
Do tego działu analizy miareczkowej należą metody polegające na reakcjach tworzenia się trudno rozpuszczalnych osadów o ściśle określonym składzie, powstających szybko i łatwo opadających na dno.
ARGENTOMETRIA - jest działem analizy miareczkowej, w której oznaczanie substancji prowadzi się przez miareczkowanie mianowanym r-rem soli srebra, najczęściej AgNO3
KRZYWA MIARECZKOWANIA reakcji wytrąceniowe przedstawia zmiany stężenia jonów miareczkowanych X, wyrażone jako pX- wykładnik stężenia danych jonów. X(pX=-lg[X]) w miarę dodawania r-ru mianowanego.
OZNACZANIE CHLORKÓW METODA MOHRA
Metoda ta ;polega na bezpośrednim miareczkowaniu obojętnego r-ru chlorku mianowanym r-re, AgNO3 w obecności K2CrO4 jako wskaźnika. W czasie miareczkowania wytrąca się najpierw trudno rozpuszczalny osad AgCl. Gdy praktycznie cała ilość jonów Cl- zostanie wytracona, nadmiar r-ru AgNO3 wytraca chromian srebra, którego brunatnoczerwone zabarwienie wskazuje na koniec miareczkowania.
Odczyn r-ru powinien być obojętny, ponieważ w środowisku kwaśnym tworzą się jony HCrO4- i Cr2O72-, powoduje to zmniejszenie stężenia jonów CrO4-, a w bardziej kwaśnych r-rach osad nie wytrąci się wcale.
Metody tej nie można stosować do oznaczania chlorków w obecności anionów tworzących w r-rach obojętnych trudno rozpuszczalne sole srebrowe (np. Br-,I-), kationów tworzących trudnorozpuszczalne chromiany (Ba2+, Pb2+) oraz substancji redukujących AgNO3 do srebra metalicznego (np. Fe2+).Metodą ta można oznaczać jeszcze bromki ale nie można oznaczać jodków i tiocyjanianów.
OZNACZANIE CHLORKÓW METODĄ VOLHARDA
Polega na dodaniu nadmiaru r-ru AgNO3 do zakwaszonego kwasem azotowym r-ru chlorku. Nadmiar AgNO3 odmiareczkowuje się mianowanym r-rem KSCN lub NH4SCN w obecności ałunu żelazowo-amonowego jako wskaźnika.
Po wytrąceniu srebra kropla nadmiaru r-ru tiocyjanianu powoduje powstanie różowego zabarwienia ponieważ tworzy się czerwony kompleks FeSCN2+. Zawartość chlorku oblicza się z różnicy początkowej objętości r-ru AgNO3 i objętości dodanego nadmiaru, która określa się na podstawie zużytej objętości r-ru tiocyjanianu.
Dużą zaletą tej metody jest możliwość miareczkowania chlorków w środowisku kwaśnym.
Adsorpcyjna Spektrometria Atomowa.
PODSTAWY TEORETYCZNE:
W wyniku wysokotemperaturowego wzbudzenia termicznego lub elektrycznego otrzymujemy próbkę, w której większość atomów jest wzbudzona. Emituje ona charakterystyczne promieniowanie.Jeżeli wzbudzenie zachodzi na skutek pochłonięcia promieniowania elektromagnetycznego, to podawana na próbkę wiązka światła może ulec mierzalnemu osłabieniu. To zjawisko jest podstawą ASA. Ponieważ atomy krótko przebywają w stanie wzbudzonym, to pochłonięta fotoenergia po czasie relaksacji ulega wypromieniowaniu tworząc widmo fluoroscencyjne. W metodzie ASA na wyższe poziomy po pochłonięciu energii przechodzą elektrony walencyjne atomów, niesie to za sobą wniosek, że oznaczenie pierwiastka w próbce tą metodą jest możliwe, jeżeli zostanie ona zatomizowana i wolne atomy będą mogły absorbować energię. Atomy powinny znajdować się w stanie podstawowym. Równowaga między liczbą atomów w stanie wzbudzonym i podstawowym w danym ośrodku zależy od temperatury i wielkości energii wzbudzenia.. Ponieważ energia promieniowania elektromagnetycznego jest odwrotnie proporcjonalna do długości fali to możemy wywnioskować,że więcej atomów w stanie wzbudzonym jest w parach pierwiastka absorbującego lub emitującego światło o dłuższej fali. Absorpcja promieniowania podlega prawu Lamberta-Beera:
It=I0*e-κ*N*l
It natężenie wiązki promieniowania po przejściu przez ośrodek zawierający oznaczane atomy;
I0-natężenie wiązki padającej;
κ- atomowy współczynnik absorpcji;
N- liczba atomów w stanie podstawowym;
l- długość drogi optycznej;
Absorbancja jest wprost proporcjonalna do liczby oznaczanych atomów co wynika ze wzoru:
A= log I0/It=2,303*κ*N*l
Spektrofotometry ASA:
Schemat:
źródło światła; 2- atomizer; 3- szczelina; 4- monochromator; 5- detektor
Źródło światła musi dostarczać promieniowania ściśle monochromatycznego. Długość fali promieniowania ze źródła musi być taka sama, jak długość fali odpowiadająca położeniu linii absorpcyjnej oznaczanego pierwiastka. W lampach stosowanych w metodzie ASA niezależnie od konstrukcji, promieniowanie uzyskuje się dzięki wzbudzeniu i wypromieniowaniu energii przez WYBRANY PIERWIASTEK.
Praktyczne zastosowanie w ASA znajdują lampy:
z katodą wnękową (do oznaczania jednego pierwiastka)
jarzeniowe(rtęciowe) (do oznaczania pierwiastków łatwo lotnych)
bezelektrodowe
Lampa z katodą wnękową której schemat przedstawiono poniżej
1-katoda;2-anoda;okienko kwarcowe
składa się z zestawu dwóch elektrod: katody w kształcie walca wykonanej z pierwiastka, której widmo ma emitować lampa(jeżeli jest to metal miękki, to pokrywa on jedynie powierzchnię szkieletowego twardego walca z innego materiału); anody, którą jest drut wolframowy lub niklowy. Elektrody umieszczone są w szklanej rurce zakończonej kwarcowym denkiem-okienkiem przez, które emitowane jest promieniowania. Wewnątrz rurki znajduje się gaz szlachetny (argon bądź neon) pod zmniejszonym ciśnieniem. W lampach komercyjnych katoda jest otoczona ceramiczną osłoną i dodatkowo izolowana krążkami wykonanymi z miki
Mechanizm pracy lampy jest następujący:
Napięcie rzędu kilkuset woltów przyłożone do elektrod powoduje jonizację gazu szlachetnego oraz przyspieszenie powstałych jonów w kierunku katody. Zderzenia anionów gazu z powierzchnią katody powodują wybijanie z niej atomów pierwiastka. Te z kolei napotykając na swojej drodze inne jony gazu ulegają wzbudzeniu i powracając do stanu podstawowego emitują promieniowanie.
Lampy bezelektrodowe. Podstawowym elementem jest zatopiona cienka rurka (o średnicy 5-10 mm) kwarcowa wypełniona argonem pod ciśnieniem kilku hPa, zawierająca miligramowe ilości badanego pierwiastka. Rurka jest na stałe zamontowana wewnątrz cewki dostarczającej energię o częstotliwości radiowej. Cały zestaw znajduje się wewnątrz osłony próżniowej i zamocowany jest na cokole zasilającym. Promieniowanie emitowane przez lampy bezelektrodowe charakteryzuje się największym natężeniem oraz najmniejszą szerokością połówkową linii pośród uzyskiwanych ze źródeł stosowanych w ASA.
Atomizery. Zadaniem atomizeru jest doprowadzenie jak największej liczby atomów w stanie podstawowym. Stosowanymi atomizerami są atomizery płomieniowe i bezpłomieniowe.
Atomizerami płomieniowymi są palniki o specjalnej konstrukcji. W specjalnych wypadkach stosuje się palniki z burzliwym przepływem gazów. Mieszanie gazów palnego i utleniającego odbywa się praktycznie u wylotu dyszy w momencie spalania. Zaletą takiego palnika jest bezpieczna praca, gdyż duża szybkość gazów eliminuje możliwość cofnięcia strefy palenia do jego wnętrza. Zaleta ta jest zarazem wadą palnika ponieważ próbka wprowadzana do płomienia przebywa w nim bardzo krótko, czas ten nie zawsze wystarcza na jej zatomizowanie i odpowiednio długie zatrzymanie w strefie analitycznej, którą jest odpowiednio wybrana część płomienia, przez którą przepuszcza się monochromatyczne promieniowanie ze źródła światła.
Palniki ze wstępnym mieszaniem gazów(z laminarnym przepływem gazów). Gazy łączone są w specjalnej komorze i po wymieszaniu w odpowiednich proporcjach, doprowadzane do szczeliny wylotowej. Palniki te charakteryzują się długą strefą analityczną, gdyż płomień formowany nad szczeliną ma kształt wąskiej płytki. Palniki te wymagają zachowania znacznej ostrożności i mogą być wykorzystywane w analizach z użyciem płomieni o średniej i małej szybkości rozprzestrzeniania, gdyż cofnięcie się strefy palenia do wnętrza grozi eksplozją. Obecnie eksplozjom zapobiega się dzięki specjalnej budowie palnika (obudowa palnika jest silnie żebrowana w celu poprawienia cyrkulacji powietrza) i intensywnemu chłodzeniu(z użyciem ciekłych mediów lub powietrza.
W spektrofotometrach ASA stosuje się dwa rodzaje palnych mieszanin gazowych:
powietrze/acetylen (do oznaczania litowców łatwo ulegających jonizacji)
Można w nich wyróżnić dwie strefy: wewnętrzną-świecącą o charakterze redukującym, i zewnętrzną- bezbarwną o charakterze utleniającym. Promieniowanie monochromatyczne przepuszcza się przez strefę utleniającą na wysokości kilku mm nad stożkiem redukującym. Temperatura osiągana (do 2400°C) zapewnia atomizację większości substancji. Jednak charakter utleniający tej strefy powoduje, że nie jest on odpowiedni dal pierwiastków tworzących stabilne tlenki. W warunkach oznaczania tlenki te powstają w palniku i nie ulegając dysocjacji zmniejszają wyniki analizy.
Tlenek dwuazotu/acetylen
Jego strefa analityczna ma charakter redukujący. W przekroju płomienia można wyróżnić trzy obszary: wewnętrzny -błękitno biały (h=2-4 mm), analityczny -czerwony(5-50 mm), i wtórnej reakcji utleniania gazu palnego- zewnętrzny -jaskrawoniebieskofioletowy. Atomizację i wzbudzane za pomocą dostarczanego promieniowania monochromatycznego prowadzi się w części wewnętrznej. Płomień osiąga temp do 2800°C. Metale są narażona w znacznym stopniu na jonizację a dodatkowo czerwona strefa analityczna emituje silne promieniowanie własne odpowiadające za znaczny poziom sygnału tła.
W płomieniowej absorpcji atomowej analizuje się na ogół próbki ciekłe. Jednak ze względu na krótki czas przebywania w sferze analitycznej płomienia r-r powinien być do niego wprowadzony w formie aerozolu. Stosowane w ASA nebulizery -urządzenia do rozpylania fazy ciekłej i tworzenia jej subtelnych zawiesin w gazach. Najczęściej używane są nebulizery pneumatyczne.
Atomizacja bezpłomieniowa. Pierwszym rozwiązaniem był piec Lwowa. Obecnie działają na zasadzie kiuwety Massmanna Główny element pieca- rurka grafitowa(wymiary dobierane indywidualnie do pierwiastka) jest ogrzewana elektrycznie- indukcyjnie lub rezystorowo. Wnętrze rurki jest pokrywane grafitem pirolitycznym, uzyskiwanym w trakcie prowadzonego w niej rozkładu węglowodorów(stanowi to zabezpieczenia przed dyfuzją oznaczanych atomów do wnętrza ścianki). Kiuweta nie jest zamykana w szczelnych komorach, ochronną atmosferę uzyskuje się dzięki przepływowi odpowiednio kierunkowanych strumieni argonu. Jeden strumień powinien omywać zewnętrzną część ogrzewanej powierzchni zabezpieczając ją przed utlenieniem. Drugi wprowadza się do końcówki rurki i odprowadza małym otworem w jej części centralnej.
Monochromatory są to najczęściej siatki dyfrakcyjne. W nowszych są to siatki holograficzne, o dużej rozdzielczości spektralnej i zapewniające większy stosunek sygnału do szumu.
Parametry pracy przyrządu wpływające na precyzję, dokładność i czułość oznaczeń:
długość fali promieniowania przepuszczanego przez atomizer
należy dobrać odpowiednią długość fali dla naszego pierwiastka leżącą odpowiednio daleko od linii absorpcyjnych innych pierwiastków
szerokość wykorzystywanej wiązki promieniowania monochromatycznego
nie powinna być zbyt duża, gdyż może obejmować sąsiadujące linie przeszkadzających pierwiastków, jednak zbytnie jej zawężenie zmniejsza natężenie światła a co za tym idzie -czułość metody
natężenie stosowanej wiązki promieniowania
Mała wartość prądu powoduje emitowanie wąskiej wiązki o małej intensywności. Prąd o zbyt dużym natężeniu zanadto rozszerza wiązkę pogarszając precyzję i selektywność.
Interferencje- zmiany sygnału analitycznego próbki inne niż dla identycznie przygotowanej próbki wzorcowej. Jeżeli wpływ jakiegokolwiek czynnika zewnętrznego lub składnika próbki na wynik oznaczenia nie może być skompensowany przez odpowiednie przygotowanie „ślepej prób”, to jest on źródłem interferencji.
Interferencje:
• spektralne- spowodowane niekompletnym wyodrębnieniem z widma sygnału analitycznego wiązki promieniowania monochromatycznego osłabionego przez absorpcje jej części przez atomy oznaczanego pierwiastka.
Ich przyczyny to:
-niewłaściwy wybór linii analitycznej
1.rozpraszanie promieniowania przez stałe cząstki składników próbki, które nie uległy mineralizacji i atomizacji
2. pośredni wpływ nie oznaczanych składników analizowanej próbki na warunki pracy atomizera
3.zastosowanie nieodpowiedniego źródła promieniowania w stosunku do możliwości monochromatora.
• niespektralne powodują bezpośrednią zmianę postaci oznaczanego pierwiastka i tym samym zmianę sygnału analitycznego.
interferencje powstałe w procesach transportu (wynikają z niestabilnej pracy nebulizera a także palnika)
interferencje w fazie stałej (spowodowane procesami chemicznymi zachodzącymi podczas odparowania rozpuszczalnika oraz mineralizacji i atomizacji próbki)
interferencje w fazie gazowej(zjawisko jonizacji)
interferencje wynikające z nierównomiernego rozkładu przestrzennego atomów oznaczanego pierwiastka w atomizerze.
Jedyną metodą zapewniającą pełną eliminację interferencji jest stosowanie r-rów wzorcowych o składzie identycznym ze składem r-ru badanej próbki.
Niekiedy oznaczenia prowadzi się niekiedy metodą dodatków .Może być ona stosowana jedynie wtedy, jeżeli znany jest rodzaj związku, w jakim związany jest oznaczany pierwiastek. Metoda ta eliminuje wszelkie interferencje niezależne od jego stężenia.
Metodą wszechstronnie stosowaną do eliminowania różnego rodzaju interferencji jest wprowadzanie do r-rów wzorcowych i badanych tzw. Buforów spektrochemicznych. Można wyróżnić:
-środki wspomagające nebulizację
-substancje ułatwiające procesy utleniania i atomizacji próbki dzięki przeprowadzajnia oznaczanego pierwiastka w związki łatwo lotne i łatwo ulegające dysocjacji termicznej
-substancje „uwalniające”, które łatwo reagują ze składnikami próbki tworzącymi z oznaczanym pierwiastkiem trudno dysocjujące związki
-bufory dejonizujące- substancje łatwo ulegające jonizacji.
Oznaczenia ilościowe w ASA prowadzi się dwoma metodami:
metodą dodatku wzorca
metodą krzywej wzorcowej.
Metoda krzywej wzorcowej polega na przygotowaniu serii wzorców o zmieniających się stężeniach, pomiarze ich absorbancji i wykreśleniu zależności A= f(c). Zakres stężeń powinien być tak dobrany aby zależność była linią prostą i mieściła się w nim zawartość oznaczanego pierwiastka. Wzorce powinny być ciekłe jeśli badana próbka jest ciekła, lub stałe jeśli jest ona ciałem stałym. Próbki wzorcowe powinny mieć skład ściśle odwzorowujący skład oznaczanego materiału. Do rozpuszczania lub roztwarzania substancji wzorcowych i analizowanych należy stosować identyczne ilości tych samych rozpuszczalników lub kwasów. Również ilości buforów w każdym r-rze powinny być takie same. Pomiary absorbancji muszą być wykonane w jednej serii obejmującej wzorce i analizowane próbki. Stosowanie tej techniki jest celowe przy analizie większej liczby próbek.
Metoda dodatku wzorca stosowana jest do oznaczania zawartości pierwiastka w pojedynczej próbce o nieznanym stężeniu. Po przeprowadzeniu próbki do r-ru dzieli się ją na kilka częśći o jednakowej objętości. Do pierwszej wprowadza się tylko bufory spektralne, a do kolejnych poza buforami , dodaje wzrastające masy oznaczanego pierwiastka. Oznaczany wzorzec powinien mieć identyczną postać chemiczną jak oznaczany pierwiastek w próbce. Po uzupełnieniu r-rów rozpuszczalnikiem do tej samej objętości mierzymy ich absorbancję. Wówczas rysujemy wykres absorbancji od stężenia, a stężenie próbki bez dodatku odczytujemy z wykresu.
Zastosowanie ASA:
Jest to technika o wielu zaletach; charakteryzuje się dużą czułością, jest specyficzna a także łatwa i wymaga niewiele czasu by wykonać pomiar. Spektrofotometry są łatwiej dostępne oraz tanie.
ASA stosowana jest:
W analizie śladowej, gdyż w wersji bezpłomieniowej pozwala na oznaczanie nawet nanogramowych ilości pierwiastków.
W wersji płomieniowej stosowana jest do oznaczania składników głównych.
Stosowana w większości analiz, których celem jest oznaczanie pierwiastków metalicznych
Wykorzystywana w laboratoriach analitycznych różnych gałęzi przemysłu np. metalurgicznego, farmaceutycznego czy spożywczego, w geologii, rolnictwie, ochronie środowisk (analiza wód i atmosfery), medycynie, biologii i wielu innych dziedzinach nauki i gospodarki.
Polarografia.
Podstawy metody:
W polarografii stosuje się elektrodę rtęciową, której katodę stanowią wypływające regularnie wypływające z kapilary krople rtęci, dzięki czemu elektrolit styka się zawsze ze świeżą powierzchnią rtęci. Anodę stanowi warstwa rtęci wchłaniająca rtęć katodową. Potencjał takiej elektrody zależy od rodzaju elektrolitu stykającego się z elektrodą.
Obecnie stosuje się elektrody odniesienia, w szczególności nasyconą elektrodę kalomelową (NEK), która eliminuje taką zależność.
Zalety kroplowej elektrody rtęciowej:
1.odnawianie powierzchni elektrody(produkty reakcji elektrodowej są usuwane wraz z rtęcią co zapewnia stałe parametry elektrody)
2. spadające krople mieszają r-r (zapewnia to odświeżanie jego powierzchni)
3.podczas elektrolizy przebiega znikomo mały prąd
4.duże napięcie wodoru na rtęci (możliwość osiągnięcia dużych bezwzględnych wartości ujemnych potencjałów)
5.rtęć jako metal szlachetny zachowuje się obojętnie w stosunku do większości r-rów
6.idealne warunki do wykorzystania dyfuzyjnego prądu granicznego
Wady:
1.łatwość utleniania rtęci
2.konieczność używania Hg o dużej czystości ze względu na kapilarę
3.mały zakres dla potencjałów dodatnich (powyżej +4 [V] rtęć ulega anodowemu rozpuszczaniu)
4.dla niektórych anionów ograniczenia potencjałów do: Cl- 0,0[V]; OH- -0,2[V]; CN- -0,6[V]
Krzywa polarograficzna:
Jeżeli do elektrod zanurzonych w r-rze elektrolitu zaczniemy doprowadzać wzrastające liniowo napięcie (takie by nie wywołało reakcji elektrochemicznej) to funkcja mierzonego natężenia da wykres zwany polarogramem:
h- wysokość fali
ID - prąd dyfuzyjny
Is - prąd szczątkowy
E1/2 - potencjał półfali
A-B- prąd szczątkowy
B- potencjał wydzielania
B-C- prąd dyfuzyjny
C-D- graniczny prąd dyfuzyjny
Część krzywej B-D- fala polarograficzna
Powyżej D- reakcja elektrodowa innego pierwiastka niż oznaczany (np. wydzielanie wodoru)
Rodzaje prądów polarograficznych:
Dyfuzyjny (jego szybkość zależy jedynie od szybkości dyfuzji depolaryzatora z głębi r-ru do pow. Elektrody kroplowej)
Migracyjny( uporządkowany ruch jonów do elektrod o odpowiednim znaku)
Szczątkowy (suma prądów: migracyjnego i pojemnościowego)
Pojemnościowy (spowodowany ładowaniem się podwójnej warstwy elektrycznej na powierzchni kropli, układ tworzy pewnego rodzaju kondensator)
Kinetyczny
Katalityczny
Adsorpcyjny
Prąd mierzony jest sumą: granicznego dyfuzyjnego, migracyjnego, szczątkowego.
Charakterystyka prądu granicznego:
Prąd graniczny pojawia się wtedy gdy szybkość reakcji elektrodowej jest określona przez szybkość dostarczenia elektroaktywnej substancji do pow. elektrody w wyniku procesu bardziej lub mniej zależnego od potencjału elektrody. Substancja elektroaktywna może być dostarczana w wyniku procesów przenoszenia(dyfuzji, migracji elektrycznej, konwekcji) lub w wyniku przebiegającej w r-rze reakcji chemicznej (prąd kinetyczny). Konwekcja nie odgrywa większej roli w polarografii wiec może być pominięta; migrację składnika sprowadza się do zera wprowadzając elektrolit podstawowy. W tych warunkach stosowany prąd graniczny określa się wyłącznie przez dyfuzję-prąd graniczny dyfuzyjny. Szybkość przenoszenia dyfuzyjnego zależy od różnicy stężeń między pow. elektrody a całością r-ru. Różnica ta jest stała więc natężenie prądu określonego przez dyfuzję nie zmienia się. Zależność określającą wartość dyfuzji w czasie trwania kropli wprowadził Ilković:
id= 607*n*D0,5*C*m2/3*t1/6
id-średni prąd dyfuzyjny w czasie trwania kropli
n- liczba elektronów biorących udział w reakcji
D-współczynnik dyfuzji substancji elektroaktywnej
C- stężenie
m- szybkość wypływu rtęci z elektrody
t- czas trwania kropli
Aparatura pomocnicza.
1.Elektroda kroplowa jest szklaną kapilarą połączoną wężem igielitowym, ze zbiorniczkiem rtęci, którego przesuw umożliwia regulowanie ciśnienie słupa rtęci w stosunkowo dużym zakresie. Optymalny czas trwania kropli wynosi od 2 do 5 sekund. Szybsze spadanie kropel powoduje mieszanie zakłócające warstwę dyfuzyjną zaś czas dłuższy od 5 sekund powoduje niedogodne oscylacje prądu. Długość rurki kapilarnej wynosi od 5-10 cm. Przy określaniu charakterystyki elektrody bardzo ważna jest wartość promienia wewnętrznego kapilary.
Schemat polarografu:
1-kroplowa elektroda rtęciowa
galwanometr
bocznik galwanometru
potencjometr
źródło prądu stałego
Prawidłową pracę elektrody warunkuje:
Pionowe ustawienie elektrody(odchylenie od pionu powoduje błędy dochodzące do5%)
Obcięcie kapilary ściśle prostopadle do osi kapilary
Zapobieganie drganiom elektrody (w tym celu elektrodę umieszcza się na masywnej podstawce)
Po każdorazowym oznaczeniu elektrodę wyjmuje się z naczyńka, przemywa wodą destylowaną, osusza, a następnie obniża się zbiorniczek elektrody do momentu, gdy rtęć przestaje wypływać i zostawia się elektrodę na powietrzu lub zanurzoną w wodzie destylowanej.
Charakterystykę elektrody stanowią dwa parametry; czas trwania kropli i wydajność kapilary. W celu wyznaczania charakterystyki elektrody dla każdego położenia zbiorniczka rtęci mierzy się za pomocą stopera czas wypływu określonej ilości kropel. Ważąc rtęć, która wypłynęła w określonym czasie , mamy dane pozwalające określić dla konkretnej wysokości czas trwania kropli (t) w s oraz wydajność (m) w mg HG/s. Zależność tych wielkości od wysokości położenia zbiorniczka rtęci daje pełną charakterystykę kapilary. Mamy zależność m* t = const.
Charakterystyka elektrody:
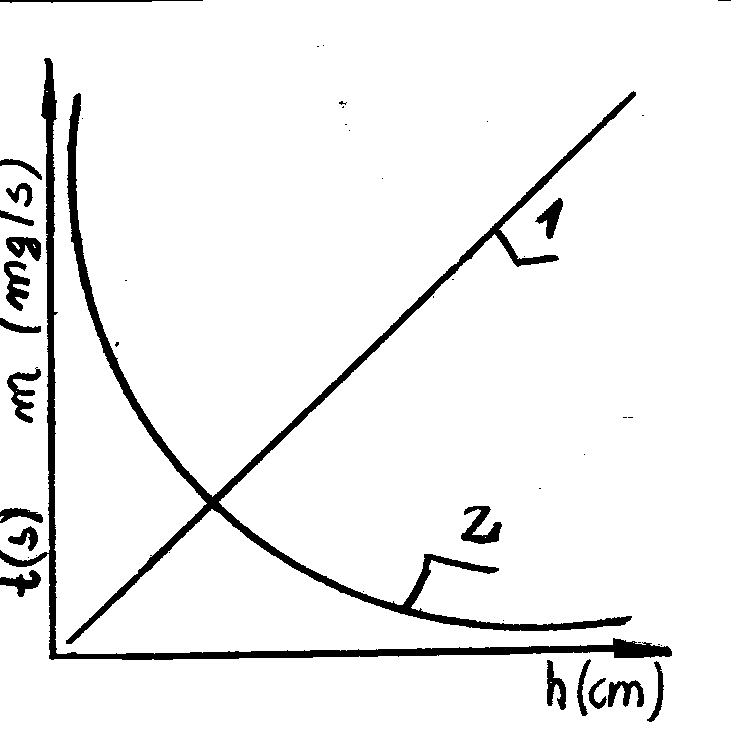
1-wydajność elektrody
2-czas trwania kropli
2.Naczyńka polarograficzne.
Heyrowski w swych pierwszych pracach stosował jako naczyńko kolbę Erlemmayera z rtęcią na dnie. Obecnie stosuje się tzw. Naczyńko Novaka w kształcie U rurki o jednym ramieniu szerszym i drugim węższym. Naczyńko zamyka się rtęcią , do szerszego ramienia wprowadza się próbkę , a przez węższe łączy się z anodą polarografu. Wpływ elektrolitu na wartość potencjału likwiduje się stosując elektrodę zewnętrzną , niepolaryzującą się np. kalomelową. W tym wypadku stosuje się naczyńko w kształcie litery H rozdzielone przegrodą ze szkła porowatego, umożliwiające połączenie z elektrodą zewnętrzną. W pewnych typach naczyniek stosuję się dodatkowo doprowadzenie gazu służącego do odtlenienia próbki.
Metody oznaczania stężenia z pomiarów prądu dyfuzyjnego:
1.metoda krzywej wzorcowej-polega na pomiarze wartości prądu dyfuzyjnego dla próbek o różnej lecz wiadomej ilości oznaczanego składnika i wykreśleniu krzywej.
2. metoda dodanego wzorca-bywa wykorzystywana w przypadku wykonywania analiz pojedynczych. Polega na wartości prądu dyfuzyjnego dla identyfikowanej próbki i ponownym wyznaczeniu wartości prądu dyfuzyjnego po wprowadzeniu do badanej próbki określonej ilości oznaczanego składnik. Oznaczaną ilość c1 oblicza się ze wzoru:
C1=(h1*v2*C2)/[h(v1+V2)+h1*v2]
H1,h2-wysokość fal polarograficznych przed i po dodaniu wzorca
V1- objętość próbki oznaczanej
V2 - objętość wprowadzonego wzorca.
3.metoda pomiaru bezwzględnego- polega na zastosowaniu podanego wcześniej wzoru Ilkovića.
Nowe kierunki w polarografii:
1.zmienno prądowe
2.oscylograficzne.
3.magnetopolarografia
Miareczkowanie amperometryczne (polarometryczne)
polega na pomiarach natężenia prądu w układzie polarograficznym (przy stałym napięciu odpowiadającym prądowi granicznemu oznaczanego jonu) podczas dodawania do roztworu badanego kolejnych porcji odczynnika. Jeżeli zmierzy się początkowe natężenie prądu odpowiadające nieznanemu stężeniu badanej substancji, a następnie dodaje się do roztworu porcje odczynnika, reagującego z substancją badaną i mierzy się natężenie prądu po dodaniu każdej porcji odczynnika - można wykreślić krzywą miareczkowania amperometrycznego.
Zastosowanie polarografii:
stosowana zarówno w analizie nieorganicznej jak i organicznej. - Stosowana do oznaczania substancji występ. w ilościach śladowych, np. zanieczyszczeń. - w analizie nieorganicznej stosuje się ją do badania stopów, sprawdzania czystości odczynników, środków spożywczych, badania wody kotłowej. Ostatnio gwałtownie wzrasta zastosowanie polarografii w analizie organicznej, gdyż jest jedyna metodą oznaczania podobnych substancji występ. w mieszaninach.
Spektrofotometria UV/VIS.
Spektrofotometria-oddziaływanie elektromagnetyczne z materią, działa na dwóch zakresach (UV/VIS) światła, zakres nadfioletu i widzialny. Wykorzystuje promieniowanie w zakresie 190-800 nm gdzie: spektrofotometria UV (ultrafiolet)- 190-380 nm ;VIS, kolorymetria-380-800 nm.
Promieniowanie elektromagnetyczne można rozpatrywać dwojako: jako strumień fotonów o określonej energii lub jako falę. Wielkości te są ze sobą związane zależnością:
ν=C/λ
gdzie:
ν-częstość drgań
λ-długość fali
C- prędkość rozchodzenia się promieniowania w próżni c=3*1010 cm/s
Energia fotonów, którą można wyrazić równaniem:
E= h*ν = h* C/λ
Gdzie: h- stała Plancka, 6,16 10-34 J* s
Zmienia się ze zmniejszeniem częstości drgań, czyli im krótsza jest długość fali promieniowania, tym wyższą energię niesie ono ze sobą, a więc może spowodować większe zmiany w stanie energetycznym cząsteczki.
Efektem absorpcji promieniowania elektromagnetycznego przez cząsteczki związków chemicznych jest wzbudzenie odpowiednich poziomów energii. Energia promieniowania UV/VIS mieści się w zakresie 240-400 kJ/mol.
Całkowitą energię cząsteczki E można przedstawić jako sumę:
Ecalk = Eel+ Eosc+Erot+Et
WIDMO ABSORPCYJNE zawiera informacje o rodzajach przejść energetycznych w cząsteczce i jest graficzną zależnością ilości energii promieniowania elektromagnetycznego pochłoniętej przez cząsteczki materii zależności (absorbancja, molowy współczynnik absorpcji, log A, log ε) od długości fali światła lub częstotliwości drgań czy liczby falowej. Widmo zawiera pasma absorpcji o różnym kształcie i intensywności w zależności od procesów zachodzących w cząsteczce.
Pochłonięcie promieniowania w zakresie UV/VIS odpowiada przejściom elektronów z odpowiednich orbitali wiążących (σ, π) na wyższe energetycznie orbitale antywiążące σ*,π*, przy czym dostarczenie największej energii jest potrzebne do wywołania przejścia σ->σ*.Pasma przejścia tego typu występują w obszarze dalekiego nadfioletu, poza obszarem pracy zwykłych spektrofotometrów.
Przejścia typu π->π*charakteryzują się dużą intensywnością i powodowane są absorpcją promieniowania o niższej energii, w zakresie UV/VIS.
W związkach organicznych zawierających orbitale wiążące σ, niewiążące π i antywiążące σ* i π* istnieje możliwość wielu przejść elektronów ze stanu (orbitalu)o niższej energii na wolny orbital o wyższej energii. Określenie rodzaju przejść elektronowych na podstawie pasm absorpcji występujących w widmie pozwala określić strukturę cząsteczki.
Możliwość przejść elektronów ilustruje poglądowo rysunek:
Aby cząsteczka mogła zaabsorbować promieniowanie UV/VIS, musi mieć odpowiednią strukturę. Występowanie w cząsteczce wiązań wielokrotnych pozwala na absorpcję promieniowania w tym zakresie.
Chromofor- określenie dla ugrupowań atomów nadających cząsteczce barwę, zawierających łatwo wzbudzalne elektrony π, czyli zawierających wiązania wielokrotne, zdolnych do absorpcji promieniowania w tym zakresie (180-800 nm).
Chromofory:
1nieorganiczne:
-CL, -Br, -I, =S, ≡N, =O
2.organiczne
-C=C, ,>C=O, >C=N, >C=S, benzen itp.
Mogą one występować w układach izolowanych lub sprzężonych.
Na położenie pasma absorpcji chromoforu ma wpływ obecność w strukturze cząsteczki podstawników o charakterze elektrodonorowym (-NH2, -OH, -SH, -OR, -NR2, fluorowce), zwanych auksochromami lub grupami auksochromowymi. Ich obecność wpływa na przesunięcie pasma absorpcji chromoforu w kierunku fal dłuższych lub krótszych, zwanych odpowiednio przesunięciem batochromowym i hipsochromowym. Zwiększenie lub zmniejszenie intensywności pasma określane jest jako efekt hiperchromowy lub hipochromowy.
Badanie widm elektronowych rozcieńczonych r-rów wymaga doboru odpowiedniego rozpuszczalnika, który nie powinien wykazywać własnej absorpcji w danym zakresie pomiarowym. Polarność rozpuszczalnika może mieć wpływ na przesunięcie pasm absorpcji w widmie, wywołane efektem dipolowym.
Prawa absorpcji.
Prawa te zostały opracowane przez Lamberta, Beera i innych. Prawo Lamberta odnosi się do ośrodków jednorodnych:
Wielkość absorpcji promieniowania w jednorodnym ośrodku absorbującym jest proporcjonalna do grubości warstwy tego ośrodka.
It = I0 * e-kb
It- natężenie promieniowania padającego
I0- natężenie promieniowania przechodzącego przez ośrodek absorbujący
b- grubość warstwy
k- współczynnik charakterystyczny dla substancji
Prawo Beera odnosi się do ośrodków, w których znajdują się różne stężenia substancji absorbującej:
Natężenie promieniowania przechodzące przez r-r zmniejsza się wykładniczo ze wzrostem stężenia r-ru.
Z połączenia tych praw otrzymujemy podstawowe równanie spektrofotometrii i kolorymetrii:
Absorbancja promieniowania przechodzącego przez ośrodek jednorodny jest zależna od rodzaju r-ru i proporcjonalna do jego stężenia ( c ) oraz grubości warstwy absorbującej r-ru ( b )
It= I0 * e-abc
A=abc= lg I0/ It
Gdzie: A- absorbancja, b- grubość warstwy, c- stężenie, a- współczynnik absorpcji.( kiedy stężenie wyraża się w g/l, gdy stężenie podaje się w molach na l, używa się symbolu ε, który jest molowym współczynnikiem absorpcji i mówi o czułości metody).
A=ε * c * b
Aparatura.
1.Źródło światła.
Lampy deuterowe emitujące promieniowanie w zakresie 180-380 nm oraz lampy wolframowo- halogenowe obejmujące zakres 380 do bliskiej podczerwieni. Stosuje się również wysokociśnieniowe łukowe lampy ksenonowe obejmujące cały zakres UV/VIS.
2. monochromator
zadaniem jego jest wycięcie wąskiego pasma o określonej długości fali z ciągłego promieniowania emitowanego przez źródło światła i skierowanego na kuwetę pomiarową.
Poszczególne elementy to:
Szczelina wejściowa
Element rozszczepiający, którymi są obecnie siatki dyfrakcyjne ( parametrem charakteryzującym siatkę jest stała siatki określająca liczbę rys przyp. na 1mm długości) , w starszych przyrządach spotyka się pryzmaty (wykonane są ze szkła (VIS) lub kwarcu (UV) jak również filtry barwne
Kolimator (zwierciadła) zapewniające równoległość wiązki promieniowania
Szczelina wyjściowa
3.kuweta pomiarowa
Wykonana z materiału przepuszczającego promieniowanie danego zakresu. Dla UV stosuje się kuwety z kwarcu lub stopionej krzemionki, dla VIS ze szkła optycznego lub niektórych tworzyw sztucznych.
4.detektory
Cechy dobrego detektora:
dobra czułość przy niskim poziomie szumów własnych
szeroki zakres liniowości wskazań
stabilność wskazania w czasie pomiaru
Jako detektory stosujemy najczęściej
Fotokomórki- wykorzystują zjawisko fotoelektryczne zewnętrzne
Fotopowielacze- są to układy wzmacniające wielokrotnie fotoprąd dzięki wykorzystaniu zjawiska wtórnej emisji elektronów.
Fotodiody- wykorzystują zjawisko fotoelektryczne wewnętrzne.
Rodzaje spektrofotometrów:
-jednowiązkowe- w których promieniowanie przechodzi najpierw przez r-r odniesienia, a następnie po zmianie kuwety przez badaną próbkę
-dwuwiązkowe- promieniowanie jest podzielone przez układ optyczny na dwie równocenne wiązki przechodzące równolegle przez r-r odniesienia i badaną próbkę.
Dobór optymalnych warunków oznaczania:
Kontrola sprawności przyrządu, kalibracja zgodnie z obsługą
Przygotowanie próbek do pomiaru (r-r musi być jednorodny!)
Dobór odpowiedniego rozpuszczalnika
Ustalenie odpowiedniego pH
Dobór odpowiedniego odczynnika kompleksującego ( odczynniki i helat( metal+ ligand) muszą być trwałe w czasie i dobrze rozpuszczalne)
Pasmo ligandu i kompleksu nie powinno się pokrywać
Reakcja kompleksu musi być szybka, odtwarzalna, selektywna
Helat musi spełniać prawo Lamberta- Beera w szerokim zakresie stężeń
Oznacz(?) molowy współczynnik absorbcji( czułość metody)
Zastosowanie spektrofotometrii:
-oznaczanie kationów, anionów
-oznaczanie zw. organicznych
-badanie równowagi reakcji chemicznych
-wyznaczanie równowagi reakcji chemicznych
-ustalenie składu i stałych trwałości związków kompleksowych
-potwierdzenie tożsamości danego związku przez porównanie widma z widmem wzorca
- kontrola czystości rozpuszczalników
Miareczkowanie spektrofotometryczne:
Miareczkowanie zwykłe, z tą samą aparaturą do zmiany barwy
Miareczkowanie potencjometryczne
Miareczkowanie spektrofotometryczne; niewielkie zużycie titranta, punkt końcowy obserwujemy przy określonej długości fali
RYS. Możliwe przebiegi krzywych miareczkowania:
a)substraty nie absorbują promieniowania a produkt reakcji tak,
b)substraty i produkty nie absorbują promieniowania a titrant absorbuje
c)żaden z reagentów nie absorbuje
Do układu dodaje się indykator, który pozwala określić punkt końcowy miareczkowania..
Spektrofluorometria.
Luminescencja-emisja światła przez ciała zimne
Rodzaje luminescencji:
-fotoluminescencja- subst wzbudzanie promieni elektromagnetycznych(UV, VIS)
-chemiluminescencja- wzbudzanie cząsteczki w wyniku reakcji chemicznej
-bioluminescencja- wzbudzanie cząsteczki jest wynikiem procesów biochemicznych(robaczki świętojańskie)
-elektroluminescencja- wzbudzanie cząsteczek w polu elektrycznym
Zastosowanie:
1.lepsza selektywność
2.analiza ksenobiotyków
Spektrofotometria różniczkowa (pochodna):
Krzywa pochodna widma absorpcji jest graficznym przedstawieniem wartości różniczki absorbancji po długości fali światła w funkcji długości fali światła
Dx, z= f (λ) = dnA/ dλn
W sp. Poch. Istnieje proporcjonalna zależność wartości pochodnej widma od stężenia substancji mierzonej (X ). Stosuje się elektryczną obróbkę materiału w ukł. Analogowym. Numeryczna obróbka, zarejestrowanie w pamięci komputera widma podstawowego.
Wyszukiwarka
Podobne podstrony:
Pytania z wejściówek, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
Zadanie 4 CHEMIA ANALITYCZNA
Chemia analityczna kolos
CHEMIA ANALITYCZNA 2 TEST poprawione przez G M
analiza wody sprawozdanie chemia analityczna analiza wody teoria
chemia analityczna wyklad 11 i 12
Fizyczna27m, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
kationy IIIgr(1), Farmacja, Farmacja, - Chemia Analityczna
CHEMIA FIZYCZNA-Proces analityczny sc, Ochrona Środowiska pliki uczelniane, Chemia
Sprawozdanie damiana nr 1, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i
poprawa II 25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna
Notatki chemia analityczna
chemia analityczna wyklad 02
Chemia analityczna skrypt
Program, Ochrona Środowiska, Chemia analityczne środowiska
Chfizyczna5, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
Zasady nazewnictwa wybranych klas zwi-zk-w organicznych, STUDIA PŁ, TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIA
Litowce, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
więcej podobnych podstron