Laboratorium teoria I część
Skład chemiczny wód w wielu częściach świata jest bardzo różny, dlatego normy czystości są różne i nie ma możliwości ustalenia ścisłych norm chemicznych jakości wody. Światowa Organizacja Zdrowia podaje dopuszczalne stężenia niektórych związków występujących w wodzie. Obecnie (od 1978r.) proponuje się podawania także tymczasowych maksymalnych dopuszczalnych stężeń toksycznych do oceny przydatności wody do picia. Wynika to z pojawienia się w wodzie związków organicznych - pochodnych trójhalogenków metanu. Pochodne halogenowe tworzą się w trakcie chlorowania wody i przypuszcza się, że są one związkami rakotwórczymi. Aby się ich pozbyć można stosować absorpcję na węglu aktywnym i sposób ten zaleca się do oczyszczania wody w wodociągach obsługujących do
75 000 mieszkańców. Woda oprócz stosowania do celów komunalnych jest także stosowana do celów przemysłowych, rolniczych, ciepłowniczych, w energetyce, chłodnictwie, w przemyśle spożywczym...itp.
BADANIE FIZYCZNE WODY
Oznaczanie temperatury (PN-77/C-04584).
Temperatura wód naturalnych może wahać się od 273 K do temperatury wrzenia. Z tego punktu widzenia są one dzielone na 6 klas od bardzo zimnej (273-7K) do wrzącej (>373K). Temperatura wód powierzchniowych, zaskórnych i infiltracyjnych, w zależności od pory roku waha się od 273-298K, jest ona także zmienna w zależności np. od głębokości zbiornika (najgłębsze warstwy mają temperaturę 277K, zbliżoną do temperatury największej gęstości wody). Wody podziemne wykazują większą stałość temperatury. Ma ona znaczny wpływ na proces samooczyszczania biologicznego wód naturalnych, proces ten ulega spowolnieniu w temperaturach niskich, zgodnie z regułą van't Hoffa.
Temperatura wody do picia powinna wynosić 280-285K. Powyżej 288K woda jest niesmaczna, mdła i nie zaspakaja pragnienia, zaś <278K może działać szkodliwie. Równocześnie z oznaczeniem temperatury wody oznacza się temperaturę powietrza.
Oznaczanie barwy (PN-74/C-04558).
Barwa wody ma szczególne znaczenie przy zaopatrywaniu ludzi w wodę do picia, na potrzeby niektórych gałęzi przemysłu jak i wykorzystaniu jej do celów reakcyjnych.
Woda chemicznie czysta w małej objętości jest bezbarwna, w grubej warstwie ma odcień niebieskawy. Naturalna barwa wody, jej odcień i intensywność pochodzi i zależy zazwyczaj od substancji humusowych. Skala barw wody jest bardzo szeroka, od zabarwienia lekko żółtego do barwy brązowej. Wody podziemne odznaczają się małą skalą barwy naturalnej (5-20 gPt/m3), barwa wód powierzchniowych jest zmienna w szerokich granicach (np. powodowana ściekami przemysłowymi z produkcji barwników, farb i przemysłu tekstylnego, produkcji celulozy). Ścieki przemysłowe nadają wodzie barwę specyficzną. Wody powierzchniowe mogą zawierać cząstki koloidalne, pochodzące z produktów rozpadu roślin oraz zawiesiny, gliny, iły i inne cząstki wyługowane z gleby. Zabarwienie wód powierzchniowych może być także spowodowane rozwojem mikroorganizmów (tzw.„zakwit”). Drobne zawiesiny - np. kłaczki strąconego Fe(OH)3, również nadają wodzie dodatkowe zabarwienie. To zabarwienie, pochodzące od substancji zawieszonej, dające się łatwo usunąć przez filtrację nazywamy barwą pozorną. Barwa rzeczywista wody pochodzi od substancji rozpuszczalnych. Dlatego barwę wody oznacza się na próbie klarownej, pozbawionej zawiesin, po odsączeniu lub odwirowaniu zanieczyszczeń.
Rodzaje metod badań.
Do oznaczenia barwy stosuje się:
metodę porównawczą - z wykorzystaniem skali wzorcowych roztworów platynowo-kobaltowych lub dwuchromianowo-kobaltowych. Ma ona zastosowanie przy badaniu wód naturalnych o barwie identycznej lub bardzo zbliżonej do barwy roztworów wzorcowych
Dopuszczalna barwa wody do picia wynosi 15 mgPt/dm3. Zabarwienie wody nie świadczy o jej szkodliwości, może powodować natomiast pogorszenie smaku.
Skala barw: jednostką barwy jest zabarwienie jakie nadaje 1mgPt zawartej w chloroplatynianie potasowym K2PtCl6 rozpuszczonym w 1 dm3 wody destylowanej z dodatkiem 0.5mg chlorku kobaltowego CoCl2×6H2O.
Mętność (PN-79/C-04583).
Jest to wskaźnik jakości wody, spowodowany obecnością zawiesin i koloidów, powodujących rozpraszanie i absorbowanie światła. Nie wykazuje ona korelacji z oznaczeniem grawimetrycznym.
Mętność wód podziemnych może pojawiać się dopiero po pewnym czasie np. w wyniku kontaktu z powietrzem. Reakcje wytrącania się węglanu wapniowego i wodorotlenku żelazowego (III) biegną zgodnie ze schematem:
Ca(HCO3)2 → CaCO3 + CO2↑ + H2O
2 Fe(HCO3)2 + H2O + ½ O2 → 2 Fe(OH)3 + 4 CO2↑
Powierzchniowe wody płynące najczęściej są mętne, gdyż zawierają rozdrobnione substancje organiczne pochodzenia roślinnego, zwierzęcego, substancje humusowe, plankton, wyższe drobnoustroje, cząstki gliny, piasku, iłu, wytrącone związki żelaza, manganu, wapnia. Mętność wody jest cechą fizyczną, wpływającą przede wszystkim na wygląd i apetyczność wody. Woda mętna nie nadaje się do picia i na potrzeby gospodarcze, szczególnie gdy mętność jest pochodzenia organicznego, świadcząca o zanieczyszczeniu ściekami. Zawiesiny i koloidy mogą być pochodzenia:
mineralnego
glina
iły
piasek
wytrącone związki żelaza, manganu, glinu, wapnia
organicznego
rozdrobnione substancje organiczne
kwasy humusowe
plankton
wyższe mikroorganizmy
Szczególne znaczenie w ocenie wody ma mętność powodowana obecnością zawiesin organicznych, mogących świadczyć o zanieczyszczeniu wód ściekami.
W wodach powierzchniowych występowanie tego wskaźnika uzależnione jest również od warunków atmosferycznych; pod czas opadów, wiosennych roztopów w wyniku większej ilości wody w rzekach jest zwiększony przepływ (bardziej burzliwy), który powoduje wzruszenie osadów (mułu) z dna rzeki.
Przyczyny zanieczyszczenia wód powierzchniowych wymienionymi związkami:
turbulencje w wodach rzek- stosunkowo duże zawiesiny z osadów dennych porywane przez nurt rzeki
powodzie, wody burzowe
ścieki bytowe i przemysłowe
nadmierny rozwój planktonu
Mętność wód rzecznych zmienia się w bardzo szerokim zakresie.
Różnorodność cząstek powodujących mętność sprawia, że znajomość tej wielkości daje tylko ogólny pogląd na charakter zanieczyszczenia wody.
Woda do picia powinna być klarowna i nie może zawierać zarówno substancji organicznych jak i mineralnych powodujących mętność.
Woda o wysokiej mętności może chronić mikroorganizmy przed działaniem dezynfekcyjnym i może pobudzać wzrost bakterii. Dlatego we wszystkich tych przypadkach, kiedy woda jest dezynfekowana, mętność musi być tak niska, ażeby dezynfekcja mogła być skuteczna.
Zaleca się ażeby mętność wody była utrzymana na możliwie najniższym poziomie ze względu na jej znaczenie dla jakości wody pod względem mikrobiologicznym.
Dopuszczalne zmętnienie wód użytkowych nie może przekraczać 1mg SiO2/dm3. Jako jednostkę mętności przyjmuje się mętność takiej wody, która zawiera 1mg/dm3 SiO2 o wymiarze SiO2 ok. 100μm (koloid) lub kaolinu, lub koloidalny wzorzec formazynowy otrzymywany przez zmieszanie
1g (NH2)2 × H2SO4 w 100cm3 wody destylowanej
10g (CH2)6N4 (urotropina) w 100cm3 wody destylowanej
Pobiera się po 10cm3 takich roztworów do kolby poj. 200cm3, miesza, pozostawia na 24 godz. i uzupełnia wodą destylowaną. Wzorzec taki ma mętność 400mg/dm3.
Wykonanie ćwiczenia wizualną metodą turbidymetryczną: badaną próbkę dokładnie wymieszać i wlać do kolby miarowej poj. 200cm3, następnie porównać ją z przygotowanymi wzorcami mętności. Porównanie przeprowadzić na tle okna, trzymając kolby na wysokości oczu. Należy pamiętać o dobrym wymieszaniu wzorców oraz wody badanej. Jeśli mętność jest większa niż skala wzorców, próbkę rozcieńczyć wodą destylowaną , uwzględniając ten fakt przy obliczaniu wyników oznaczenia.
Zapach (PN-72/C-04557).
Zapach należy do czynników organoleptycznych, którego ocena zależy od indywidualnych odczuć człowieka - jego powonienia. Aby wyeliminować błędy należy oceniać zapach wody przez zespół trzyosobowy.
Woda chemicznie czysta jest bezwonna. Zapach wód naturalnych może być spowodowany przez występujące w nich różne wonne substancje, przeważnie pochodzenia organicznego, ale także nieorganicznego np. siarkowodór i fosforowodór, związki lotne, produkty rozkładu substancji organicznych, wyższe drobnoustroje. Może także pochodzić od zanieczyszczeń ściekami bytowo-gospodarczymi lub przemysłowymi. Naturalne zapachy wód powierzchniowych są powodowane przez glony (wydzielające olejki eteryczne, szczególnie intensywne w czasie zakwitów), pleśnie, grzyby wodne i pierwotniaki. Wpływ na zapach mają także osady denne oraz procesy fizykochemiczne i biologiczne, zachodzące w tym środowisku. Wody podziemne w większości przypadków są bezwonne.
Siarkowodór w wodach podziemnych jest produktem rozkładu siarczków metali lub redukcji biochemicznej siarczanów.
FeS + 2CO2 + 2H2O → H2S + Fe(HCO3)2
MeSO4 + CH4 → MeCO3 + H2S + H2O
H2S pojawia się także w wyniku anaerobowego rozkładu białek
Stężenie siarkowodoru w atmosferze równe jest zeru, gdyż szybko wydziela się do atmosfery lub utlenia np. pod wpływem tlenu rozpuszczonego w wodzie.
H2S + 1/2O2 → H2O + S
Rozróżnia się trzy zasadnicze grupy zapachów:
zapach roślinny (R), spowodowany obecnością substancji organicznych, nie będących w stanie rozkładu i nie nadających wodzie cech przykrych. Do takich zapachów należy zapach ziemi, siana, trawy, torfu, mchu i kwiatów.
zapach gnilny (G) jest wywoływany obecnością ciał organicznych w stanie rozkładu gnilnego i nadający wodzie nieprzyjemną woń, np. zapach siarkowodoru, stęchlizny, pleśni, fekaliów.
zapach specyficzny (S) jest to zapach nienaturalny, powodowany obecnością ciał nie występujących w wodach naturalnych np. chlor, fenol, benzen, denaturat, smoła nafta. W badaniach zapachu, w nawiasie podaje się bliższe określenie zapachu np.S(chlor)
Zapach roślinny i gnilny są zapachami pochodzenia naturalnego.
Oprócz rozpoznania zapachu wody należy zwrócić uwagę na jego intensywność.
Rozróżniamy 5 stopni natężeń zapachu:
Natężenie |
Wyczuwalność zapachu |
Określenie zapachu |
0 |
brak |
--- |
1 |
bardzo słaby |
trudno wyczuwalny |
2 |
słaby |
łatwo wyczuwalny |
3 |
wyraźny |
dyskwalifikuje wodę do picia |
4 |
silny |
dyskwalifikuje wodę do picia i na potrzeby gospodarcze |
5 |
bardzo silny |
dyskwalifikuje zupełnie użytkowanie wody |
Zapach jest bardzo czułym i ważnym wskaźnikiem obecności niektórych związków i oceny jakości wody do picia na potrzeby gospodarcze i przemysłu spożywczego. Zapach wody oznacza się na zimno (z) w temperaturze pokojowej (20±1°C) i na gorąco (g) w temp. 60±1°C. Oznaczenie należy wykonywać na miejscu pobrania próby lub jak najszybciej po pobraniu. Zapachy G i S dyskwalifikują wodę do picia. Woda do picia powinna mieć zapach akceptowalny.
Wykonanie ćwiczenia:
(oznaczenie na zimno) - odmierzyć do kolby stożkowej 100cm3 badanej wody, dokładnie wymieszać i wąchać przy wylocie kolby. Określić rodzaj zapachu i jego intensywność w skali 6-stopniowej;
(oznaczenie na gorąco) - odmierzyć do kolby stożkowej 100cm3 badanej wody, przykryć szkiełkiem zegarkowym i podgrzać na łaźni wodnej do temp.60°C. Po zdjęciu z łaźni wymieszać zawartość kolby i natychmiast oznaczyć rodzaj i intensywność zapachu.
Przewodnictwo właściwe (konduktancja elektrolitów). (PN-77/C-04542)
Przewodność elektrolityczna właściwa roztworu wodnego jest to zdolność do przewodzenia prądu elektrycznego (inaczej zwana konduktywnością elektrolityczną roztworu). Prąd elektryczny jest przenoszony w roztworze w wyniku ruchu jonów -im większe stężenie jonów tym wyższa jest jego przewodność . Chemicznie czysta woda jest złym przewodnikiem elektryczności, co wynika z bardzo małego stopnia dysocjacji czystej wody na kation wodorowy (w rzeczywistości występuje one w wodzie jako jon hydroniowy H3O+) i anion wodorotlenowy:
H2O ![]()
H+ + OH-
Przewodność właściwa czystej wody wynosi 0.038μS/cm w 18°C.
W wodach naturalnych jony przewodzące prąd pochodzą głównie z dysocjacji związków nieorganicznych. Związki organiczne występujące w wodzie nie ulegają dysocjacji lub ulegają dysocjacji w małym stopniu. Oznacza to, że pomiar przewodności świadczy o mineralnym zanieczyszczeniu wody. Przewodność wynikająca z zawartości zanieczyszczeń organicznych jest zwykle nieznaczna. Z wielkości przewodnictwa właściwego wody można w przybliżeniu określić zasolenie, suchą pozostałość i zawartość substancji rozpuszczonych.
Przewodność (konduktancja) jest odwrotnością oporu (rezystywności) elektrycznego słupa cieczy, zawartego pomiędzy elektrodami o powierzchni 1cm2 i odległości między nimi 1m.
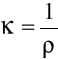
κ- konduktywność elektryczna [Ω-1m-1], ρ - rezystywność [Ωm].
Z wielkości przewodnictwa właściwego wody można w przybliżeniu określić: zasolenie, suchą pozostałość, zawartość substancji rozpuszczonych.
-zasolenie: mg NaCl/dm3 = f![]()
κ
κ - przewodność właściwa μS/cm
f - współczynnik przeliczeniowy:
f1 = 0,52 dla stężeń 0-10 mg NaCl/dm3
f2 = 0,55 dla stężeń powyżej 10 mg NaCl/dm3
-sucha pozostałość: mg/dm3 = f![]()
κ
f = współczynnik przeliczeniowy 0,55-0,9 należy wyznaczyć go doświadczalnie dla danej wody
-substancje rozpuszczone: mg/dm3 = f![]()
κ
f = współczynnik przeliczeniowy 0,55-0,75 należy wyznaczyć go doświadczalnie dla danej wody
Przewodność właściwa wynosi dla:
-świeżo destylowanej wody 0,5-2 μS/cm
-wód powierzchniowych przeciętnie 50-1000 μS/cm
-ścieków może to być kilka tysięcy μS/cm
Konduktancja zależy od temperatury i z każdą zmianą o 1°C zmienia się o 2%. Badania wykonuje się najczęściej w temperaturze 293K (20°C), dla innych temperatur stosuje się wzór korekcyjny:
κT = κ293 [1 + α (T - 293)]
gdzie: κT, κ293 konduktywność w temp. T i 293K, T - temperatura w skali bezwzględnej, α - współczynnik określany doświadczalnie
Dopuszczalna wartość przewodności w wodzie do picia w temp. 20oC wynosi 2500 mS/cm.
Gwałtowne zmiany konduktywności wody świadczą o przedostaniu się do niej związków nieorganicznych (elektrolitów). Substancje powierzchniowo - czynne (tłuszcze, oleje, smoły) powodują zafałszowanie wyników wskutek zanieczyszczenia elektrod aparatu pomiarowego.
Metody oznaczeń. Mierzona przewodność właściwa jest przewodnością słupa cieczy o grubości 1cm i przekroju 1cm2. Jednostką miary jest simens S, który jest odwrotnością oma Ω. W badaniach wody przewodność właściwą wyraża się w μS/cm. pomiar polega na zanurzeniu do wody elektrod, przyłączeni odpowiedniego napięcia i pomiarze oporności roztworu. Do pomiaru stosuje się konduktometry.
OZNACZANIE CHLORKÓW
Chlorki (PN-ISO 9297:1994),
Chlor wolny w przyrodzie w stanie wolnym występuje wyjątkowo (gazy wulkaniczne). Zazwyczaj występuje w postaci związków rozpuszczonych w wodzie morskiej bądź jako składnik złóż osadowych pochodzenia morskiego. Jego zwartość w skorupie ziemskiej wynosi 0.19%. Głównymi minerałami zawierającymi chlor jest halit - sól kamienna (NaCl), karnalit (KCl×MgCl2×6H2O), sylwinit [(K,Na)Cl]. W wodach morskich znajduje się około 1.89% Cl (w postaci NaCl, MgCl2). Sole kwasu solnego są szeroko rozpowszechnione w przyrodzie. Chlorki są w większości łatwo rozpuszczalne w wodzie, stąd ich obecność we wszystkich wodach naturalnych. Wyjątek stanowi chlorek srebrowy (AgCl), chlorek rtęciowy (Hg2Cl2) i chlorek miedziawy (CuCl). Zawartość chlorków w wodach naturalnych może wynosić od kilku dziesiątych grama do kilkuset gramów/m3.
Chlorki pochodzące z gleby lub z pokładów soli znajdujących się na danym terenie, występują w ilościach stosunkowo stałych i przyjęto je nazywać się normalnymi. Ich obecność nie świadczy o zanieczyszczeniu. Natomiast wzrost ich zawartości może świadczyć o zanieczyszczeniu lub dopływie zasolonych wód z innych warstw wodonośnych. Organizm ludzki wydala ok. 10g jonów chlorkowych na dobę, przez nerki jak i przez skórę w pocie. Chlorki pochodzące z przemian metabolicznych w organizmach żywych i ze ścieków przemysłowych są ważnym wskaźnikiem zanieczyszczenia wody. Obserwuje się wtedy też wzrost związków azotowych , utlenialności i zwiększoną ilość bakterii. Dlatego oceniając chlorki w wodzie należy zwrócić uwagę na ich pochodzenie. Chlorki nie stanowią zagrożenia dla organizmu, są nawet niezbędne dla jego prawidłowej egzystencji. Jednak przy dużym stężeniu nadają wodzie nieprzyjemny smak. W dużych ilościach mogą jednak działać toksycznie, a ich działanie zależy od rodzaju kationu. Dopuszczalne stężenie Cl- w wodzie do picia wynosi 250mg/dm3 . Chlorki w dużych ilościach powodują korozję metali, dając sole rozpuszczalne w wodzie. Uniemożliwiają w ten sposób tworzenie powłoki ochronnej. Duże zasolenie wody jest szkodliwe dla roślin.
Do oznaczania zawartości chlorków stosowane są następujące metody:
metoda Mohra (argentometryczna) do oznaczeń w środowisku obojętnym lub słabo alkalicznym
Metoda Mohra polega na miareczkowaniu chlorków azotanem srebrowym (AgNO3) wobec chromianu potasowego ( K2CrO4) jako wskaźnika. W roztworze obojętnym lub słabo alkalicznym (pH=6.5-10). Reakcja chlorków z jonami srebra prowadzi do powstania nierozpuszczalnego chlorku srebra (AgCl) wytrącającego się ilościowo.
Ag+ + Cl_ → AgCl↓
Po całkowitym strąceniu Cl_, nadmiar jonów Ag+ reaguje z K2CrO4 powodując zmianę barwy roztworu na żółtobrunatną
2 Ag+ + CrO42_ → Ag2CrO4↓
co świadczy o zmiareczkowaniu jonów chlorkowych. Metodę Mohra stosuje się przy zawartości chlorków > 5mg/dm3. W oznaczeniu przeszkadzają: barwa > 30mg Pt/dm3, mętność > 30mg/dm3, Fe >10mg/dm3, ortofosforany > 25mg PO43_/dm3, bromki, jodki, cyjanki, siarczki, siarczyny, tiosiarczany (S2O32_).
OZNACZENIE TLENU W WODZIE. (PN-76/C-04545)
Rozpuszczalność gazów w cieczach.
Roztwory są to układy jednofazowe, co najmniej dwuskładnikowe, których skład można zmieniać w pewnych granicach w sposób ciągły. Układ taki nie daje się rozdzielić na składniki za pomocą metod fizycznych. Rozpuszczalność danej substancji zależy od temperatury i zazwyczaj wzrasta ze wzrostem temperatury. Natomiast rozpuszczalność gazów maleje w miarę wzrostu temperatury.
Roztwory rzeczywiste wykazują odchylenie od właściwości roztworów doskonałych, gdyż oddziaływania między ich cząsteczkami nie są równe. Ze względu na właściwości strukturalne cząsteczek roztwory można podzielić na gazowe, ciekłe i stałe. Roztwory ciekłe (zwane także roztworami właściwymi) tworzą się przez rozpuszczenie w cieczy (rozpuszczalniku) gazu, cieczy lub ciała stałego. Każdy związek chemiczny oznacza się określoną rozpuszczalnością i z tego punktu widzenia roztwory mogą być nasycone (pozostające w równowadze z nadmiarem substancji rozpuszczonej), nienasycone (zawierające mniej substancji niż wynosi jej rozpuszczalność w danych warunkach) i przesycone (o stężeniu większym niż stężenie nasycenia, jest to układ metastabilny).
Rozpuszczalność gazów w wodzie chemicznie czystej zmienia się w szerokich granicach. Wyjątkowo wysoką rozpuszczalność wykazują gazy, których cząsteczki reagują z wodą np. NH3, H2S, CO2, SO2. Gazy nie reagujące z wodą rozpuszczają się w małym stopniu. Rozpuszczalność gazów zależy od ich charakteru, temperatury i ciśnienia, a w wodach naturalnych także od składu fizyczno-chemicznego i biologicznego wody.. Ze wzrostem temperatury rozpuszczalność gazów maleje, ale tylko w niskich temperaturach. Gazy o wysokiej temperaturze, zbliżonej do temperatury krytycznej wody, wykazują wzrost rozpuszczalności. W temperaturze krytycznej wody (rozpuszczalnika) wzajemna rozpuszczalność składników roztworu jest nieograniczona, gdyż powyżej tej temperatury istnieje tylko faza gazowa.
Rozpuszczalności gazów w wodzie towarzyszy wydzielanie się ciepła (ciepło hydratacji), co powoduje przesunięcie się równowagi termodynamicznej tak, aby ciepło było pobierana przez układ. Zachodzi zatem proces wydzielania gazów z wody, co oznacza zmniejszenie ich rozpuszczalności.
Woda tworzy z gazami roztwory przesycone, które są termodynamicznie nietrwałe. Stan ten można łatwo usunąć np. przez zetknięcie z cząsteczkami ciał stałych. Zależność pomiędzy rozpuszczalnością gazu a temperaturą opisuje równanie Clasiusa-Clapeyrona:
![]()
gdzie X1, X2 - rozpuszczalność gazu w temperaturach T1, T2 (w ułamkach molowych), ΔH - ciepło rozpuszczania 1 mola gazu w jego nasyconym roztworze.
Rozpuszczalność gazów można wyrażać w gramach/100g cieczy, w liczbie moli gazu/1000g cieczy, liczbie moli w 1dm3 (stężenie molowe), w ułamkach molowych lub współczynnikach pochłaniania. Współczynnik pochłaniania jest to objętość gazu rozpuszczonego w jednostce objętości cieczy w danej temperaturze (273K) pod ciśnieniem 1013.25 hPa. Np. współczynniki pochłaniania dla niektórych gazów wynoszą (w 273K):
H2 |
CO2 |
H2S |
SO2 |
O2 |
N2 |
O3 |
CH4 |
C2H2 |
NH3 |
0,0215 |
1,71 |
4,65 |
79,8 |
0,0486 |
0,0235 |
0,494 |
0,0556 |
1,73 |
1173 |
Jeśli zawartość gazów w wodzie jest mniejsza niż ich rozpuszczalność, zachodzi pochłanianie gazów z powietrza, gdy jest ona większa, gazy wydzielają się z cieczy. Np. woda świeżo destylowana nasyca się CO2 z powietrza do osiągnięcia stanu równowagi. Natomiast ciśnienia cząstkowe H2S i H2 w powietrzu są znikome, dlatego gazy te łatwo wydzielają się do powietrza atmosferycznego. Ponadto H2S w obecności rozpuszczonego O2 utlenia się do siarki elementarnej:
2 H2S + O2 → 2 H2O + 2S
Rodzaj rozpuszczalnika ma również wpływ na rozpuszczalność gazów, choć nie znaleziono tu żadnych zależności ilościowych.
Pochodzenie tlenu w wodach naturalnych.
Tlen rozpuszczony występuje we wszystkich wodach naturalnych, które stykają się z powietrzem atmosferycznym. Oznacza to, że występuje on w wodach powierzchniowych i płytkich podziemnych. Wody głębinowe są go zupełnie pozbawione.
W górnych warstwach wód powierzchniowych znajduje się tlen w ilości zbliżonej do stanu nasycenia. W głębokich wodach powierzchniowych stojących (jeziora), zawartość tlenu rozpuszczonego jest zależna m.in. od naturalnego uwarstwienia wody. W okresie zimy i lata wyróżnić można 3 warstwy:
- nadskokową (głębokość 2-3m) znajduje się w stanie ciągłej cyrkulacji i stałego kontaktu z atmosfera, zawartość tlenu zależy od stopnia czystości wody,
- skokową (grubość 1m), niewielka zawartość rozpuszczonego tlenu,
- podskokową (sięga do dna), jest prawie nieruchoma i zawiera bardzo małe ilości tlenu lub nie zawiera go wcale.
W czasie wiosny i jesieni na skutek zmian temperatury powietrza następuje wymieszanie się wody w jeziorze.
Zawartość tlenu jest ważnym wskaźnikiem stopnia zanieczyszczenia wody, a także wskaźnikiem do kontroli oczyszczania ścieków. Jego ilość zależy głównie od temperatury i ciśnienia. Zużywany jest on w wodach naturalnych przez organizmy wodne do oddychania, do utleniania substancji nieorganicznych (np. H2S, Fe2+, SO32_) oraz na procesy biochemicznego rozkładu substancji organicznych. W czystych wodach powierzchniowych zawartość O2 odpowiada 100% nasyceniu. Oznacza to, że tlen rozpuszczony w wodzie znajduje się w równowadze z tlenem atmosferycznym. W wodach zanieczyszczonych ulega on zużyciu na procesy biochemicznego rozkładu substancji organicznych i jego zawartość może < 100%. Im większe jest zanieczyszczenie substancjami organicznymi tym większe jest biochemiczne zapotrzebowanie tlenu (BZT) a ilość rozpuszczonego tlenu mniejsza. Poniżej 40% następuje śnięcie niektórych gatunków ryb, a przy wartość bliskiej zera zaczynają przeważać procesy beztlenowe (anaerobowe), a woda zaczyna wydzielać nieprzyjemny zapach.
Zawartość rozpuszczonego tlenu w wodach naturalnych wynosi 0-14 mg O2/dm3. Ilość rozpuszczonego tlenu nie określa stopnia nasycenia wody tlenem w danych warunkach. Pojęciem tym nazywamy stosunek zawartości tlenu rozpuszczonego w badanej wodzie do maksymalnej zawartości tlenu w wodzie destylowanej, wdanej tmperaturze przy ciśnieniu 760mm Hg. Procent nasycenia obliczamy ze wzoru:
X = ![]()
a - oznaczona zawartość tlenu rozpuszczonego w badanej wodzie [mg O2/dm3], c - maksy-malna ilość tlenu (w mg) zawarta w 1 dm3 wody destylowanej o temperaturze badanej wody - wartość odczytana z tabeli, B - ciśnienie barometryczne w czasie pobrania próbki wody
[mm Hg].
Ilość tlenu potrzebna do całkowitego nasycenia 1 dm3 wody destylowanej, stykającej się z powietrzem o zawartości 20,9 % tlenu pod ciśnieniem 760 mm Hg
Temperatura K |
Rozpuszczalność tlenu mg/dm3 |
Temperatura K |
Rozpuszczalność tlenu mg/dm3 |
Temperatura K |
Rozpuszczalność tlenu mg/dm3 |
273 274 275 276 277 278 279 280 281 282 |
14,62 14,23 13,84 13,48 13,13 12,80 12,48 12,17 11,87 11,59 |
283 284 285 286 287 288 289 290 291 292 |
11,33 11,08 10,83 10,60 10,37 10,15 9,95 9,75 9,54 9,35 |
293 294 295 296 297 298 299 300 301 302 |
9,17 8,99 8,83 8,68 8,53 8,38 8,22 8,07 7,92 7,77 |
W wodach powierzchniowych na skutek biochemicznego rozkładu związków organicznych, przy współudziale organizmów wodnych zużywa się tlen, a powstaje CO2 - proces samooczyszczenia. Jednakże w obecności światła i roślin wodnych (wodorosty, glony, plankton) zachodzą procesy fotosyntezy, które polegają na pochłanianiu CO2 i wydzielaniu tlenu.
CO2 + hγ = O2
Im większa głębokość zbiorników wodnych fotosynteza ulega zahamowaniu i zawartość tlenu maleje. W dzień w warstwach powierzchniowych może zachodzić zjawisko przesycenia wody tlenem (przekroczenie 100% nasycenia) wskutek:
intensywnej fotosyntezy roślin wodnych,
gwałtownego wzrostu temperatury wody - dopływ wód pochłodniczych np. z elektrowni,
spadku ciśnienia - poniżej wysokich zapór.
W nocy, tlen jest zużywany przez plankton w procesach intensywnego oddychania i jego stężenie maleje. Przesycenie wody tlenem jest także zjawiskiem niekorzystnym ze względu na organizmu wodne (ryby, bezkręgowce).
Zawartość tlenu oznacza się w wodach powierzchniowych oraz w wodach, gdzie jest niepożądanym składnikiem, gdyż w obecności agresywnego CO2 przyspiesza korozję przewodów i urządzeń metalowych:
2 H+ + Fe → 2 H + Fe2+
2 H + ½ O2 → H2O
Jony wodorowe pochodzące z dysocjacji H2CO3 atakują powierzchnię metalu. W wyniku tej reakcji do roztworu przechodzą jony Fe2+, a tworzący się wodór atomowy wydziela się i izoluje powierzchnię metalu od dalszej korozji. Jednak obecny w wodzie tlen utlenia wydzielający się wodór atomowy do H2O, powodując odkrycie powierzchni metalu i dalszy proces korozji.
Obecność tlenu w wodzie do picia nie ma znaczenia higienicznego.
Procesy samooczyszczania wód powierzchniowych i podziemnych.
Wody powierzchniowe są zazwyczaj mniej lub bardziej zanieczyszczone pod względem bakteriologicznym i fizyczno-chemicznym. Naturalne wody zawierają ponadto wiele organizmów wodnych - bakterii, glonów, zwierząt wodnych. Przy współudziale tlenu rozkładają one substancje organiczne nawet do całkowitej ich mineralizacji tzn. do CO2, H2O, HNO3, H2SO4.
Procesy te odbywają się głównie pod wpływem bakterii saprofitycznych przy współudziale mikrofauny i mikroflory. W wyniku usuwania zanieczyszczeń z wody, mikroorganizmy które to powodują, same się rozmnażają. Rodzaj organizmów występujących w danym zbiorniku zależy od:
-składu chemicznego wody -substancje organiczne i nieorganiczne występujące w danym zbiorniku stanowią materiał budulcowy dla organizmów wodnych,
-oświetlenia - ma olbrzymie znaczenie, gdyż 70 % energii słonecznej przenika do 1 m głębokości, 5,4 % do 5 m i tylko 1 % do głębokości 10 m. W wyniku tego w górnych warstwach zbiornika rozwija się zielona flora, na większych głębokościach pozostałe rodzaje organizmów wodnych. W górnych warstwach zawartość tlenu może być duża - procesy fotosyntezy roślin:
CO2 → O2 + C
W dolnych warstwach tlen jest zużywany na procesy oddychania przez faunę, wobec czego zawartość tlenu maleje, a wzrasta ilość CO2;
-zawartości tlenu i możliwości natleniania
-temperatury - zmiana jej powoduje duże zmiany w rozwoju organizmów wodnych, a tym samym w przebiegu procesów biochemicznych,
-ruchu wody - jego charakter wpływa na rodzaj organizmów wodnych, które są inne dla wód stojących a inne dla płynących.
Tlen w wodzie oznacza się metodą Winklera:
Zasada oznaczenia.
Do próbki wprowadza się MnSO4 (siarczan manganawy) z dodatkiem alkalicznego roztworu KJ (jodku potasowego).
MnSO4 + 2 KOH → Mn(OH)2↓ + K2SO4 biały osad
Rozpuszczony tlen w próbce w roztworz alkalicznym utlenia jony manganu Mn2+ → Mn4+
2 Mn(OH)2 + O2 → 2 MnO(OH)2 ↓ (brązowy osad)
czemu towarzyszy zmiana barwy osadu na jasnobrązową. Po zakwaszeniu próbki
roztworem H2SO4, który powoduje rozpuszczenie osadu, wydziela się z jodu potasowego wolny jod w ilości równoważnej zawartości tlenu rozpuszczonego w badanej próbce:
MnO(OH)2 + 2 H2SO4 → Mn(SO4)2 + 3 H2O
Mn(SO4)2 + 2 KJ → J2 + MnSO4 + K2SO4
Wydzielony jod oznacza się roztworem Na2S2O3 wobec skrobi jako wskaźnika:
J2 + 2 Na2S2O3 → 2 NaJ + Na2S2O6
Z ilości zużytego Na2S2O3 oblicza się zawartość tlenu rozpuszczonego. W oznaczeniu przeszkadzają zawiesiny, chlor, chloraminy, ClO2, CrO42-, MnO4-, Fe3+ i inne.
ODCZYN, KWASOWOŚĆ I ZASADOWOŚĆ WODY (PN-90/C-04540).
Odczyn
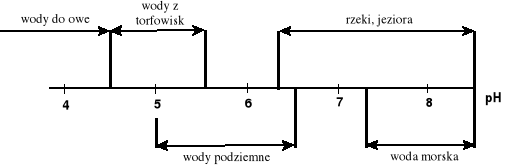
Woda chemicznie czysta ma odczyn obojętny (pH=7) tylko w 295K (22°C), przy wzroście temperatury jej pH zmniejsza się. Odczyn większości wód naturalnych wynosi 6.5 - 8.5 i zależy od wielu czynników np.
odprowadzanych zanieczyszczeń -ścieki, opady atmosferyczne,
podłoża, z którego mogą być wymywane związki o charakterze kwaśnym lub zasadowym
układu węglanowego- tzn. od zawartości węglanów i CO2 ; wody węglanowe są zasadowe, a wody ubogie w węglany są kwaśne; wody powierzchniowe swój zasadowy odczyn mogą zawdzięczać wzmożonej fotosyntezie,
rodzaju gleb w zlewni, którą odwadnia zbiornik wody (wody wypływające z bagien i lasów są zwykle kwaśne z powodu obecności kwasów huminowych i fulwowych),
skał magmowych i osadowych, wód towarzyszących złożom ropy naftowej, wód morskich i gruntowych.
Kwaśne deszcze .Obniżenie pH wód deszczowych jest spowodowane spalaniem ogromnych ilości węgla i ropy naftowej oraz wprowadzaniem do atmosfery dwutlenku siarki SO2 i tlenków azotu NOx. Gazy te łączą się z wodą tworząc kwasy H2SO4 i HNO3.
SO2 + H2O → H2SO3
H2SO3 + ![]()
O2 → H2SO4
SO2 + O2 → 2SO3
SO3 + H2O → H2SO4
2NO + O2 → 2NO2
2NO2 + H2O → HNO2 + HNO3
Kwaśny odczyn wód deszczowych jest w 60-70 % wynikiem obecności kwasu siarkowego, a w 30-40 % - kwasu azotowego. Kwaśne deszcze powstają głównie na terenach silnie uprzemysłowionych. Powstałe w wyniku spalania gazy unoszą się na dużą wysokością i mogą wędrować setki lub tysiące kilometrów od miejsca wytworzenia i tam opaść.
Zmiana wartości pH wód naturalnych może świadczyć o zanieczyszczeniu jej produktami rozkładu związków organicznych lub ściekami zawierającymi wolne kwasy, zasady lub sole. Sole hydrolizują z uwolnieniem kwasu lub zasady np.:
FeSO4 + 2H2O → Fe(OH)2 + H2SO4 zmniejsza pH wody
Al2(SO4)3 + 6H2O → 2Al.(OH)3 + 3H2SO4 zmniejsza pH wody
Na3PO4 + 2H2O → NaH2PO4 + 2NaOH zwiększa pH wody
Wody o małym pH (<6.5) mają właściwości korozyjne, o dużym (>8.5) wykazują zdolność pienienia się i smak specyficznie ługowaty. Odczyn ma duże znaczenie w wielu procesach technologicznych, biochemicznych i wpływa na proces samooczyszczania.
Kwasowość wody.
Jest to zdolność do zobojętniania dodawanych do niej silnych zasad nieorganicznych lub węglanów wobec umownych wskaźników.
Kwasowość wód naturalnych może wynikać z obecności w nich wolnego, rozpuszczonego dwutlenku węgla, słabych kwasów organicznych (humusów) oraz produktów hydrolizy soli żelaza lub glinu, wprowadzonych do wody podczas procesu koagulacji. W analityce kwasowość wody spowodowana mocnymi kwasami nieorganicznymi określa się kwasowością mineralną, spowodowaną CO2 i słabymi kwasami organicznymi, określaną jako kwasowość ogólna.
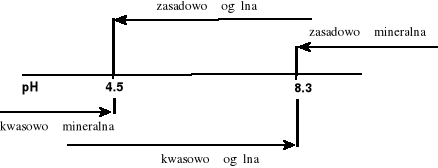
Kwasowość mineralna występuje gdy pH<4.5 i oznacza się ją wobec oranżu metylowego (za pomocą mianowanego roztworu NaOH), kwasowość ogólna występuje przy odczynie wody niższym od pH = 8.3 i oznacza się ją wobec fenoloftaleiny. Przy pH>8.3 kwasowość wody nie występuje. Reakcje zobojętniania za pomocą zasad można przedstawić następująco:
H+ + OH- = H2O
CO2 + OH- = HCO3-
Przy występowaniu kwasowości mineralnej woda ma charakter silnie korozyjny w stosunku do betonu, żelaza i innych metali. W związku z tym kwasowość mineralna jest niedopuszczalna w wodach użytkowych, gdyż rozpuszczone metale są szkodliwe dla zdrowia. natomiast kwasowość wywołana obecnością CO2, ze względu na higienę nie ma większego znaczenia.
Zasadowość wody.
Jest to zdolność wody naturalnej do zobojętniania mocnych kwasów nieorganicznych (tj. przyjmowania protonów) do określonego pH wobec umownych wskaźników. Jest ona spowodowana obecnością wodorowęglanów, węglanów (głównie metali alkalicznych), rzadziej wodorotlenków, boranów, krzemianów i fosforanów. Przy pH<8.3 występują przeważnie wodorowęglany Ca(HCO3)2, Mg(HCO3)2, Fe(HCO3)2, rzadziej NaHCO3. W wodach zanieczyszczonych ściekami przemysłowymi (przy pH>8.3) mogą występować obok anionów słabych kwasów jak np. HCO3_, CO32_, H2PO4_, HPO42_, SiO32_ również mocne zasady jak NaOH, KOH i Ca(OH)2, które dysocjują z wytworzeniem jonów OH_.
Podczas miareczkowania zachodzą następujące reakcje:
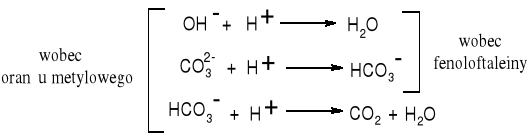
W oznaczeniu przeszkadzają: mętność > 30mg/dm3 i barwa > 50 mg Pt/dm3.
Zasadowość może być ogólna (M), oznaczana wobec oranżu metylowego przy pH>4.5 lub zasadowość mineralna (F), oznaczana wobec fenoloftaleiny przy pH>8.3. W wodach naturalnych, w zakresie pH=4.5-8.3 występuje przeważnie aniony wodorowęglanowe HCO3_, przy pH>8.3 występują ponadto jony CO32_ i OH_. Zasadowość pochodząca równocześnie od trzech jonów praktycznie nie występuje, gdyż
HCO3_ +OH_ → CO32_ + H2O
W wodzie mogą występować tylko dwa jony: [HCO3_ + CO32_] lub [OH_ + CO32_].
Zasadowość wody z punktu widzenia sanitarnego ma znaczenie raczej drugorzędne. Duże znaczenie ma natomiast w ocenie wody do celów gospodarczych i technicznych. Woda o zasadowości ogólnej, odpowiadającej twardości węglanowej w zasadzie nie nadaje się do zasilania kotłów parowych z powodu powstawania kamienia kotłowego. Również niepożądana jest w wodzie zasadowość alkaliczna, ponieważ wywołuje silne pienienie się wody w kotle i w ten sposób zanieczyszcza parę. W niektórych gałęziach przemysłu wywołuje ona szkody w produkcji wyrobów np. w garbarstwie, powodując straty garbników. Zasadowość alkaliczna stanowi różnicę pomiędzy zasadowością a twardością ogólną. Ten rodzaj zasadowości powodowany jest właśnie przez zawarte w wodzie wodorowęglany i węglany potasowe i sodowe.
Zależność między rodzajem zasadowości a stężeniami jonów OH-, CO32-, HCO3- wygląda następująco:
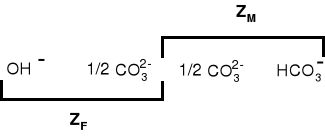
Wolne jony wodorotlenowe OH_ nie mogą istnieć, gdyż zachodzi reakcja:
HCO3_ + OH_ → CO32_ + H2O
ZF = ½ [CO32_]
ZM - ZF = [HCO3_] + ZF
[HCO3_] = ZM - 2ZF
Na podstawie wartości zasadowości wobec fenoloftaleiny ZF i zasadowości ogólnej ZM można obliczyć zawartość jonów, które powodują zasadowość wody.
TWARDOŚĆ WODY (PN-71/C-04554)
Jest to właściwość wody polegająca na zużywaniu pewnych ilości mydła bez wytworzenia piany. Wynika to z obecności w wodzie jonów Ca, Mg, Mn, Al, Zn, które tworzą z mydłem dodawanym do wody nierozpuszczalne sole. Pienienie się roztworu następuje dopiero po ich strąceniu. Zawartość wapnia i magnezu w wodach naturalnych jest dużo większa od innych wymienionych pierwiastków wobec tego twardość wody naturalnej zależy głównie od obecności jonów Ca2+ i Mg2+. Sole wapnia i magnezu występują w wodach naturalnych przeważnie w postaci wodorowęglanów Ca(HCO3)2, Mg(HCO3)2, albo jako siarczany, chlorki, azotany i inne związki.
W wodach naturalnych zawartość Ca jest większa od Mg, przy czym rozpuszczalność MgCO3 jest większa od CaCO3, co oznacza, że MgCO3 jest obecny w wodzie, natomiast CaCO3 praktycznie nie istnieje w formie rozpuszczonej. Twardość wody surowej nazywa się twardością ogólną i jest sumą twardości węglanowej (TwW) i twardości niewęglanowej (TwN):
węglanowa: (TwWCa, TwWMg) wywołana przez wodorowęglany, węglany i wodorotlenki wapnia i magnezu: Ca(HCO3)2, CaCO3, Ca(OH)2, Mg(HCO3)2, MgCO3Mg(OH)2,
niewęglanowa (TwNCa, TwNMg) wywołana przez inne związki wapnia i magnezu CaSO4, CaCl2, Ca(NO3)2, MgSO4, MgCl2, Mg(NO3)2.
Twardość węglanowa w czasie gotowania wody ulega zmniejszeniu w wyniku rozkładu wodorowęglanów i hydrolizie powstających węglanów
Ca(HCO3)2 ⇔ CaCO3 ↓ + H2O + CO2 ↑
Mg(HCO3)2 ⇔ MgCO3 ↓ + H2O + CO2 ↑
MgCO3 + H2O ⇔ Mg(OH)2 ↓ + CO2 ↑
Twog. = Twnwęg. + Twwęg.
Gdy twardość wody jest większa od sumy jej zasadowości węglanowej i zasadowości wodorowęglanowej (zasadowości ogólnej), to ta część twardości, która równa się zasadowości ogólnej, określana jest jako twardość węglanowa. Nadwyżka twardości w stosunku do wartości zasadowości ogólnej określana jest jako twardość niewęglanowa. Gdy twardość wody jest równa lub mniejsza od wartości jej zasadowości ogólnej, wówczas cała twardość ogólna składa się tylko z twardości węglanowej, a twardość niewęglanowa równa jest zeru.
Twardość wód naturalnych waha się w szerokich granicach, które można określić jako sięgające od 1 do 20 mval/dm3. Wody uzdatniane mogą mieć twardość bliską 0 mval/dm3. Higieniczno-sanitarne znaczenie twardości wody do picia może być traktowane jako czynnik drugorzędny. Jedynie w przypadkach, gdy ilość soli magnezowych jest bardzo duża (np. chlorku lub siarczanu magnezowego) może to wpływać na smak wody lub wywoływać przejściowe biegunki. Wody bardzo miękkie jak również bardzo twarde mogą być używane
do picia bez ujemnego wpływu na zdrowie ich konsumentów.
Z gospodarczo-przemysłowego punktu widzenia woda twarda jest niepożądana ze względu na duże straty mydła w gospodarstwach domowych oraz przemyśle i łatwość tworzenia osadów w postaci kamienia. Poza tym woda twarda powoduje niekiedy podrażnienia skóry przy częstym myciu. Dlatego też zalecane jest, aby woda do celów gospodarczych i do picia nie wykazywała twardości większej od 7,14 mval/dm3.
Wodzie używanej przez różne gałęzie przemysłu stawiane są na ogól specjalne wymagania dotyczące jej twardości. Poza niektórymi gałęziami przemysłu spożywczego, jako woda
produkcyjna, dopuszczana jest na ogół tylko woda miękka. Specjalne wymagania stawiane są
wodzie stosowanej do zasilania kotłów parowych. Dla takiej wody brana jest pod uwagę nie tylko sama jej twardość, lecz również rodzaj poszczególnych związków wapniowych i magnezowych, powodujących tę twardość. Najbardziej szkodliwy jest siarczan wapniowy, gdyż z niego powstaje, trudny do usuwania, twardy kamień kotłowy. Chlorek magnezowy natomiast wywołuje korozję kotłów parowych.
Twardość wody można wyrażać w różnych jednostkach. Najbardziej rozpowszechnione jest stosowanie stopni twardości. W celu ujednolicenia oznaczania twardości przyjęto wyrażać twardość w uniwersalnych jednostkach chemicznych w milimolach jonów Ca i Mg zawartych w 1dm3(mmol/dm3) .
Inne jednostki i ich przeliczniki:
TAB. JEDNOSTKI TWARDOŚCI WODY I WSPÓŁCZYNNIKI PRZELICZENIOWE
Jednostka |
mmol/dm-3 |
mg (CaCO3)/dm-3 |
niemiecka (ºn) |
francuska (ºF) |
Mmol/ dm-3 |
1 |
100,08 |
5,61 |
10,00 |
mg (CaCO3)/ dm-3 |
0,01 |
1 |
0,056 |
0,10 |
niemiecka (ºn) |
0,178 |
17,84 |
1 |
1,784 |
francuska (ºF) |
0,10 |
10,00 |
0,560 |
1 |
gdzie:
1 stopień niemiecki (1on) = 10 mg CaO (lub 7,19 mg MgO) w 1 dm3 wody,
1 stopień francuski (1oF) = 10 mg CaCO3 w 1 dm3 wody,
1 mmol = 40,08 mg Ca2+ (lub 24,32 mg Mg2+) w 1 dm3 wody,
1ºn = 0,356 mval/dm3.
Przeliczenie jedynostek
1 mval/dm3 odpowiada 2,8 0 n (niemiecki stopień twardości)
1 mval/dm3 → 50 mg CaCO3/dm3
1 mval/dm3 → 0,5 mmol/dm3
1 mval/dm3 → 28 mg CaO/dm3
1 mmol/dm3 → 5,6 0 n
1 mmol/dm3 → 100 mg CaCO3/dm3
1 mmol/dm3 → 2 mval/dm3
1 mmol/dm3 → 56 mg CaO/dm3
10 n → 0,357 mval/dm3
10 n → 0,179 mmol/dm3
10 n → 10 mg CaO/dm3
10 n → 1,79 mg CaCO3/dm3
Twardość wody wyraża się w 6-stopniowej skali.
Skala twardości wody:
Woda |
stopnie twardości |
mg CaO/dm3 |
Bardzo miękka Miękka O średniej twardości O znacznej twardości Twarda Bardzo twarda |
0-5 5-10 10-15 15-20 20-30 powyżej 30 |
0-50 50-100 100-150 150-200 200-300 powyżej 300 |
Wody opadowe są miękkie (°tw≈0), wody mineralne i morskie są natomiast bardzo twarde gdyż zawierają duże ilości Mg (350÷450°tw). Wody powierzchniowe zwłaszcza te z potoków górskich są na ogół miękkie. Większą twardość wykazują wody podziemne. Twardość naturalna wód słodkich wynosi 1÷60°tw. Wody twarde i bardzo miękkie mogą być używane do picia bez szkody dla zdrowia, niekiedy mogą mieć jedynie gorzki lub mdły smak. Szkodliwa jest duża zawartość chlorku i siarczanu magnezu, które to mogą powodować biegunki. Twarda woda jest niepożądana:
pogarsza wartości odżywcze gotowanego mięsa i jarzyn,
powoduje duże zużycie mydła w trakcie mycia,
może powodować podrażnienie skóry,
nie nadaje się do produkcji piwa, barwników, wyrobów tekstylnych,
taką woda nie można zasilać kotłów - powstaje kamień kotłowy ,który utrudnia wymianę ciepła.
Dopuszczalna twardość wody przeznaczonej do spożycia wynosi: 60*) - 500 mg CaCO3/dm3 (*)wartość zalecana ze względów zdrowotnych).
Zasada oznaczenia twardości ogólnej metoda wersenianową.
Oznacza się ją kompleksometrycznie wobec czerni erichromowej T jako wskaźnika. Jony Ca i Mg w roztworze wodnym o pH około 10 zmieniają niebieskie zabarwienie czerni tworząc z nią związek kompleksowy o czerwonym zabarwieniu. Kompleks ten jest mniej trwały niż z wersanianem dwusodowym. Przy miareczkowaniu po związaniu wszystkich jonów Ca i Mg przez wersenian, wskaźnik zostaje uwolniony i barwa roztworu zmienia się z czerwonej na niebieską. Zmiana zabarwienia miareczkowanego roztworu jest wyraźna jedynie w obecności dostatecznej ilości jonów magnezowych.
SUCHA POZOSTAŁOŚĆ
Sucha pozostałość - substancje nierozpuszczone i rozpuszczone wydzielone z wody przez odparowanie lub wysuszenie w temperaturze 105°C do stałej masy
Zawiesiny ogólne - substancje nierozpuszczalne, pływające i zawieszone, wydzielone z wody lub ścieków przez przesączenie lub odwirowanie i wysuszenie w temperaturze 105°C do stałej masy.
Zawiesiny składają się z substancji organicznych i mineralnych. Mogą być pochodzenia naturalnego (np. cząstki drobnego piasku, gliny, wytrącone związki żelaza lub manganu, organizmy wodne) lub mogą pochodzić z zanieczyszczeń znajdujących się w ściekach miejskich lub przemysłowych. Zawiesiny można podzielić na łatwoopadające (o średnicy cząstek 0,1 μm i większych) oraz trudnoopadające (o średnicy cząstek poniżej 0,1 μm).
Sumaryczna ilość zawiesin łatwo i trudnoopadających, zarówno mineralnych jak i lotnych, stanowi zawiesiny ogólne. Zasada oznaczania zawartości zawiesin ogólnych polega na przesączeniu określonej objętości próbki ścieków przez przygotowany i zważony ilościowy sączek bibułowy, a następnie jego wysuszeniu wraz z zawartością do stałej masy w 105°C i zważeniu. Zasada oznaczania zawiesin mineralnych (nielotnych) polega na wyprażeniu zawiesin ogólnych w 550oC i zważeniu pozostałości po prażeniu. Schemat zależności pomiędzy zawiesinami, suchą pozostałością, a substancjami rozpuszczonymi przedstawia rysunek jak i lotnych, stanowi zawiesiny ogólne.
Zasada oznaczania zawartości zawiesin ogólnych polega na przesączeniu określonej objętości próbki ścieków przez przygotowany i zważony ilościowy sączek bibułowy, a następnie jego wysuszeniu wraz z zawartością do stałej masy w 105°C i zważeniu. Zasada oznaczania zawiesin mineralnych (nielotnych) polega na wyprażeniu zawiesin ogólnych w 550oC i zważeniu pozostałości po prażeniu.
Schemat zależności pomiędzy zawiesinami, suchą pozostałością, a substancjami rozpuszczonymi przedstawia rysunek .
Rys. Zależności pomiędzy zawiesinami, suchą pozostałością, a substancjami rozpuszczonymi.
ŻELAZO
Żelazo występuje głównie w postaci rud (hematyt, magnetyt, piryt), a w wolnej postaci jedynie w niewielkich ilościach w meteorytach.
Źródłem związków żelaza w wodach naturalnych mogą być:
- gleba i skały, z których te związki są wymywane;
- zanieczyszczenia, głównie ściekami przemysłowymi z kopalni, galwanizerni, zakładów metalurgicznych, farbiarskich;
- korozja rur i zbiorników żelaznych i stalowych, z którymi woda miała kontakt.
W wodzie naturalnej żelazo występuje w związkach na II i III stopniu utlenienia w formie rozpuszczonej, koloidalnej i zawiesin. Związki żelaza(II) stanowią najczęściej rozpuszczony kwaśny węglan żelaza(II) lub siarczan(VI) żelaza(II) (w wodach z torfowisk). Ten kwaśny dwuwęglan żelazawy utrzymuje się w wodzie w postaci rozpuszczonej dzięki obecności wolnego CO2 i braku powietrza. W obecności tlenu dwuwęglan żelaza(II) ulega hydrolizie z jednoczesnym utlenieniem żelaza i wydzieleniem CO2:
2 Fe(HCO3) 2 + H2O + ½ O2 �� 2 Fe(OH) 3 ↓ + 4CO2
Związki żelaza(III) łatwo wytrącają się w wodzie, powodując stopniowe zmętnienie i brunatnienie wód zawierających znaczne ilości związków żelaza. W wodach zawierających dużo związków organicznych, a szczególnie związków humusowych, proces ten zachodzi częściowo, gdyż związki te mogą odgrywać rolę koloidów ochronnych zapobiegających wytrącaniu się Fe(OH)3.
W organizmie ludzkim znajduje się 3,5 - 4,5 g żelaza. Jest składnikiem hemoglobiny, mioglobiny i wielu enzymów. Żelazo jest niezbędne dla organizmu jako składnik krwiotwórczy oraz do transportu i magazynowania tlenu. Przy długotrwałym niskim spożyciu żelaza rozwija się niedokrwistość (anemia), objawiająca się zmianami w śluzówce (biegunki, zanik śluzówki żołądka, zmiany zapalne) oraz niedotlenieniem tkanek, co powoduje obniżenie zdolności psychofizycznych, szybsze męczenie się organizmu, zakłócenia snu, osłabienie odporności organizmu, a u kobiet w ciąży może prowadzić do poronień, przedwczesnego porodu lub wad rozwojowych płodu. Efektem nadmiernego spożycia żelaza może być zmniejszenie wchłaniania innych składników mineralnych (cynku, miedzi), zwiększone ryzyko wystąpienia infekcji, nadmierne gromadzenie żelaza w tkankach i ich uszkodzenie (np. trzustki -cukrzyca) oraz zwiększenia wystąpienia chorób nowotworowych. Jednak przypadki nadmiernego spożycia żelaza są znacznie rzadsze niż przypadki jego niedoboru i zwykle są spowodowane przedawkowaniem preparatów witaminowych zawierających żelazo.
Duża zawartość żelaza w wodzie wywołuje jej mętność, brunatną barwę i pogarsza walory smakowe. Powoduje też brudzenie tkanin podczas prania z użyciem takiej wody. Wody o dużej zawartości żelaza mają na ogół odczyn kwasowy, są toksyczne dla ryb i sprzyjają rozwojowi bakterii żelazistych (może powodować zatykanie urządzeń wodociągowych) oraz wywołują zaburzenia wzrostu u roślin.
OZNACZANIE ŻELAZA METODĄ KOLORYMETRYCZNĄ Z TIOCYJANIANEM
Zasada oznaczenia
Jony Fe3+ reagują w słabo kwaśnym środowisku z jonami SCN-, tworząc tiocyjanianowe kompleksy żelaza(III) o zabarwieniach krwistoczerwonych: [Fe(H2O)5(SCN)]2+, [Fe(H2O)4(SCN)2]+, [Fe(H2O)3(SCN)3].
Metoda ta może być stosowana po wyeliminowaniu czynników przeszkadzających, takich jak:
- barwa,
- mętność,
- duża zawartość związków organicznych,
- aniony tworzące kompleksy z żelazem (np. F-),
- metale wchodzące w kompleksy z tiocyjanianem (np. Ag+, Cd2+).
Barwę, mętność i substancje organiczne usuwa się poprzez wyprażanie próbki z HCl (1:1), przy dużej ilości jonów przeszkadzających należy zastosować inną metodę.
MANGAN
Mangan podobnie jak żelazo jest jednym z najbardziej rozpowszechnionych metali. W skorupie ziemskiej i wodach naturalnych zwykle występuje łącznie z żelazem. W wodach naturalnych najczęściej spotyka się mangan w ilościach 0,1 - 0,3 mg/l. Pochodzi z resztek roślinnych, z gleby oraz zanieczyszczeń, głównie przemysłowych W przypadku kontaktu z tlenem mangan tworzy nierozpuszczalne tlenki, które mogą powodować powstawanie niepożądanych osadów i problemy z barwą wody w systemach wodociągowych.
Mangan jest niezbędnym pierwiastkiem śladowym, jego dobowe zapotrzebowanie wynosi 30 - 50 mg/kg masy ciała. Dzienne spożycie manganu przez osoby dorosłe przyjmuje się w gra-nicach 2 - 9 mg. Przy założeniu, iż 20% spożycia manganu pochodzi z wody do picia, ustalo-no tymczasową zalecaną wartość 0,5 mg/l opartą na względach zdrowotnych, która powinna być odpowiednia dla ochrony zdrowia publicznego. Dotychczas na podstawie wyników badań nie udowodniono toksyczności związanej ze spożyciem manganu w wodzie do picia w odniesieniu do ludzi.
Zgodnie z obecnie obowiązującymi przepisami zawartość manganu w wodzie nie powinna przekraczać 0,05 mg/l, jednakże już stężenie 0,1 mg/l może powodować pogorszenie się cech organoleptycznych wody i narzekania konsumentów.
Oznaczanie manganu zmodyfikowaną metodą kolorymetryczną z katalizatorem srebrowym
Podstawą kolorymetrycznej metody oznaczania jest utlenianie jonów manganowych silnym utleniaczem, którym jest nadsiarczan amonowy w środowisku kwaśnym, do zabarwionych na fioletowo jonów nadmanganianowych. Intensywność zabarwienia jest proporcjonalna do zawartości manganu w roztworze. Przebieg reakcji przedstawia równanie:
Katalizatorem reakcji jest azotan srebrowy. Stosując nadsiarczan amonowy i jony srebra, przy obecności w roztworze nawet małych ilości chlorków, należy dodać azotanu rtęciowego, który zapobiega zmętnieniu roztworu, tworząc z jonami chlorkowymi kompleks, rozpuszczalny w środowisku kwaśnym. Utlenianie przeprowadza się w podwyższonej temperaturze w mieszaninie kwasów: siarkowego i azotowego. Czynnikiem przeszkadzającym w oznaczaniu oprócz chlorków są substancje organiczne zawarte w wodzie, których ujemny wpływ eliminuje się poprzez dodanie nadmiaru nadsiarczanu amonowego i dłuższe gotowanie roztworu.
Bibliografia.
W. Hermanowicz, „Chemia sanitarna”, Arkady, Warszawa 1984
E. Gomółka, A, Szaynok, „Chemia wody i powietrza”, Oficyna Wydawnicza Politechniki Wrocławskiej, Wrocław 1997
Pr. Zbiorowa, „Laboratoryjne badanie wody, ścieków i osadów ściekowych. Cz.1 i 2”, Oficyna Wydawnicza Politechniki Warszawskiej, Warszawa 2001
J. Minczewski, Z. Marczenko, „Chemia analityczna. Cz. 1 i 2”, Wydawnictwo Naukowe PWN, Warszawa 2001
B.I. Stiepanow, „Podstawy chemii i technologii barwników organicznych”, WNT Warszawa 1980
J. March, „Chemia organiczna. reakcje, mechanizmy, budowa”, WNT Warszawa 1975
W. Hermanowicz i in., „Fizyczno-chemiczne badanie wody i ścieków”, Wyd. Arkady, Warszawa 1976
Pr. zbiorowa, „Fizykochemiczna analiza zanieczyszczeń powietrza', Oficyna Wydawnicza Politechniki Wrocławskiej, Wrocław 1997
L. Kołodziejczyk, S. Mańkowski, M Rubik, „Pomiary w inżynierii sanitarnej”, Arkady, Warszawa 1980
J. Dojlido, „Chemia wody”, Arkady, Warszawa 1987
I. Trzepierczyńska, „Fizykochemiczna analiza zanieczyszczeń powietrza”, Oficyna Wydawnicza Politechniki Wrocławskiej, Wrocław 1997
Rozporządzenie Ministra Zdrowia z dn. 19.11.2002 r. w sprawie wymagań dotyczących jakości wody przeznaczonej do spożycia przez ludzi (Dz. U. Nr 203 poz.1718)
Rozporządzenie Ministra Środowiska z dn. 27.11.2002 r. w sprawie wymagań, jakim powinny odpowiadać wody powierzchniowe wykorzystywane do zaopatrzenia ludności w wodę przeznaczoną do spożycia (Dz. U. Nr 204, poz. 1728 z dn. 9.12.2002 r.)
Rozporządzenie Ministra Środowiska z dn. 5.12.2002 r. w sprawie wartości odniesienia dla niektórych substancji w powietrzu (Dz. U. Nr 1, poz. 12 z dn. 8.01.2003)
1
27
Wyszukiwarka
Podobne podstrony:
Sucha pozostałość, Studia, PK OŚ, chemia, laboratorium
Glony(1), Studia, PK OŚ, biologia, laboratorium
GLONY, Studia, PK OŚ, biologia, laboratorium
POMIAR, Studia, PK OŚ, biologia, laboratorium
Morfologia liścia, Studia, PK OŚ, biologia, laboratorium
Zadania z, Studia, PK OŚ, technologia informacyjna, exel
Zagadn do egzaminu Biologia 2011 2022, Studia, PK OŚ, biologia
Excel strona internetowa, Studia, PK OŚ, technologia informacyjna, exel
zadania cz.1ab, Studia, PK OŚ, biochemia, zadania
teoria 9, studia, IV semestr, chemia fizyczna
Zasady zaliczania, Studia, PK OŚ, technologia informacyjna
Zadania z, Studia, PK OŚ, technologia informacyjna, exel
iloczyn rozpuszczalności, STUDIA (ochrona), ROK I, chemia, laboratoria
chromatografia - ćwiczenie laboratoryjne, Studia Zip, Semestr 1, Chemia
termochemia, STUDIA (ochrona), ROK I, chemia, laboratoria
Laboratorium 4 Reakcje utleniania i redukcji, Studia - Inżynieria materiałowa, Chemia ogólna i nieor
Laboratorium 9 Iloczyn rozpuszczalności, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganic
Dysocjacja, Studia, Semestr II, Chemia, Laboratorium
więcej podobnych podstron