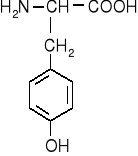
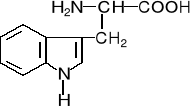
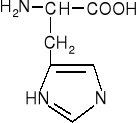
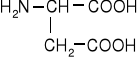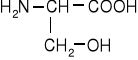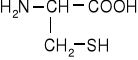CHROMATOGRAFIA BIBUŁOWA
BIAŁKA - WIADOMOŚCI OGÓLNE
Chemiczna budowa białek
Białka, czyli proteiny są podstawowymi składnikami strukturalnymi wszystkich organizmów żywych, zarówno zwierzęcych, jak i roślinnych. Stanowią one postawę wszystkich przejawów życia.
Białka są wielkocząsteczkowymi kondensatami α-aminokwasów, połączonych za pomocą wiązań peptydowych, tj. wiązań -CO-NH-. Wszystkie substancje białkowe dzielą się na dwie grupy:
1. Białka proste, czyli proteiny, zbudowane wyłącznie z aminokwasów.
2. Białka złożone, czyli proteidy, które oprócz części białkowej zawierają związaną z nią część niebiałkową, zwaną grupą prostetyczną.
Poszczególne rodzaje białek różnią się przede wszystkim:
a) rodzajem aminokwasów wchodzących w ich skład,
wielkością cząsteczek, tj. masą cząsteczkową,
kształtem drobin: kulistym, czyli globularnym, lub włókienkowym, czyli fibrylarnym,
kolejnością powiązania reszt aminokwasowych w ich makrocząsteczkach.
Aminokwasowy skład białek można określić przez ich hydrolizowanie, powodujące rozerwanie wiązań peptydowych:
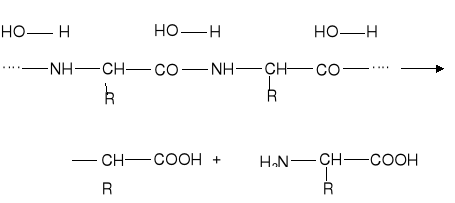
W wyniku hydrolizy powstaje hydrolizat białkowy stanowiący mieszaninę wszystkich aminokwasów, które wchodziły w skład makrodrobiny białka. Za pomocą odpowiednich metod hydrolizat białkowy można rozdzielić na poszczególne aminokwasy i określić ich rodzaj oraz ilościowy udział w budowie makrodrobiny białka.
Aminokwasy substancji białkowych
W skład substancji białkowych wchodzą rodzaje aminokwasów przedstawione w tabeli 1.
Tabela 1. Rodzaje aminokwasów
Aminokwasy łańcuchowe |
Aminokwasy cykliczne |
||||
niepodstawione |
podstawione |
aromatyczne
|
heterocyklicz-ne
|
||
jednoaminokwasy a) jednokarboksylowe b) dwukarboksylowe |
dwuaminokwasy a) jednokarboksy- lowe |
hydroksya- minokwasy
|
aminokwasy siarkowe
|
|
|
|
|
|
|
|
|
A |
B |
C |
D |
E |
F |
Wszystkie substancje białkowe świata zwierzęcego i roślinnego w całej ich różnorodności są zbudowane tylko z ok. 40 aminokwasów, z których ok. 20 wchodzi w skład wszystkich substancji białkowych. Aminokwasy te są α-aminokwasami o ogólnym wzorze:
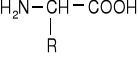
i różnią się tylko budową rodnika R. Najważniejszymi są:
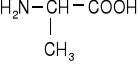
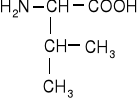
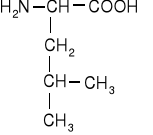
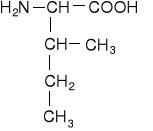
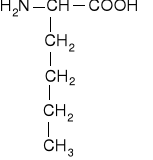
Jednoaminokwasy łańcuchowe niepodstawione
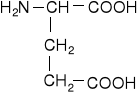
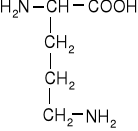
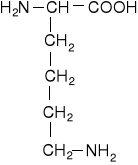
Dwuaminokwasy łańcuchowe niepodstawione
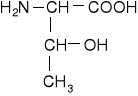
Hydroksyaminokwasy łańcuchowe
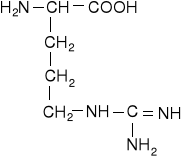
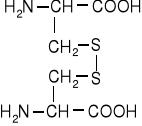
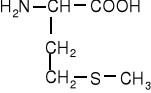
Aminokwasy siarkowe
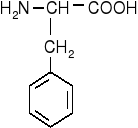
Aminokwasy aromatyczne
Aminokwasy heterocykliczne
|
|
|
glikokol |
alanina |
walina |
|
|
|
leucyna |
izoleucyna |
norleucyna |
|
|
|
kwas asparaginowy |
kwas glutaminowy |
|
|
|
|
ornityna |
arginina |
lizyna |
|
|
seryna |
treonina |
|
|
|
cysteina |
cystyna |
metionina |
|
|
fenyloalanina |
tyrozyna |
|
|
|
prolina |
tryptofan |
histydyna |
Fizyczne właściwości białek
Po połączeniu się aminokwasów w łańcuch reszt powiązanych wiązaniami peptydowymi -CO-NH-, czyli w drobinę białka, zawsze na jednym końcu łańcucha pozostaje wolna grupa aminowa, a na drugim wolna grupa karboksylowa:
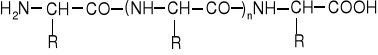
Ponadto w resztach R znajdują się wolne grupy aminowe dwuaminokwasów oraz wolne grupy karboksylowe aminokwasów dwukarboksylowych. Wskutek tego, że w makrodrobinach białek znajdują się grupy o charakterze zasadowym (NH2) i grupy o charakterze kwasowym (COOH), białka są amfoterami, tworząc sole zarówno z kwasami (w których są kationami), jak i z zasadami (w których są anionami). W określonym pH, charakterystycznym dla każdego białka i zwanym punktem izoelektrycznym, dysocjacja kwasowych i zasadowych grup makrodrobiny białka wzajemnie się równoważy i białko staje się obojętnym amfijonem.
Z fizycznych właściwości białek najbardziej charakterystyczne są:
1) wytrącenie się białka z roztworu koloidalnego w punkcie izoelektrycznym,
2) wytrącenie się białka z roztworu koloidalnego pod wpływem soli nieorganicznych, czyli tzw. wysalanie.
Wytrącanie białka w punkcie izoelektrycznym
Liczne białka są koloidami hydrofilowymi. Ich cząsteczki wykazują dość duże powinowactwo do wody. Otoczka z drobin wody, związanych z makrodrobiną białka siłami oddziaływań międzycząsteczkowych, oraz jednoimienne (najczęściej ujemne) ładunki elektryczne makrodrobin białka powodują ich wzajemne odpychanie się w stanie roztworu koloidalnego, stając się przyczyną jego trwałości.
W punkcie izoelektrycznym, wyrażonym przez odpowiednią wartość wykładnika stężenia jonów wodorowych pH, następuje zobojętnienie ładunków elektrycznych makrodrobin białka w roztworze koloidalnym. W wyniku zostaje usunięta warstewka drobin wody i następuje koagulacja, czyli wytrącenie białka z roztworu koloidalnego. Wartość pH punktu izoelektrycznego jest wielkością charakterystyczną określonego białka, która może służyć do jego identyfikacji. Dla większości białek punkt izoelektryczny leży w zakresie słabo kwaśnym (pH = 5,0). W roztworach silnie kwaśnych makrodrobiny białek zmieniają swój ładunek na dodatni (stają się kationami), który podwyższa stabilność ich roztworów koloidalnych. W roztworach zasadowych makrodrobiny białek uzyskują ładunek ujemny (stają się anionami), co również zwiększa stabilność roztworu koloidalnego. Dlatego białka z silnie kwaśnych i silnie zasadowych roztworów nie wytrącają się przy ogrzewaniu.
Wysalanie białek
Pod wpływem stężonych roztworów różnych soli nieorganicznych białka ulegają wytrącaniu, czyli wysoleniu z roztworu koloidalnego. Do wysalania białka stosuje się różne sole metali lekkich, najczęściej siarczan(VI) amonu (NH4)2SO4, siarczan(VI) sodu Na2SO4, chlorek sodu NaCl i siarczan(VI) magnezu MgSO4. W wystarczająco dużym stężeniu tych soli jony o ładunku przeciwnym ładunkowi makrodrobin białka, absorbując się na ich powierzchni, zobojętniają ich ładunek, usuwają ochronną otoczkę drobin wody i zmniejszają stabilność roztworu koloidalnego. Następuje koagulacja i białko wytrąca się z roztworu.
Do wysolenia różnych białek są konieczne różne stężenia tych samych soli. Pozwala to przeprowadzić frakcjonowane wysalanie mieszaniny różnych białek. Najsilniej wysalająco działa siarczan amonu, którego stężone roztwory wysalają wszystkie białka. Niektóre białka (np. globuliny) wytrącają się już półnasyconym roztworem siarczanu amonu. Inne białka (np. albuminy) wysalają się tylko nasyconym roztworem tej soli. Chlorek sodu i siarczan magnezu natomiast wytrącają globuliny tylko przy pełnym nasyceniu roztworu. W punkcie izoelektrycznym w środowisku słabo kwaśnym chlorek sodu i siarczan magnezu wytrącają zarówno globuliny, jak i albuminy nie tylko przy całkowitym nasyceniu, ale nawet przy niewielkim stężeniu tych soli w roztworze.
Obie opisane przemiany fizyczne, tj. koagulacja w punkcie izoelektrycznym i wysalanie, nie powodują zmian struktury białka i są odwracalne. Po usunięciu czynnika powodującego wytrącenie osad białka może przejść ponownie w stan roztworu koloidalnego. Sole nieorganiczne z roztworu koloidalnego można usunąć za pomocą dializy wykorzystującej błony półprzepuszczalne, które są przenikalne dla jonów, a nie są przenikalne dla drobin koloidu.
Badanie składu hydrolizatów białkowych
Do badania składu hydrolizatów białkowych, a zatem i białek, z których one powstały, stosuje się wiele metod, z których program ćwiczeń obejmuje tylko chromatografię bibułową lub cienkowarstwową.
Chromatografia cienkowarstwowa polega na tym, że kroplę hydrolizatu białkowego umieszcza się na skraju płytki szklanej, powleczonej cienką warstwą adsorbenta (np. tlenkiem glinu, żelem krzemionkowym, kwasem krzemowym lub ziemią okrzemkową) (w przypadku chromatografii bibułowej jest to odpowiedni arkusz bibuły chromatograficznej); płytkę umieszcza się w naczyniu z rozpuszczalnikiem, tak aby naniesiona kropla hydrolizatu znajdowała się nad powierzchnią rozpuszczalnika. Rozpuszczalnik wznoszący się w warstwie adsorbenta pod działaniem sił kapilarnych ekstrahuje z kropli hydrolizatu zawarte w niej aminokwasy, unosząc je w górę płytki. Rozpuszczone aminokwasy są adsorbowane na adsorbencie: łatwo adsorbujące się w pobliżu miejsca naniesienia kropli hydrolizatu, a trudniej adsorbujące się w pewnej od niego odległości. Gdy front wznoszącego się rozpuszczalnika osiągnie określoną wysokość, płytkę wyjmuje się i suszy, a następnie skrapia roztworem odczynnika, np. roztworem ninhydryny, który z aminokwasami daje reakcję barwną. Poszczególne barwne plamki odpowiadają określonym aminokwasom. Plamki identyfikuje się przez porównanie z plamkami powstałymi z naniesionych na tę samą płytkę kropel roztworów czystych aminokwasów, albo za pomocą współczynników przesunięcia Rf.
Współczynnik przesunięcia Rf jest stosunkiem odległości plamki od miejsca naniesienia kropli hydrolizatu do odległości, na jaką przesunął się front rozpuszczalnika.
Rys. 1. Schemat chromatografii cienkowarstwowej lub bibułowej
Współczynnik przesunięcia Rf jest wielkością charakterystyczną i stałą dla określonego aminokwasu pod warunkiem, że rozdział chromatograficzny jest przeprowadzany w ściśle ustalonych warunkach.
Przeprowadzić rozdział chromatograficzny aminokwasów hydrolizatu białka i oznaczyć współczynniki przesunięcia Rf
Sprzęt laboratoryjny: komora chromatograficzna, uchwyt do bibuły chromatograficznej, rozpylacz, ołówek, linijka, skrzynka do spryskiwania, suszarka, kapilara szklana. |
Odczynniki i materiały: |
|
próbka hydrolizatu białkowego, |
|
pasek bibuły chromatograficznej, |
|
mieszanina rozpuszczalników, |
|
roztwór ninhydryny, |
|
eluent = mieszanina tert-butanolu, kwasu octowego i wody w stosunku 4:1:5. |
|
|
|
|
|
|
Wykonanie
A. Na pasek bibuły chromatograficznej o wymiarach 20x20 cm w odległości 2 cm równolegle do jednego z boków narysować ołówkiem przerywaną kreskę i w miejscu przerywania kreski umieścić krople hydrolizatu białkowego.
B. Na dno komory chromatograficznej wlać mieszaninę rozpuszczalników (eluent) w takiej ilości, aby słup cieczy miał wysokość 1 cm.
C. Pasek bibuły chromatograficznej z naniesionymi kroplami hydrolizatu umocować w ramce z drutu i zanurzyć dolnym końcem w mieszaninie rozpuszczalników znajdującej się na dnie komory chromatograficznej. Komorę chromatograficzną przykryć pokrywą.
D. Gdy front rozpuszczalnika wzniesie się na bibule na wysokość 12 cm ponad kreskę z punktu A, bibułę wyjąć, zaznaczyć na niej ołówkiem front rozpuszczalnika i wysuszyć w suszarce.
E. Wysuszoną bibułę umieścić w skrzynce do spryskiwania i spryskać butanolowym roztworem ninhydryny, a następnie umieścić w suszarce o temp. 110oC na 15-30 min.
F. Na wywołanym chromatogramie wymierzyć odległość od miejsca startu (miejsca naniesienia kropli hydrolizatu) a. - do frontu rozpuszczalnika b. - do środka poszczególnych plamek .
G. Wyznaczyć współczynniki Rf chromatogramu i na ich podstawie według podanej tabeli określić aminokwasy zawarte w badanym hydrolizacie. Do sprawozdania załączyć chromatogram.
Przepisy
1. Mieszanina rozpuszczalników
Zmieszać 200 cm3 tert-butanolu, 50 cm3 kwasu octowego lodowatego i 250 cm3 wody destylowanej.
2. Roztwór ninhydryny
1,5 g ninhydryny rozpuścić w 500 cm3 tert-butanolu i dodać 15 cm3 kwasu octowego lodowatego.
Uwagi
1. Należy unikać dotykania bibuły palcami
2. W celu uzyskania wyraźniejszych plamek na chromatogramie można naniesioną kroplę hydrolizatu wysuszyć i w to samo miejsce nanieść drugą kroplę hydrolizatu. Operację tę można powtórzyć kilkakrotnie.
Wyszukiwarka
Podobne podstrony:
Program cwiczen laboratoryjnych z chemii-stacjonarne, Semestr II, Chemia
Cwiczenie zabawowe, STUDIA, Polibuda - semestr II, Hydraulika i hydrologia, laborki z hydro
chemia 10, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
OksydymetriaMaterialy, STUDIA, II SEMESTR, chemia, 3 kolokwium
CHEMIA-cwiczenie-4, Budownictwo, Inżynierka, Budownictwo, Semestr 1-2, Chemia, CHEMIA, Chemia ćwicze
pyt. 15, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
Ćwiczenie nr 9, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwicze
Teoria do ćwiczeń laboratoryjnych, UTP Elektrotechnika, 2 semestr, Teoria obwodów, Laborki
6b, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
chemia wyklady2ok, Studia, Mibm, semestr I, Chemia Ogólna
sprawozdanie-chromatografia, ochrona środowiska UJ, IV semestr, chemia ograniczna, sprawozdania
test (1), Studia Zip, Semestr 2, Informatyka-Bazy danych
CHROMAT. GAZOWA, Politechnika Białostocka - Ekoenergetyka, semestr I, Chemia, sprawozdania, Chromato
10.2, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
pyt. 15, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egzamin
Zagadnienie1, Inżynieria Środowiska Politechnika Krakowska studia I stopnia, I semestr, Chemia, egza
Sprawozdanie z ćwiczenia nr 4, Studia, AAAASEMIII, 3. semestr, Elektrotechnika II, Pack, Pack
więcej podobnych podstron