Co to jest związek chemiczny?
Jednorodne połączenie co najmniej dwóch różnych pierwiastków chemicznych za pomocą dowolnego wiązania. Podstawową jednostką związku chemicznego jest cząsteczka. Cząsteczki powstają i rozpadają się w wyniku tworzenia i zrywania wiązań chemicznych między atomami.
Co to jest równanie chemiczne? Podaj dwa przykłady.
Równanie chemiczne to inaczej zapis przebiegu reakcji chemicznej. W równaniu chemicznym po jego lewej stronie znajdują się wzory chemiczne substratów, czyli związków chemicznych wchodzących do reakcji, a po jego prawej stronie znajdują się wzory powstałych z nich produktów. Równania chemiczne mogą mieć charakter stechiometryczny lub tylko charakter ogólny.
2Fe + 6HCl → 2FeCl3 + 3H2
Reakcja egzotermiczna
Reakcja egzotermiczna to reakcja chemiczna, która ma dodatni bilans wymiany ciepła z otoczeniem, czyli jest to reakcja, w której ciepło znajduje się po stronie produktów.
Reakcja endotermiczna
Reakcja endotermiczna to reakcja chemiczna, która posiada ujemny bilans wymiany ciepła z otoczeniem, czyli jest to reakcja, w której ciepło znajduje się po stronie substratów.
Mechanizm tworzenia się związku chemicznego. Podać odpowiednie przykłady
Związki chemiczne są tworzone przez atomy, łączą się w ścisłych proporcjach poprzez wiązania chemiczne. Najmniejszą porcją związku chemicznego jest cząsteczka. Cząsteczki mogą więc ulegać przemianom tylko na skutek pękania i/lub powstawania wiązań. To co powstaje nosi nazwę cząsteczki lub jonu.
Powstawanie kwasu siarkowego(IV) SO2 + H2O → H2SO3
Otrzymywanie kwas azotowego(V) N2O5 + H2O → 2HNO3
Jak powstaje wiązanie jonowe? Wyjaśnij podając odpowiedni przykład.
Wiązanie jonowe polega na przyciąganiu elektrostatycznym różnoimiennie naładowanych jonów. Związki jonowe w stałym stanie skupienia tworzą sieć krystaliczną, w której nie ma cząsteczek.
Wiązania jonowe są wiązaniami mocnymi. Powstają pomiędzy pierwiastkami, w których różnica elektroujemności jest większa od 1,7 (wg skali Paulinga),
np.: chlorek sodu - Na Cl
Na - 1e --> Na+
Cl + 1e --> Cl -
Każdy jon sodu jest otoczony sześcioma jonami chlorkowymi, a każdy jon chlorkowy sześcioma jonami sodowymi.
Nie można rozróżnić, który kation sodu do którego anionu chlorkowego należy, podobnie jak nie da się określić, który anion chlorkowy należy do którego kationu sodu. Cały kryształ traktuje się więc jako jedną makrocząsteczkę.
Jak powstaje wiązanie kowalencyjne? Wyjaśnij podając odpowiedni przykład.
Wiązania kowalencyjne (atomowe) powstają, gdy łączą się z sobą atomy pierwiastków zaliczanych do niemetali. Mechanizm tworzenia wiązania kowalencyjnego, podobnie jak i w wiązaniu jonowym tłumaczy się dążeniem atomów do przyjęcia konfiguracji najbliższego gazu szlachetnego (reguła dubletu, oktetu). Skompletowanie oktetów (dubletu) w wiązaniu atomowym następuje poprzez uwspólnienie par elektronowych.. Przykładem jest cząsteczka wodoru, w której dublet jest osiągany poprzez uwspólnienie dwóch elektronów pochodzących od dwóch atomów wodoru.
Mechanizm powstawania wiązania kowalencyjnego w cząsteczce chloru.
Co to jest wiązanie spolaryzowane? Wyjaśnij podając odpowiedni przykład.
Wiązanie atomowe spolaryzowane jest wiązaniem pośrednim między jonowym a atomowym i powstaje wówczas, gdy łączą się ze sobą atomy pierwiastków różniących się rozmiarami i ilością powłok, lecz nie tak znacznie jak w przypadku tworzenia wiązania jonowego.
Mechanizm powstawania wiązania kowalencyjnego spolaryzowanego w cząsteczce chlorowodoru.
Wspólna para elektronowa w cząsteczce H--Cl jest silniej przyciągana przez atom chloru (ma w jądrze 17 protonów) niż przez atom wodoru (ma w jądrze 1 proton), jest więc przesunięta w kierunku atomu chloru. Dlatego przy symbolu pierwiastka chloru mamy znak ( - ) (minus) a przy symbolu pierwiastka wodoru znak ( + ) ( plus).
Co to jest wiązanie metaliczne?
Wiązanie metaliczne jest to wiązanie pomiędzy tworzącymi sieć krystaliczną kationami metali i ich elektronami, które zajmują orbitale powłok walencyjnych wszystkich tworzących sieć atomów. Takie elektrony nazywa się zdelokalizowanymi. Metal jako całość jest elektrycznie obojętny. Obecność swobodnych elektronów w metalach powoduje ich wysokie przewodnictwo elektryczne i cieplne oraz wiele innych charakterystycznych właściwości.
Charakterystyczne właściwości substancji o budowie jonowej?
w stanie stałym tworzą sieć krystaliczną jonową,
ich kryształy nie przewodzą prądu elektrycznego,
posiadają wysoką temperaturą topnienie i wrzenia,
rozpuszczone w wodzie jak i wstanie stopionym przewodzą prąd elektryczny,
w obecności wody ulegają dysocjacji elektrolitycznej.
Wpływ rodzaju wiązania na właściwości związku chemicznego.
Rodzaje wiązań chemicznych występujące w związkach chemicznych mają decydujący wpływ na właściwości tych związków.
*Wiązanie kowalencyjne
W stałym stanie skupienia tworzą kryształy cząsteczkowe, takie jak : SiH4 . Substancje te na ogół nie przewodzą prądu elektrycznego ( wyjątek - grafit) i nie ulegają dysocjacji elektrolitycznej. Słabo rozpuszczają się w wodzie i alkoholu, natomiast dobrze w benzynie czy benzenie. Reagują powoli. Im większy jest udział wiązania kowalencyjnego w tlenkach, tym bardziej kwasowy jest jego charakter.
*Wiązanie jonowe.
Związki jonowe są substancjami krystalicznymi, twardymi, mają wysoką temperaturę topnienia , dobrze rozpuszczają się w wodzie. Kryształy jonowe nie przewodzą prądu elektrycznego, ale stopione i rozpuszczone w wodzie sole są dobrymi przewodnikami elektryczności. W roztworze związki te ulegają procesowi dysocjacji. Im większy jest udział wiązania jonowego w związku - tlenku, czy wodorotlenku tym bardziej zasadowy jest związek.
*Wiązanie metaliczne
Substancje mające wiązanie metaliczne to metale. Charakteryzują się one połyskiem i bardzo dobrym przewodnictwem elektrycznym i cieplnym. Są kowalne, ciągliwe można je obrabiać mechanicznie. Nie roztwarzają się w wodzie , chociaż niektóre z nich gwałtownie z nią reagują - sód. Mają wysokie temperatury topnienia, poza takimi
pierwiastkami , jak: rtęć, gal, ind, grupa litowców.
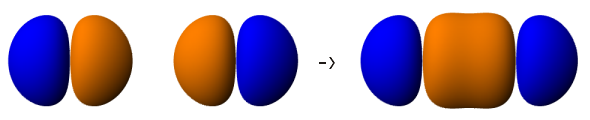
Jak powstaje wiązanie typu sigma? Podaj przykład
Powstaje w wyniku nakładania czołowego orbitali atomowych. Kształt wiązania σ wyznacza orbital molekularny σ.
Schemat powstawania orbitalu wiążącego σp-p.
Jak powstaje wiązanie typu pi? Podaj przykład
Powstaje w wyniku nakładania bocznego orbitali atomowych (oprócz s). Kształt tego wiązania wyznacza orbital molekularny π.
Schemat powstawania wiążącego orbitalu πp-p
Co to są wolne pary elektronowe? W jaki sposób wpływają one na budowę cząsteczki związku chemicznego?
Wolne pary elektronowe są to elektrony z powłoki walencyjnej, nie biorące udziału w wiązaniu. Cząsteczki dążą do uzyskania jak największej symetrii. Nie tylko atomy, ale także często niezauważane wolne pary elektronowe należy brać pod uwagę przy opisie symetrii. Oto przykłady najprostszych symetrii:
Przykładem liniowej cząsteczki (kąty 180°) jest ditlenek węgla(IV):
Zaś tetraedryczne cząsteczki (kąty 109°28′) to np. metan, czy woda.
Właśnie w wodzie często nie dostrzegamy wolnych par elektronowych tlenu, a to one powodują, że cząsteczka nie jest liniowa, tylko kątowa.
Jaki jest kształt chmur elektronowych dla par elektronowych sigma, pi oraz n?
Podaj przykłady cząsteczek z wiązaniami pi.
Azot - 1 wiązanie typu sigma i 2 wiązania typu pi.
Etyn - 1 wiązanie typu sigma i 2 wiązania typu pi.
Wyjaśnij budowę cząsteczki wody, zrób odpowiedni rysunek.
W cząsteczce wody następuje przesunięcie elektronów w stronę atomu tlenu. Powoduje to, że atom tlenu ma pewien ładunek ujemny, a atomy wodoru odpowiadający mu ładunek dodatni. Ujemny ładunek atomu tlenu przyciąga dodatnio naładowane atomy wodoru sąsiedniej cząsteczki i pomiędzy nimi powstaje tak zwane wiązanie wodorowe. Mówimy, że cząstka wody jest polarna, czyli tworzy dipol.
Wyjaśnij budowę cząsteczki dwutlenku węgla, zrób odpowiedni rysunek.
Cząsteczka dwutlenku węgla ma budowę liniową, atom węgla znajduje się w niej pomiędzy oboma atomami tlenu. Długość wiązania C - O, wynosi 116 pm. Układ krystalograficzny jak kwarc, moment dipolowy 0 D.
Co to znaczy, że cząsteczka wody jest dipolem?
Tak jak zwykły magnes posiada bieguny północny i południowy, tak molekuła wody ma dodatni i ujemny biegun i jest przez to elektrycznym dipolem
Przedstaw na odpowiednim wykresie zmiany energetyczne podczas nakładania się orbitali atomowych.
Nakładanie się orbitali atomowych powoduje zwiększenie gęstości chmury elektronowej pomiędzy jądrami atomowymi
Co to jest wiązanie wodorowe. Podaj odpowiedni przykład.
Wiązanie wodorowe to rodzaj stosunkowo słabego wiązania chemicznego polegającego głównie na przyciąganiu elektrostatycznym między atomem wodoru i atomem elektroujemnym zawierającym wolne pary elektronowe. Klasyczne wiązanie wodorowe powstaje, gdy atom wodoru jest połączony wiązaniem kowalencyjnym z innym atomem o dużej elektroujemności (np. tlenem) i w ten sposób uzyskuje nadmiar ładunku dodatniego. W wyniku tego oddziaływania pierwotne, kowalencyjne wiązanie wodór - inny atom ulega częściowemu osłabieniu, powstaje zaś nowe, stosunkowo słabe wiązanie między wodorem i innym atomem (akceptorem wiązania wodorowego).
Wiązanie wodorowe między cząsteczkami wody.
Jakie są właściwości substancji, w których występują wiązania wodorowe?
Mimo, że wiązanie wodorowe jest około 10 razy słabsze od wiązania kowalencyjnego, wywiera istotny wpływ na właściwości związku. Duże znaczenie ma zwłaszcza dla układów biologicznych. Jest głównym czynnikiem utrwalania informacji genetycznej w cząsteczkach DNA. Prowadzi do łączenia się w większe zespoły cząsteczek, co powoduje znaczną zmianę ich właściwości, takich jak rozpuszczalność, gęstość, temp. wrzenia, czy topienia.
Opierając się na przykładzie wody: zamarzając rozszerza się, ponieważ w krysztale lodu regularnie rozmieszczone wiązania wodorowe mają większą długość niż w cieczy. To sprawia, że gęstość lodu jest mniejsza niż wody i lód pływa po jej powierzchni. Przy ogrzewaniu wody pękają wiązania wodorowe i woda zmniejsza swoją gęstość.
Wyjaśnij budowę wiązania podwójnego między atomami węgla.
Atom węgla o hybrydyzacji sp2 dysponuje trzema orbitalami zhybrydyzowanymi, które leżą na jednej płaszczyźnie (XY), kąt pomiędzy nimi wynosi 120o. Czwarty orbital atomu węgla pozostaje niezhybrydyzowany i jest prostopadły do płaszczyzny w której leżą orbitale hybrydyzowane. Poprzez czołowe nakładanie się orbitali zhybrydyzowanych z innymi orbitalami zhybrydyzowanymi lub orbbitalem 1s atomu wodoru tworzy się wiązanie s. W wyniku zbliżenia się do siebie dwóch grup :CH2 wzdłuż osi 0X, ich orbitale zhybrydzyzowane nakładają się na siebie czołowo tworząc wiązanie s. Jednakże by atomy węgla posiadały oktet elektronów, orbitale p muszą się również na siebie nałożyć. Mogą nałożyć się jedynie bocznie, tworząc nowy typ wiązania, nazywany wiązaniem p.
Wiązanie podwójne to wiązanie σ i jedno wiązanie
Wyjaśnij budowę wiązania potrójnego pomiędzy atomami węgla.
Wiązanie potrójne może powstać tylko podczas gdy dwa sąsiednie atomy węgla znajdują się w liniowej hybrydyzacji sp. Wtedy to jedna hybryda węgla w cząsteczce acetylenu łączy się z orbitalem atomu wodoru (wiązanie kowalencyjne σsp-s), a druga analogicznym wiązaniem σsp-sp łączy się z drugą hybrydą, która oczywiście też łączy się z jednym atomem wodoru.W ww. sposób powstaje liniowy szkielet cząsteczki, jak to jednak bywa z hybrydyzacją sp pozostają jeszcze po dwa prostopadłe do osi wiązania orbitale p. Za ich pomocą zostaną utworzone dwa wiązania π pomiędzy atomami węgla.
Wyjaśnij budowę cząsteczki benzenu (stan aromatyczny).
- Budowa cząsteczki płaska
- Obecność w cząsteczce wiązania zdelokalizowanego zbudowanego z sześciu elektronów (sekstetu elektronowego), Tworzy ono chmurę elektronową nad i pod pierścieniem.
Jakie rodzaje oddziaływań mogą występować pomiędzy drobinami?
Do oddziaływań tych zalicza się (w kolejności od najsilniejszych do najsłabszych):
- oddziaływania jon-jon nazywane też efektem jojo
- oddziaływania trwały dipol - trwały dipol
- oddziaływania van der Waalsa
Należy również uwzględnić fakt, że dla małych odległości pomiędzy atomami czy cząsteczkami pojawia się oddziaływanie odpychające pomiędzy powłokami elektronowymi, wynikające z obowiązywania zakazu Pauliego.
Opisz siły wzajemnego oddziaływania między cząsteczkami tzw. siły van der Waalsa.
Siłami van der Waalsa nazywamy słabe oddziaływania krótkiego zasięgu między cząsteczkami niepolarnymi. Te oddziaływania są częściowo odpowiedzialne za stan skupienia materii. Występują np. między warstwami sieci krystalicznej grafitu. Przyczyną wystąpienia oddziaływania van der Waalsa są trwałe oraz wyindukowane momenty dipolowe w cząsteczkach lub chwilowe asymetrie rozkładu ładunku w cząsteczce lub atomie.
Oddziaływania dyspersyjne.
dyspersyjne oddziaływania - rodzaj oddziaływań międzycząsteczkowych, przyciąganie między chwilowymi multipolami (gł. dipolami) wzajemnie indukowanymi w obu oddziałujących cząsteczkach.
Oddziaływania indukcyjne.
Efekt indukcyjny - wpływ podstawnika (w cząsteczkach związków organicznych) - bardziej lub mniej elektroujemnego od wodoru na rozkład gęstości elektronowej w sąsiedztwie tego podstawnika lub nawet w całej cząsteczce.
Co to jest granica faz?
- obszar szczególny o swoistej strukturze, właściwościach fizycznych i chemicznych, na którym zachodzą szczególne zjawiska i procesy (adsorpcja, rozproszenie światła, efekt fotoelektryczny, heterogeniczna kataliza reakcji chemicznych).
Rozkład sił działających na cząsteczkę w głębi fazy i na granicy faz.
Atomy i cząsteczki na granicy faz mają energię większą niż atomy i cząsteczki we wnętrzu fazy (w fazie objętościowej) ponieważ siły międzycząsteczkowe działające na cząsteczkę będącą na granicy faz mają inny rozkład niż siły działające na cząsteczkę wewnątrz fazy (w fazie objętościowej). Na granicy faz siły te nie są „wysycone”.
Czym zajmuje się termodynamika?
Termodynamika zajmuje się badaniem przepływu ciepła pomiędzy ciałami i ich układami. Skąd się pojawia ciepło, jakie są jego postacie i jakim ulega przemianom - to tematy badań termodynamiki.
W jaki sposób można opisywać granicę faz?
a) Dokładny, metody termodynamiki, posługujące się parametrami i funkcjami charakteryzujące stan energetyczny układu, którym jest granica faz.
b) Opis molekularny, biorący pod uwagę właściwości fizyczne i chemiczne atomów i cząsteczek przejawiające się ich wzajemnym oddziaływaniem, aby lepiej poznać strukturę i właściwości granicy faz (modele - zwykle uproszczone).
Jakie podstawowe wielkości opisują stan termodynamiczny granicy faz?
- powierzchnia A [m2],
- energia powierzchniowa (napięcie powierzchniowe) σ [J/m2]
- potencjał elektryczny [V]
- gęstość ładunku powierzchniowego q
- stężenie powierzchniowe = ni / A [mol/m2]
Co to jest napięcie powierzchniowe i międzyfazowe?
Napięcie powierzchniowe - zjawisko fizyczne występujące na styku powierzchni cieczy z ciałem stałym, gazowym lub inną cieczą. Polega na powstawaniu dodatkowych sił działających na powierzchnię cieczy w sposób kurczący ją. Zjawisko to ma swoje źródło w siłach przyciągania pomiędzy molekułami cieczy. Występuje ono zawsze na granicy faz termodynamicznych, dlatego zwane jest też napięciem międzyfazowym.
Na czym polega proces adsorpcji ?
Adsorpcja polega na samorzutnym gromadzeniu się cząsteczek na powierzchni granicy faz. Proces adsorpcji prowadzi do obniżenia energii powierzchniowej wyrażającej się zmianą napięcia powierzchniowego lub międzyfazowego.
Co to jest izoterma adsorpcji?
Izoterma adsorpcji to związek ilości zaadsorbowanej substancji i stężenia lub ciśnienia adsorbatu przy ustalonej temperaturze.
Co to są substancje powierzchniowo czynne?
Substancje powierzchniowo czynne (surfaktatnty), to każde związki chemiczne, które posiadają zdolność do obniżania napięcia powierzchniowego cieczy, ułatwiając tym samym zdolność zwilżania powierzchni ciał stałych przez te ciecze, a także umożliwiające zmieszanie dwóch cieczy, które naturalnie tworzą dwie niemieszalne fazy (np: woda i olej).
Klasyfikacja substancji powierzchniowo czynnych
Środki powierzchniowo czynne można podzielić na grupy w zależności od ich zastosowania:
- emulgatory - dodatki utrwalające emulsje
- środki zwilżające
- środki pianotwórcze - dodatki utrwalające pianę
- detergenty - środki czyszczące
Substancje powierzchniowo czynne mogą być anionowe, kationowe lub niejonowe.
Na czym polega zjawisko micelizacji ?
Micelizacja - proces polegający na rozdrobnieniu substancji rozpuszczalnych jedynie w tłuszczach do postaci łatwo przyswajalnej przez środowisko wodne organizmu.
Jak zbudowane są micele i jakie są właściwości roztworów micelarnych?
Micele to kuliste twory wytworzone z oleju, wody i stabilizowane obecnością zawiązku powierzchniowo czynnego.
Właściwości - mają szerokie zastosowanie w kosmetyce (skutecznie usuwają makijaż)
Budowa cząsteczki substancji powierzchniowo czynnej
Cząsteczki substancji powierzchniowo czynnej mają kształt kijanek. Zwykle "główka" takiej "kijanki" łączy się z wodą, podczas gdy "ogonek" z cząsteczkami brudu. Gdy wymieszamy taki środek z wodą, to na jej powierzchni "kijanki" skierują się "główkami" do wewnątrz cieczy. "Ogonki" cząsteczek substancji powierzchniowo czynnej sterczą natomiast na zewnątrz, wystając poza powierzchnię wody.
Właściwości roztworów substancji powierzchniowo czynnych
Obniżają napięcie powierzchniowe wody, ułatwiają zwilżalność. Ponadto umożliwiają mieszanie dwóch niemieszających się ze sobą cieczy, np. wody i oleju, w wyniku czego powstaje emulsja
Właściwości pianotwórcze związków powierzchniowo czynnych
Ważną rolę spełniają substancje powierzchniowo czynne w tworzeniu i utrwalaniu pian. Wywierają wpływ na trwałość piany poprzez adsorpcję na powierzchni pęcherzyków.
Stabilizacja emulsji
Stabilizacja emulsji - polega na zwiększeniu hydratacji powierzchni kropelek emulsji, co może być wywołane albo przez nadanie powierzchni kropelek ładunku elektrycznego, albo też przez pojawienie się na powierzchni grup hydrofilowych.
Co to jest EWP ?
Wyszukiwarka
Podobne podstrony:
Opracowane Pytania Na Oczyszczalnie Scieków, Studia
opracowane pytania na ASK@, Edukacja, studia, Semestr IV, Architektura Systemów Komputerowych, Oprac
CHEMIA - EGZAMIN - opracowane pytania na egzamin - wersja 1, STUDIA
Budownictwo - pomoc, Studia Budownictwo Zielona Góra Uz, Semestr 2, budownictwo(1), Egzam Budownictw
1.Rodzaje i geneza gruntów budowlanych, Opracowane pytania na egzamin
Opracowane pytania na egzamin z TWN u
opracowane pytania na egzamin
opracowane pytania na egzamin, Zootechnika SGGW, semestr VI, rozród
opracowane pytania na egzamin, 1
Opracowane pytania na egzamin z fizy
4. Ruch wody w gruncie, Opracowane pytania na egzamin
Opracowane pytania na egzamin cz 2
opracowane pytania na egzamin2, Zootechnika SGGW, semestr VI, rozród
chemia, ywno ci pytania na egzamin www.przeklej.pl, Chemia Żywności – pytania na egzamin
socjologia opracowane pytania na egzamin
satelitarna opracowanie, PYTANIA NA EGZAMIN Z GEODEZJI SATELITARNEJ
BOiKD semestr IV opracowane pytania na egzamin
Pytania na egz z wyt, Studia i nauka, Sprawozdania i notatki, Wytrzymałość materiałów, egzaminy
więcej podobnych podstron