Wydział Metali Nieżelaznych Kraków dn. 16.12.2002r.
Inżynieria Materiałowa
Rok II; grupa I
SPRAWOZDANIE Z ZAJĘĆ LABORATORYJNYCH Z CHEMII FIZYCZNEJ
Temat: KINETYKA KWASOWEGO ROZTWARZANIA METALI
- INHIBITORY
Zespół nr 6: Markowicz Jacek
Wstęp:
Stal węglowa w zetknięciu z rozcieńczonymi kwasami roztwarza się. Proces ten opisuje równanie , będące sumą elementarnych reakcji elektrodowych:
reakcja anodowa: Fe Fe2+ + 2e
reakcja katodowa: 2H+ + 2e H2
reakcja sumaryczna: Fe + 2H+ Fe2+ + H2
Proces korozji może przebiegać bez zahamowań , jeżeli jony żelazawe tworzą
z obecnymi w roztworze anionami dobrze rozpuszczalne sole. Dzieje się tak w przypadku reakcji z kwasami: solnym, azotowym, siarkowym itp. Wytrącenie się na powierzchni metalu trudno rozpuszczalnych produktów korozji powoduje zwolnienie a nawet zatrzymanie procesu (np. kwas fosforowy, węglowy). W przypadku oddziaływania stężonymi kwasami utleniającymi stal , np. stężonym kwasem azotowym w wyniku reakcji na powierzchni metalu powstaje cienka warstewka tlenkowa uniemożliwiająca dalszą korozje (pasywacja metalu).
Inhibitory są to związki organiczne , które po dodaniu (nawet w niewielkich ilościach) do rozcieńczonych roztworów kwasów, mogą powodować zmniejszenie szybkości reakcji. Mechanizm działania inhibitorów tłumaczy się ich adsorbcją na powierzchni metalu, co zmniejsza ilość miejsc w których może zajść korozja , tym samym zmniejsza się więc polaryzacja. Inhibitorami kwasowego trawienia metali są zazwyczaj związki o polarnej budowie cząsteczki , łatwo adsorbowane na powierzchni metalu. Należy podkreślić że ten sam inhibitor może w różnym stopniu hamować reakcję, zależnie od rodzaju kwasu . Wiąże się to z aktywnym działaniem anionów w procesach adsorbcyjnych metalu.
Cel ćwiczenia:
Celem ćwiczenia jest ustalenie wpływu stężenia tiomocznika na szybkość korozji stali w 10% kwasie siarkowym. Stężenia tiomocznika to: 0,001 g/l ; 0,01 g/l ; 0,1 g/l .
Opracowanie wyników:
Temperatura w laboratorium: 19,2 °C
Ciśnienie w laboratorium: 744 mmHg
Dla każdej biurety 10cm = 8,6 ml, czyli: 1ml = 11,6mm
p H2O / H 2S04 = 16,8 mmHg
d H2S04 = 1,07 [g/cm3]
Powierzchnie płytek:
I - 1807 mm2
II - 1896 mm2
III - 1879 mm2
IV - 1823 mm2
Ubytek masy płytek:
I - 0,0746g
II - 0,0358g
III - 0,0394g
IV - 0,01g
1. Korozja bez udziału inhibitora:
Czas |
Objętość gazu w biurecie V [ml] |
Wysokość słupa cieczy w biurecie h [cm] |
Ciśnienie wodoru PH2 [mm Hg] |
Ilość moli wydzielonego wodoru nH2 |
Masa przekorodowanego żelaza mFe [g] |
Masa przekorodowanego żelaza na jednostkę powierzchni K [g/cm2] |
|
zegarek |
Czas od rozpoczęcia pomiaru t [min] |
|
|
|
|
|
|
12:00 |
5 |
1,892 |
47,8 |
724,85 |
8,4464E-05 |
0,00237 |
0,0001309 |
12:05 |
10 |
3,698 |
45,7 |
722,6 |
0,00016509 |
0,00462 |
0,0002558 |
12:10 |
15 |
6,45 |
42,5 |
719,18 |
0,00028795 |
0,00806 |
0,0004462 |
12:15 |
20 |
8,772 |
39,8 |
716,29 |
0,00039161 |
0,01097 |
0,0006068 |
12:20 |
25 |
10,75 |
37,5 |
713,83 |
0,00047991 |
0,01344 |
0,0007436 |
12:25 |
30 |
12,47 |
35,5 |
711,69 |
0,0005567 |
0,01559 |
0,0008626 |
12:30 |
35 |
13,932 |
33,8 |
709,87 |
0,00062196 |
0,01742 |
0,0009638 |
12:35 |
40 |
15,308 |
32,2 |
708,15 |
0,00068339 |
0,01914 |
0,0010589 |
12:40 |
45 |
16,684 |
30,6 |
706,44 |
0,00074482 |
0,02086 |
0,0011541 |
12:45 |
50 |
17,888 |
29,2 |
704,94 |
0,00079857 |
0,02236 |
0,0012374 |
12:50 |
55 |
19,178 |
27,7 |
703,34 |
0,00085616 |
0,02397 |
0,0013266 |
12:55 |
60 |
19,952 |
26,8 |
702,38 |
0,00089071 |
0,02494 |
0,0013802 |
13:00 |
65 |
20,64 |
26 |
701,52 |
0,00092143 |
0,0258 |
0,0014278 |
13:05 |
70 |
22,274 |
24,1 |
699,49 |
0,00099438 |
0,02784 |
0,0015408 |
13:10 |
75 |
23,392 |
22,8 |
698,1 |
0,00104429 |
0,02924 |
0,0016182 |
13:15 |
80 |
24,338 |
21,7 |
696,92 |
0,00108652 |
0,03042 |
0,0016836 |
13:20 |
85 |
25,37 |
20,5 |
695,64 |
0,00113259 |
0,03171 |
0,001755 |
13:25 |
90 |
26,316 |
19,4 |
694,46 |
0,00117482 |
0,0329 |
0,0018204 |
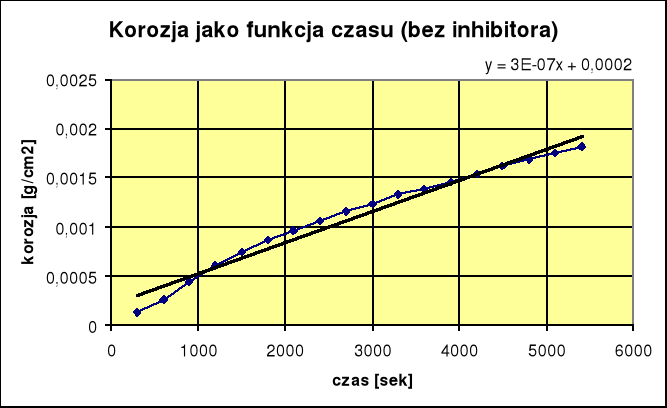
Wyliczanie gęstości prądu korozyjnego i:
ikor = ![]()
tg α -szybkość korozji;
M - masa atomowa Fe;
n - ilość moli wydzielonego wodoru;
F - stała Faradaya.
ikor = 6,07⋅ 10-7 [A/cm2]
Skuteczność rekcji (skuteczność działania inhibitora):
Skuteczność rekcji jest procentowym różnicy stosunkiem szybkości korozji bez inhibitora i szybkością danej korozji do szybkości danej korozji.
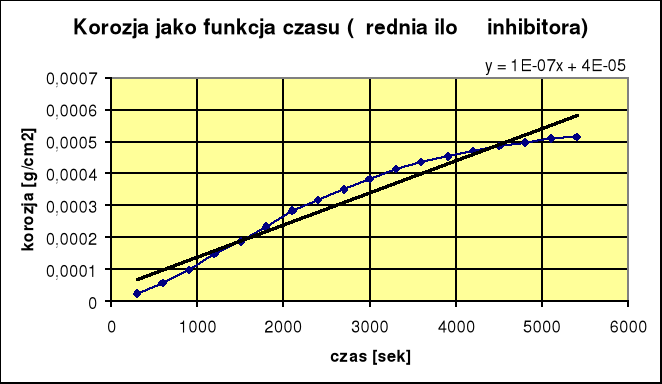
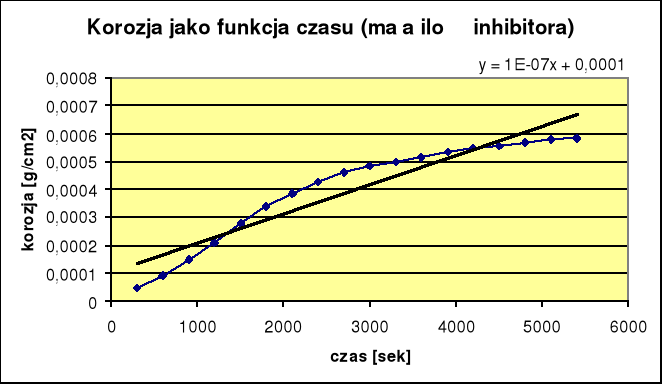
2. Korozja z małą ilością inhibitora:
Czas |
Objętość gazu w biurecie V [ml] |
Wysokość słupa cieczy w biurecie h [cm] |
Ciśnienie wodoru PH2 [mm Hg] |
Ilość moli wydzielonego wodoru nH2 |
Masa przekorodowanego żelaza mFe [g] |
Masa przekorodowanego żelaza na jednostkę powierzchni K [g/cm2] |
|
Zegarek |
Czas od rozpoczęcia pomiaru t [min] |
|
|
|
|
|
|
12:28 |
5 |
0,68 |
49,2 |
726,344 |
3,07143E-05 |
0,00086 |
4,5359E-05 |
12:33 |
10 |
1,37 |
48,4 |
725,488 |
6,14286E-05 |
0,00172 |
9,0717E-05 |
12:38 |
15 |
2,23 |
47,4 |
724,418 |
9,98214E-05 |
0,0028 |
0,00014742 |
12:43 |
20 |
3,18 |
46,3 |
723,241 |
0,000142054 |
0,00398 |
0,00020978 |
12:48 |
25 |
4,21 |
45,1 |
721,957 |
0,000188125 |
0,00527 |
0,00027782 |
12:53 |
30 |
5,16 |
44 |
720,78 |
0,000230357 |
0,00645 |
0,00034019 |
12:58 |
35 |
5,84 |
43,2 |
719,924 |
0,000261071 |
0,00731 |
0,00038555 |
13:03 |
40 |
6,45 |
42,5 |
719,175 |
0,000287946 |
0,00806 |
0,00042524 |
13:08 |
45 |
6,96 |
41,9 |
718,533 |
0,000310982 |
0,00871 |
0,00045926 |
13:13 |
50 |
7,31 |
41,5 |
718,105 |
0,000326339 |
0,00914 |
0,00048194 |
13:18 |
55 |
7,56 |
41,2 |
717,784 |
0,000337857 |
0,00946 |
0,00049895 |
13:23 |
60 |
7,82 |
40,9 |
717,463 |
0,000349375 |
0,00978 |
0,00051595 |
13:28 |
65 |
8,08 |
40,6 |
717,142 |
0,000360893 |
0,01011 |
0,00053296 |
13:33 |
70 |
8,34 |
40,3 |
716,821 |
0,000372411 |
0,01043 |
0,00054997 |
13:38 |
75 |
8,42 |
40,2 |
716,714 |
0,00037625 |
0,01054 |
0,00055564 |
13:43 |
80 |
8,60 |
40 |
716,5 |
0,000383929 |
0,01075 |
0,00056698 |
13:48 |
85 |
8,77 |
39,8 |
716,286 |
0,000391607 |
0,01097 |
0,00057832 |
13:53 |
90 |
8,85 |
39,7 |
716,179 |
0,000395446 |
0,01107 |
0,00058399 |
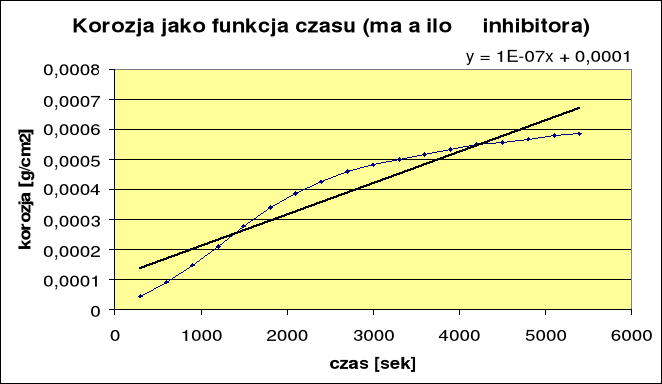
ikor = 6,8⋅10-8 Skuteczność reakcji wynosi 66,6%
3.Korozja ze średnią ilością inhibitora:
Czas |
Objętość gazu w biurecie V [ml] |
Wysokość słupa cieczy w biurecie h [cm] |
Ciśnienie wodoru PH2 [mm Hg] |
Ilość moli wydzielonego wodoru nH2 |
Masa przekorodowanego żelaza mFe [g] |
Masa przekorodowanego żelaza na jednostkę powierzchni K [g/cm2] |
|
zegarek |
Czas od rozpoczęcia pomiaru t [min] |
|
|
|
|
|
|
13:25 |
5 |
0,34 |
49,6 |
726,772 |
1,5179E-05 |
0,00042 |
2,2618E-05 |
13:40 |
10 |
0,85 |
49 |
726,13 |
3,7946E-05 |
0,00106 |
5,6546E-05 |
13:45 |
15 |
1,445 |
48,3 |
725,381 |
6,4509E-05 |
0,00181 |
9,6128E-05 |
13:50 |
20 |
2,21 |
47,4 |
724,418 |
9,8661E-05 |
0,00276 |
0,00014702 |
13:55 |
25 |
2,805 |
46,7 |
723,669 |
0,00012522 |
0,00351 |
0,0001866 |
14:00 |
30 |
3,485 |
45,9 |
722,813 |
0,00015558 |
0,00436 |
0,00023184 |
14:05 |
35 |
4,25 |
45 |
721,85 |
0,00018973 |
0,00531 |
0,00028273 |
14:10 |
40 |
4,76 |
44,4 |
721,208 |
0,0002125 |
0,00595 |
0,00031666 |
14:15 |
45 |
5,27 |
43,8 |
720,566 |
0,00023527 |
0,00659 |
0,00035059 |
14:20 |
50 |
5,78 |
43,2 |
719,924 |
0,00025804 |
0,00723 |
0,00038451 |
14:25 |
55 |
6,205 |
42,7 |
719,389 |
0,00027701 |
0,00776 |
0,00041279 |
14:30 |
60 |
6,545 |
42,3 |
718,961 |
0,00029219 |
0,00818 |
0,0004354 |
14:35 |
65 |
6,8 |
42 |
718,64 |
0,00030357 |
0,0085 |
0,00045237 |
14:40 |
70 |
7,055 |
41,7 |
718,319 |
0,00031496 |
0,00882 |
0,00046933 |
14:45 |
75 |
7,31 |
41,4 |
717,998 |
0,00032634 |
0,00914 |
0,0004863 |
14:50 |
80 |
7,48 |
41,2 |
717,784 |
0,00033393 |
0,00935 |
0,00049761 |
14:55 |
85 |
7,65 |
41 |
717,57 |
0,00034152 |
0,00956 |
0,00050891 |
15:00 |
90 |
7,735 |
40,9 |
717,463 |
0,00034531 |
0,00967 |
0,00051457 |
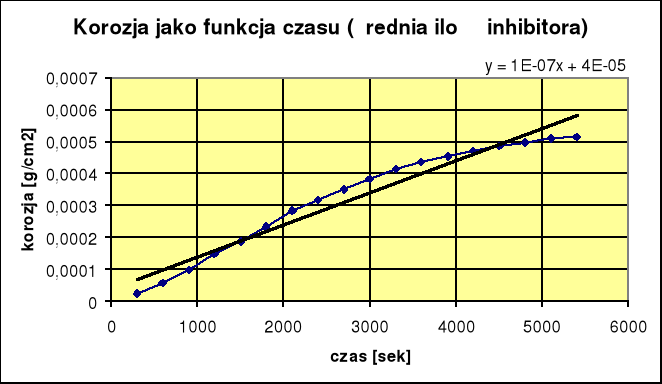
ikor = 5,95⋅10-8 Skuteczność reakcji wynosi 66,6%
4.Tabelka dla przypadku z dużą ilością inhibitora:
Czas |
Objętość gazu w biurecie V [ml] |
Wysokość słupa cieczy w biurecie h [cm] |
Ciśnienie wodoru PH2 [mm Hg] |
Ilość moli wydzielonego wodoru nH2 |
Masa przekorodowanego żelaza mFe [g] |
Masa przekorodowanego żelaza na jednostkę powierzchni K [g/cm2] |
|
zegarek |
Czas od rozpoczęcia pomiaru t [min] |
|
|
|
|
|
|
13:49 |
5 |
0,783 |
49,1 |
726,237 |
3,4955E-05 |
0,0009787 |
5,369E-05 |
13:54 |
10 |
0,783 |
49,1 |
726,237 |
3,4955E-05 |
0,0009787 |
5,369E-05 |
13:59 |
15 |
0,87 |
49 |
726,13 |
3,8839E-05 |
0,0010875 |
5,965E-05 |
14:04 |
20 |
0,87 |
49 |
726,13 |
3,8839E-05 |
0,0010875 |
5,965E-05 |
14:09 |
25 |
0,957 |
48,9 |
726,023 |
4,2723E-05 |
0,0011963 |
6,562E-05 |
14:14 |
30 |
0,957 |
48,9 |
726,023 |
4,2723E-05 |
0,0011963 |
6,562E-05 |
14:19 |
35 |
0,957 |
48,9 |
726,023 |
4,2723E-05 |
0,0011963 |
6,562E-05 |
14:24 |
40 |
0,957 |
48,9 |
726,023 |
4,2723E-05 |
0,0011963 |
6,562E-05 |
14:29 |
45 |
1,044 |
48,8 |
725,916 |
4,6607E-05 |
0,001305 |
7,159E-05 |
14:34 |
50 |
1,044 |
48,8 |
725,916 |
4,6607E-05 |
0,001305 |
7,159E-05 |
14:39 |
55 |
1,044 |
48,8 |
725,916 |
4,6607E-05 |
0,001305 |
7,159E-05 |
14:44 |
60 |
1,044 |
48,8 |
725,916 |
4,6607E-05 |
0,001305 |
7,159E-05 |
14:49 |
65 |
1,044 |
48,8 |
725,916 |
4,6607E-05 |
0,001305 |
7,159E-05 |
14:54 |
70 |
1,044 |
48,8 |
725,916 |
4,6607E-05 |
0,001305 |
7,159E-05 |
14:59 |
75 |
1,131 |
48,7 |
725,809 |
5,0491E-05 |
0,0014138 |
7,755E-05 |
15:04 |
80 |
1,131 |
48,7 |
725,809 |
5,0491E-05 |
0,0014138 |
7,755E-05 |
15:09 |
85 |
1,131 |
48,7 |
725,809 |
5,0491E-05 |
0,0014138 |
7,755E-05 |
15:14 |
90 |
1,131 |
48,7 |
725,809 |
5,0491E-05 |
0,0014138 |
7,755E-05 |
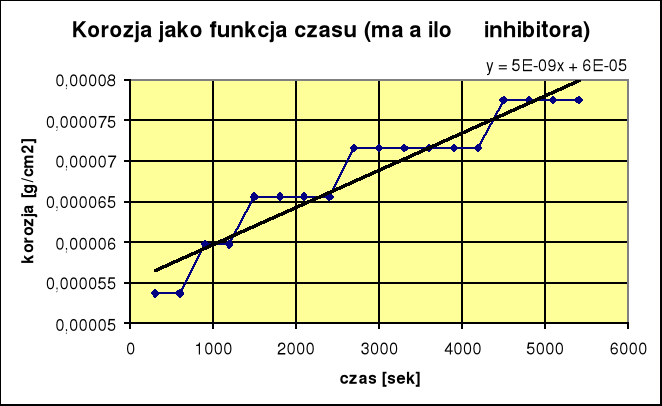
ikor = 4,35⋅10-10 Skuteczność reakcji wynosi 98,3%
Wnioski:
Przeprowadzone ćwiczenie pozwala stwierdzić że dodatek tiomocznika - inhibitora kwasowego trawienia żelaza, znacznie spowalnia korozję. Widzimy że szybkość korozji jest odwrotnie proporcjonalna do stężenia inhibitora. Niedokładny drugi pomiar najprawdopodobniej spowodowany jest pozostałością inhibitora w naczyniach jeszcze po poprzednim wykonywanym ćwiczeniu. Dla stężenia 0 g/l szybkość wynosiła 3⋅10-7 [g/cm2], dla 0,001 1⋅10-7 [g/cm2] , podobnie przy 0,01 [g/cm2], a przy 0,1 tylko 0,0000004 [g/cm2]. Skuteczności inhibitora wynosiła wówczas aż 98,3%.
Wyszukiwarka
Podobne podstrony:
614
614
I CSK 614 11 1
614
614
I ACa 614 11
di 614+ qig pl o73wgebqpeifdceje74ewhpzi3dssotir5372bq O73WGEBQPEIFDCEJE74EWHPZI3DSSOTIR5372BQ
I CSK 614-11-1
614
II CSK 614 09 1 id 209827 Nieznany
613 614
614 615
614
614
di 614+ instrukcja pl lhspp3py6fmbhtgvy3ih2sr62qhdfk767wv5ima LHSPP3PY6FMBHTGVY3IH2SR62QHDFK767WV5IM
614
614
więcej podobnych podstron