
Wydział Inżynierii i Technologii Chemicznej
Politechniki Krakowskiej
Instytut Chemii i Technologii Organicznej
Surowce i procesy technologii organicznej
Projekt syntezy wodoru w oparciu o konwersję metanu
z parą wodną
Justyna Trela
Renata Święch
Natalia Mastalerz
Katarzyna Gawęcka
1. Opis procesów otrzymywania gazu syntezowego, jego zastosowanie w syntezie chemicznej oraz analiza ekonomiczna rynku.
Metody otrzymywania gazu syntezowego.
Surowym gazem syntezowym nazywa się mieszaninę składającą się głównie z CO
i H2 oraz dwutlenku węgla. Gaz syntezowy można otrzymać praktycznie z każdego surowca zawierającego. W zależności od zastosowanej metody wytwarzania gazu syntezowego jego skład będzie różny tzn. stosunek H2/ CO może się zmieniać od około 1 do ponad 3. Dobór zastosowanej metody pozyskiwania gazu syntezowego podyktowany jest, oprócz względów ekonomicznych, wymaganym składem gazu syntezowego kierowanego do dalszej syntezy. Mieszaninę CO/ H2 głównie otrzymywano z koksu, węgla kamiennego lub brunatnego. Obecnie produkcję gazu syntezowego oparto na węglowodorach ciekłych i gazowych.
Gaz syntezowy można otrzymać w procesie gazyfikacji w którym zachodzą dwie reakcje docelowe :
2C + O2 =2 CO
C + H2O =CO + H2
Towarzyszą im reakcje uboczne :
Rekcja Bouduarda C + O2 = 2 CO
Reakcje konwersji CO + H2O = CO2 +H2
Reakcja metanizacji C + 2 H2 = CH4
Obecnie do zgazowania węgla na uwagę zasługują dwa procesy, a mianowicie proces Koppersa -Totzka oraz proces ciśnieniowy Lurgi.
Proces Koppersa - Totzka polega na bezciśnieniowej reakcji pyłu węglowego w temperaturze 1400 - 1600 ° C z mieszaniną O2 + H2 O. Proces ciśnieniowy przebiega w dwóch etapach. Najpierw kawałki węgla poddaje się przy stałym mieszaniu odgazowaniu w temperaturze 600 - 700° C i pod ciśnieniem 0,2 - 0,3 MPa a następnie przepuszcza się przez złoża od dołu strumień O2 i H2O w wyniku powstaje gaz syntezowy. Proces ten jest znacznie efektywniejszy od procesu Koppersa - Totzka. Obecnie najwięcej gazu syntezowego otrzymuje się z ropy naftowej a przede wszystkim z gazu synteowego.
W praktyce możliwie są dwa warianty procesu :
I. Reformowanie węglowodorów wyłącznie parą wodną z dostarczeniem ciepła z zewnątrz. Proces ICI
R- CH2 - + H2O = CO + 2H2
Rozszczepienie węglowodorów ( wcześniej odsiarczonych ) zachodzi w temperaturze 700 -830° C i pod ciśnieniem 1,5 - 4 MPa. Poniżej temperatury 830°C obok CO i H2 powstaje znaczna ilość niepożądanego w gazie syntezowym CH4. Dlatego produkty gazowe po wyjściu z reaktora rurowego są częściowo spalane w reaktorze rurowym wypełnionym katalizatorem niklowym, tak aby utworzona para wodna reagowała w temperaturze 1200° C z metanem, dając tlenek węgla i wodór :
CH4 + H2 = CO + 3 H2
II. Proces Shell
Substratami mogą być węglowodory począwszy od metanu do mazutu. Część z nic jest spalna za pomocą tlenu w reaktorze, bez katalizatora, pod ciśnieniem 3 -8 MPa.
w temp.1200 - 1500oC.
Coraz trudniejszy dostęp do ropy naftowej i gazu ziemnego a także wzrost ich cen powoduje, że technologie oparte na zgazowaniu węgla stają się ponownie atrakcyjne. Dowodem przemawiającym za dominacją węgla nad pozostałymi paliwami jest fakt, iż został on użyty w 85% spośród wszystkich instalacji zgazowania wybudowanych w ciągu ostatnich trzech latach. W latach 2008-2010 nastąpiło uruchomienie dodatkowych 10 instalacji, z czego w siedmiu paliwem będzie węgiel.
Zastosowanie gazu syntezowego w syntezie chemicznej.
Gaz syntezowy jest powszechnie stosowany w przemyśle chemicznym jako surowiec do wielu syntez chemicznych np. synteza metanolu, synteza amoniaku, synteza Fischera- -Tropscha, wydzielanie wodoru z gazu syntezowego - rys. 1.
Rys. 1 Zastosowanie gazu syntezowego w syntezach chemicznych.
Wybór technologii wytwarzania surowego gazu syntezowego zależy w równie istotny sposób od:
dostępności i proporcji cen podstawowych surowców energochemicznych,
dysponowania potrzebnymi procesami ich przeróbki,
stopnia przydatności otrzymywanego gazu, ocenianej z punktu widzenia zamierzonego kierunku jego wykorzystania .
Skład, a więc i przydatność surowego gazu syntezowego zależy bezpośrednio od technologii jego produkcji. Z kolei skład ten decyduje o sposobie i kosztach przygotowania z gazu surowego określonych mieszanin gazowych- surowców do różnych syntez (patrz rys.1).
W wyniku analizy techniczno-ekonomicznej wykonanej przed projektowaniem Zakładów Azotowych w Puławach i Włocławku zdecydowano np., że amoniak będzie w Polsce produkowany z importowanego z Rosji wysokometanowego gazu ziemnego, a nie krajowego węgla. Możliwe w innych warunkach lokalnych lub w przyszłości oparcie produkcji przemysłu azotowego na węglu, wiąże się z koniecznością wyboru procesu zgazowania najbardziej ekonomicznego i odpowiedniego technologicznie. W tym konkretnym przypadku procesu prowadzącego do wytwarzania gazu syntezowego przeznaczonego do produkcji amoniaku.
2. Dokładny opis procesu konwersji metanu z parą wodną do gazu syntezowego, stosowane katalizatory oraz warunki prowadzenia procesu.
Proces konwersji metanu z parą wodną prowadzący do otrzymania gazu syntezowego jest najczęściej stosowaną metodą jego produkcji. Gaz syntezowy jest niezbędny do syntezy amoniaku, jest też źródłem wodoru (ok. 80% światowej produkcji). Otrzymuje się go w procesie katalitycznej konwersji metanu z parą wodną w stosunku H2:CO - 3:1. Zachodzi endotermiczna reakcja:
CH4 + H2O ↔ CO + 3H2 ΔH = 206 kJ/mol
Surowcem jest najczęściej metan, ale może być również etan, propan lub butan. W trakcie procesu mieszanina substratów jest przepuszczana nad katalizatorem niklowym zawierającym promotory i osadzonym na nośniku (γ-Al2O3). Stosowane są również tlenki magnezu, toru, chromu i innych metali. Zastosowanie katalizatora jest konieczne, gdyż bez niego szybkość procesu nawet w wysokich temperaturach jest tak mała, że nie udaje się osiągnąć równowagi termodynamicznej. Stosując niklowy katalizator przemysłowy typu GIAP-3 w temperaturach 500-800 oC , osiąga się konwersję najbardziej zbliżoną do stanu równowagi. W temperaturze 700, 950 i 1050 oC, (stosunek pary wodnej do metanu 2:1 - 3:1) i po nagrzewaniu mieszaniny reakcyjnej przez 1 - 3 godz., konwersja metanu w warunkach statycznych wynosi odpowiednio 3, 70 i 83% w stosunku do konwersji w stanie równowagi.
Jako katalizator w tym procesie działa wyłącznie metaliczny nikiel, jego tlenki są nie aktywne. W przypadku utlenienia katalizatora należy go redukować wodorem w okresie 2-4 godz. w temperaturze 300-400 oC. Zatrucie katalizatorów niklowych powodowane jest związkami siarki, takimi jak siarkowodór jak również związkami organicznymi siarki (dwutlenek węgla, tlenosiarczek węgla, siarczki). W temperaturze procesu pod wpływem pary wodnej znaczna większość tych związków przechodzi w siarkowodór. Działając czystym wodorem w temperaturze 600 oC można prawie całkowicie zregenerować zatruty katalizator w czasie około 30-40 godz. Mniejsze prawdopodobieństwo zatrucia katalizatora siarką jest
w wyższych temperaturach.
W instalacjach przemysłowych proces konwersji metanu z parą wodną jest prowadzony w temperaturze 750-900 ºC i pod ciśnieniem 3-4 MP. Wymaga to zastosowania dużego nadmiaru pary np. objętościowo 4:1 w stosunku do metanu. Głównie ze względów ekonomicznych stosuje się zwiększone ciśnienie. Na stan równowagi nie wpływa ono korzystnie. Wzrost temperatury powoduje przesuniecie równowagi reakcji w prawo, natomiast wzrost ciśnienia wpływa niekorzystnie na położenie stanu równowagi, gdyż jest to reakcja ze wzrostem objętości. Od temperatury i stężeń reagentów zależy stopień przereagowania substratów. Im wyższa temperatura, tym większy stopień przereagowania oraz większa szybkość reakcji. Poprzez zwiększenie stosunku objętościowego substratów lub przez obniżenie ciśnienia, można przesunąć równowagę reakcji w prawo w niższych temperaturach. W temperaturze powyżej 900 ºC stosując dwukrotny nadmiar pary wodnej, można osiągnąć wysoki stopień przereagowania metanu. Stopień konwersji metanu rośnie wraz ze wzrostem temperatury. W temperaturze powyżej 1200 ºC metan ulega prawie całkowitej konwersji, nawet pod ciśnieniem 10 MPa. Ze wzrostem temperatury rośnie zatem wydajność tlenku węgla oraz wodoru.
W procesie konwersji metanu zachodzą również reakcje podoczne. Jedną z niech jest konwersja tlenku węgla z parą wodną:
CO + H2O ↔ CO2 + H2 ΔH = -42 kJ/mol
Podwyższenie temperatury powoduje przesuniecie równowagi reakcji w lewą stronę (reakcja egzotermiczna), a nadmiar pary wodnej przyspiesza tworzenie dwutlenku węgla.
W niewielkim stopniu mogą zachodzić również procesy dezaktywacji katalizatora poprzez powstawanie węgla w reakcjach:
CO +H2↔ C + H2O ΔH = -131 kJ/mol
2CO ↔C + CO2 ΔH = -173 kJ/mol
CH4↔ C + 2H2 ΔH = 75 kJ/mol
Sadza dezaktywuje katalizator, dlatego należy zapobiegać jej powstawaniu.
Na potrzeby syntezy organicznej uzyskuję się gaz syntezowy o mniejszej zawartości wodoru, mianowicie od 1:1 do 2-2, 3: 1, otrzymywany przez konwersję węglowodorów ciekłych : CnH2n+2 + nH2O ↔ n CO + (2n + 1)H2 n≥5
Istnieje możliwość dodania do pary wodnej dwutlenku węgla, wchodzącego również
w reakcję konwersji z węglowodorami. Reakcja ta przebiega jednak wolniej od konwersji metanu z parą wodną.
CH4 +CO2 ↔ 2CO + H2 ΔH = 247 kJ/mol
Jest to reakcja endotermiczna. W wysokiej temperaturze równowaga reakcji przesuwa się
w prawo.
Konwersja metanu z parą wodną zachodzi w instalacji, której surowcem jest odsiarczony gaz ziemny wysokometanowy. Zawartość siarki nie może przekraczać poziomu 0,5 mg/m3. Instalacja składa się z konwertera, w którym znajduje katalizator umieszczony
w pionowych rurach z żaroodpornej stali chromowej. Utylizacja ciepła ze spalania gazu ziemnego zachodzi w komorze połączonej bezpośrednio z konwerterem. Katalizator wraz
z mieszaniną metanu i przegrzanej pary wodnej przepływającej przez warstwę katalizatora ogrzewa się od ścianek rur reakcyjnych, znajdujących się w konwerterze. Rury te z kolei są ogrzewane palnikami znajdującymi się z stropie konwertera lub w jego ściankach bocznych. Gdy mieszanina reakcyjna osiągnie temperaturę 850-950 ºC, zachodzi endotermiczna reakcja konwersji metanu z parą wodną. Rury instalacji są wykonane z bardzo wytrzymałej i odpornej na wysokie temperatury stali stopowej, gdyż ścianki nagrzewają się do temp. ok. 1000 ºC. Skład gazów w rurach reakcyjnych nie jest jednakowy. Zwłaszcza w pierwszej części rury reakcyjnej, w górnej części warstwy katalizatora skład rzeczywisty jest daleki składowi równowagowemu. Skład mieszaniny reakcyjnej zbliża się do składu równowagowego
w końcowej części rury reakcyjnej.
3. Analiza termodynamiczna procesu konwersji metanu z parą wodną.
I. Określenie liczby reakcji liniowo niezależnych i propozycja modelu stechiometrycznego.
Macierz współczynników atomowych.
Występujące składniki: CH4, H2O, CO, CO2 i H2.
|
|
H |
O |
CH4 |
1 |
4 |
0 |
H2O |
0 |
2 |
1 |
CO |
1 |
0 |
1 |
CO2 |
1 |
0 |
2 |
H2 |
0 |
2 |
0 |
Macierze rzędu 3 są różne od 0,np.
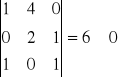
R= k- r
gdzie k- ilość związków, r - rząd wyznacznika
R = 5 - 3 = 2 liczba reakcji liniowo niezależnych
Proponowane reakcje:
1) CH4 + H2O = CO + 3 H2
2) CH4 + 2 H2O = CO2 + 4 H2
Macierz współczynników stechiometrycznych
|
CH4 |
H2O |
CO |
|
H2 |
1 |
-1 |
-1 |
1 |
0 |
3 |
2 |
-1 |
-2 |
0 |
1 |
4 |
Wszystkie macierze są różne od 0 co jest potwierdzeniem iż wybrane reakcje są względem siebie liniowo niezależne.
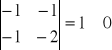
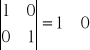
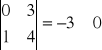
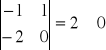
II. Obliczenie termodynamicznych ciśnieniowych stałych równowag dla reakcji modelu stechiometrycznego.
1) CH4 + H2O = CO + 3 H2
2) CH4 + 2 H2O = CO2 + 4 H2
Dane: T=1053K p=4,4MPa po=0,1013MPa
![]()
![]()
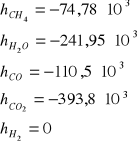
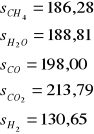
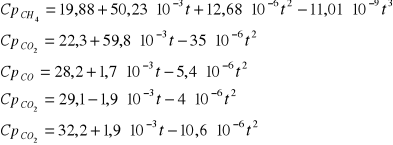
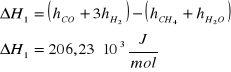
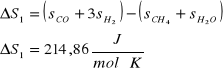
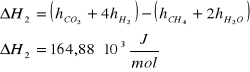
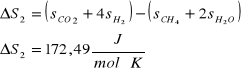
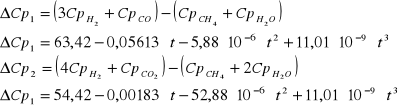
Reakcja 1
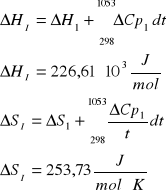
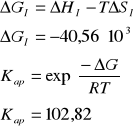
Reakcja 2
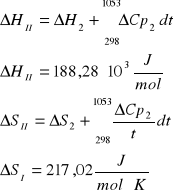
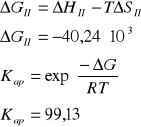
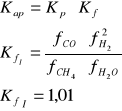
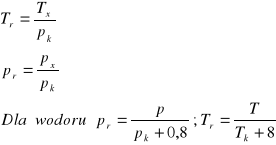
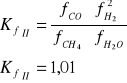
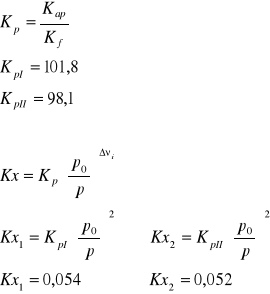
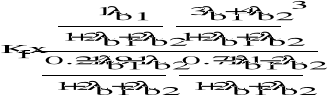
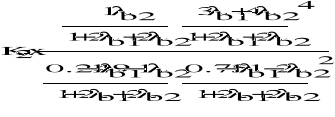
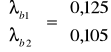
III. Obliczenie składu równowagowego dla zadanych warunków procesu.
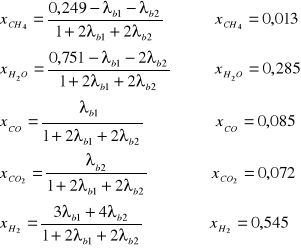
4. Bilans materiałowy procesu
I. Obliczenie przepływów masowych, masy i składu w procentach molowych wszystkich strumieni.
Strumień A
![]()
Strumień B
![]()
![]()
Stopień konwersji metanu: α = 80% = 0,8
Selektywność: SCO = 90% = 0,9
Reaktor I:
Masa CH4 : ![]()
![]()
1) CH4 + H2O = CO + 3 H2
Masa CH4 w reakcji 1) : ![]()
![]()
2) CH4 + 2 H2O = CO2 + 4 H2
Masa CH4 w reakcji 2) : ![]()
![]()
Strumień C
![]()
kg/h
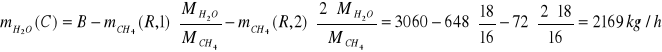
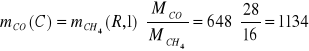
![]()
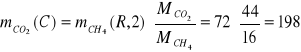
![]()
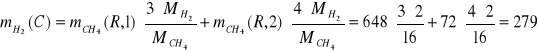
![]()
![]()
![]()
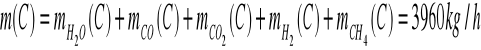
Ułamki masowe.
![]()
![]()
![]()
![]()
![]()
Ułamki molowe.





Składnik |
Masa |
Ułamek masowy |
Ułamek molowy |
H2O |
2169 |
0,548 |
0,3800 |
CO |
1134 |
0,286 |
0,1275 |
CO2 |
198 |
0,05 |
0,0142 |
H2 |
279 |
0,071 |
0,4432 |
CH4 |
180 |
0,045 |
0,0351 |
SUMA |
3960 |
1 |
1 |
Strumień D
Zawartość azotu w stumieniu E: ![]()
Ułamki masowe.
![]()
0,77
![]()
0,225
![]()
0,005
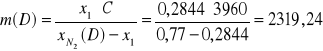
![]()
![]()
1785,81 ![]()
![]()
521,83 ![]()
![]()
11,60 ![]()
Ułamki molowe
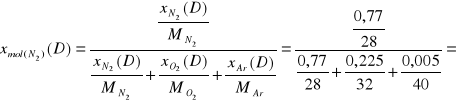
0,7935
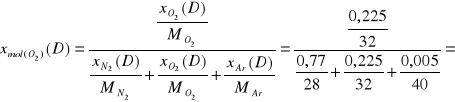
0,2029
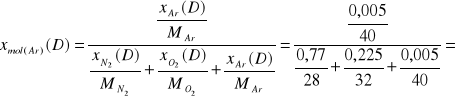
0,0036
Składnik |
Masa |
Ułamek masowy |
Ułamek molowy |
N2 |
1785,81 |
0,77 |
0,7935 |
O2 |
521,83 |
0,225 |
0,2029 |
Ar |
11,60 |
0,005 |
0,0036 |
SUMA |
2319,24 |
1 |
1 |
Strumień E
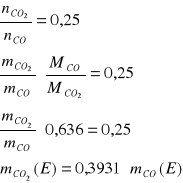
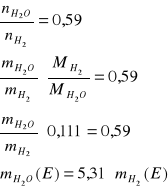
Bilans C:![]()
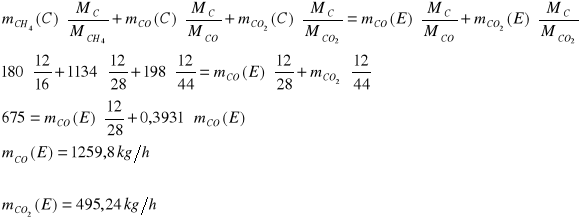
Bilans H:
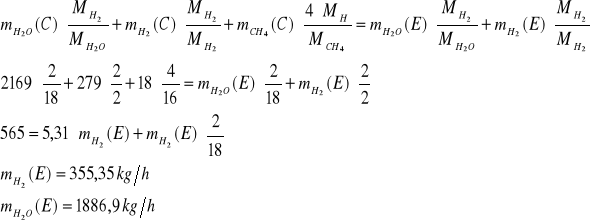
Bilans O:
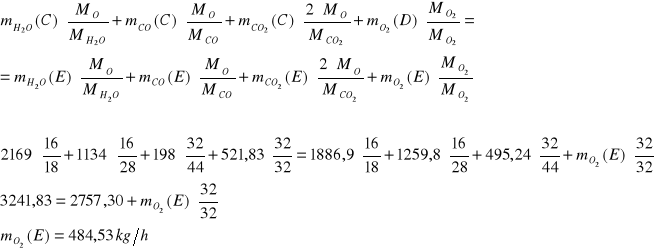
![]()
1785,81 ![]()
![]()
11,60 ![]()
![]()
Ułamki masowe.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Ułamki molowe.







Składnik |
Masa |
Ułamek masowy |
Ułamek molowy |
CO |
1259,8 |
0,201 |
0,1076 |
CO2 |
495,24 |
0,079 |
0,0269 |
H2 |
355,35 |
0,057 |
0,4270 |
H2O |
1886,9 |
0,300 |
0,2497 |
N2 |
1785,81 |
0,284 |
0,1519 |
O2 |
484,53 |
0,077 |
0,0008 |
Ar |
11,60 |
0,002 |
0,0361 |
SUMA |
6279,23 |
1 |
1 |
Strumień F
W reaktorze III tlenek węgla ulega konwersji do ditlenku węgla. W gazie opuszczającym reaktor znajduje się 0,1% mas. tlenku węgla. Ditlenek węgla przereagowuje całkowicie.
Bilans C:
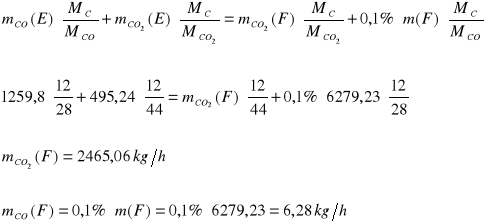
Bilans O:
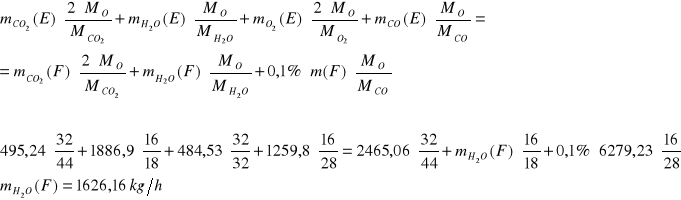
Bilans H:
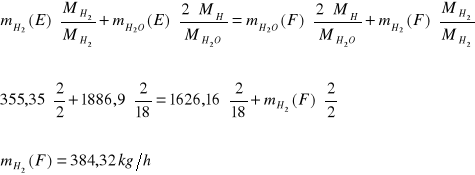
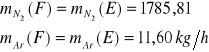
Ułamki masowe.
![]()
![]()
![]()
![]()
![]()
![]()
Ułamki molowe.






Składnik |
Masa |
Ułamek masowy |
Ułamek molowy |
CO |
6,28 |
0,001 |
0,001 |
CO2 |
2465,06 |
0,393 |
0,139 |
H2 |
384,32 |
0,061 |
0,476 |
H2O |
1626,16 |
0,259 |
0,225 |
N2 |
1785,81 |
0,284 |
0,158 |
Ar |
11,60 |
0,002 |
0,001 |
SUMA |
6279,23 |
1 |
1 |
Strumień G
Tlenki węgla usuwa się, ponieważ są one truciznami katalizatora syntezy amoniaku. Ditlenek węgla odmywany jest w płuczce zraszanej wodnym roztworem węglanu potasu o stężeniu 30% mas. stosując 1,2 krotny molowy nadmiar węglanu potasu w stosunku do ditlenku węgla w strumieniu F. Zachodzi następująca reakcja:
K2CO3 + CO2 + H2O = 2 KHCO3

![]()
![]()
Ułamki masowe:
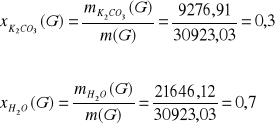
Ułamki molowe:
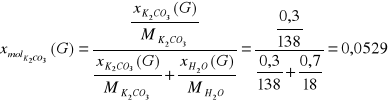
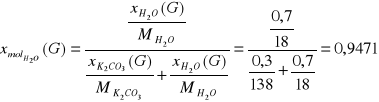
Składnik |
Masa |
Ułamek masowy |
Ułamek molowy |
H2O |
21646,12 |
0,7 |
0,9471 |
K2CO3 |
9276,91 |
0,3 |
0,0529 |
SUMA |
30923,03 |
1 |
1 |
PŁUCZKA
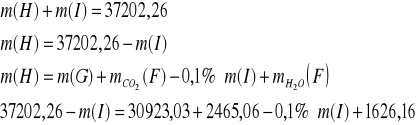
![]()
![]()
Strumień H
Masy poszczególnych składników wyliczamy z reakcji:
K2CO3 + CO2 + H2O = 2 KHCO3
![]()
![]()
1 kmol H2O - 1 kmol CO2
18 kg H2O - 44kg CO2
![]()
- 2462,87kg CO2
![]()
![]()
![]()
1 kmol CO2 - 1kmol K2CO3
44kg CO2 - 138kg K2CO3
2462,87kg CO2 - ![]()
![]()
![]()
![]()
1 kmol CO2 - 2kmol KHCO3
44kg CO2 - 200kg KHCO3
2462,87kg CO2 - ![]()
![]()
![]()
Ułamki masowe:
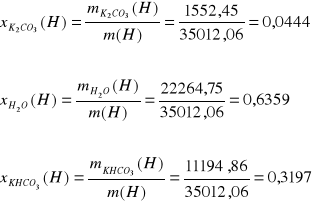
Ułamki molowe:
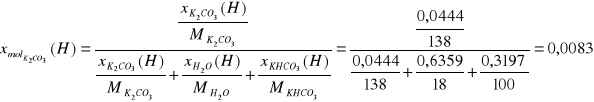
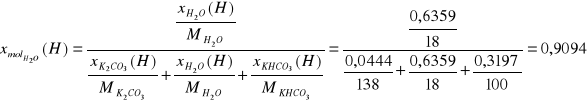
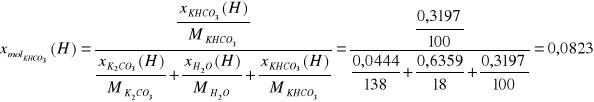
Składnik |
Masa |
Ułamek masowy |
Ułamek molowy |
H2O |
22264,75 |
0,6359 |
0,9094 |
K2CO3 |
1552,45 |
0,0444 |
0,0083 |
KHCO3 |
11194,86 |
0,3197 |
0,0823 |
SUMA |
35012,06 |
1 |
1 |
Strumień I
![]()
![]()
![]()
![]()
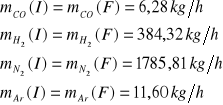
Ułamki masowe.
![]()
![]()
![]()
![]()
![]()
Ułamki molowe.




Składnik |
Masa |
Ułamek masowy |
Ułamek molowy |
CO |
6,28 |
0,003 |
0,0009 |
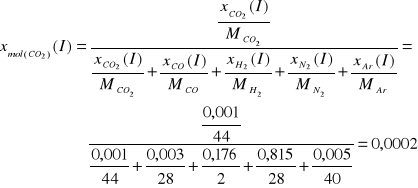
CO2 |
2,19 |
0,001 |
0,0002 |
H2 |
384,32 |
0,176 |
0,7498 |
N2 |
1785,81 |
0,815 |
0,2480 |
Ar |
11,60 |
0,005 |
0,0011 |
SUMA |
2190,2 |
1 |
1 |
Strumień J
W celu całkowitego usunięcia tlenków węgla w następnym reaktorze (metanizer) poddaje się je metanizacji. Zachodzą następujące reakcje:
CO + 3 H2 = CH4 + H2O
CO2 + 4 H2 = CH4 + 2 H2O
Bilans O:
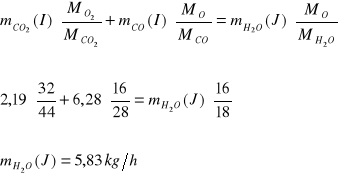
Bilans C:
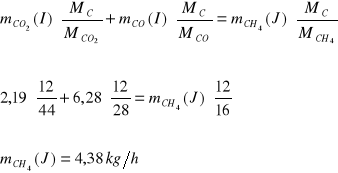
Bilans H:
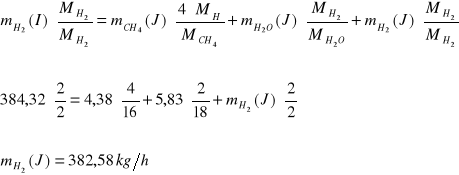
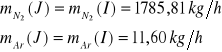
![]()
![]()
Ułamki masowe.
![]()
![]()
![]()
![]()
![]()
Ułamki molowe.





Składnik |
Masa |
Ułamek masowy |
Ułamek molowy |
H2O |
5,83 |
0,0026 |
0,0012 |
CH4 |
4,38 |
0,002 |
0,0011 |
H2 |
382,58 |
0,1747 |
0,7474 |
N2 |
1785,81 |
0,8154 |
0,2492 |
Ar |
11,60 |
0,0053 |
0,0011 |
SUMA |
2190,2 |
1 |
1 |
Strumień L
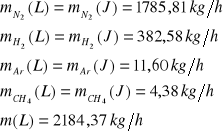
Ułamki masowe.
![]()
![]()
![]()
![]()
Ułamki molowe.
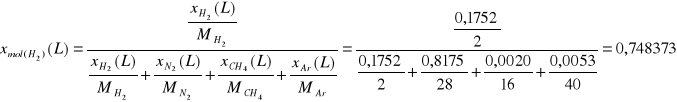
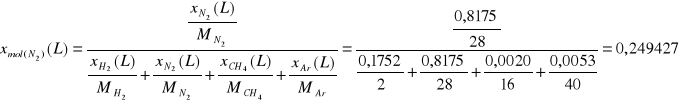
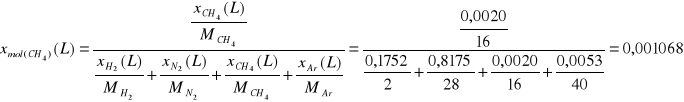
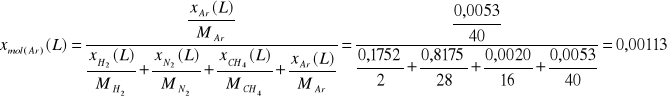
Składnik
|
Masa |
Ułamek masowy |
Ułamek molowy |
H2
|
382,58 |
0,1752 |
|
N2
|
1785,81 |
0,8175 |
|
CH4
|
4,38 |
0,0020 |
0,0011 |
Ar
|
11,60 |
0,0053 |
0,0011 |
SUMA
|
2184,37 |
1 |
1 |
Strumień K
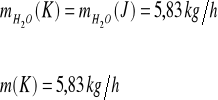
Ułamki masowe.
![]()
Ułamki molowe.
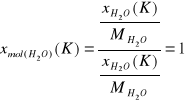
Składnik |
Masa |
Ułamek masowy |
Ułamek molowy |
H2O |
5,83 |
1 |
1 |
SUMA |
5,83 |
1 |
1 |
II. Obliczenie wydajności procesu.
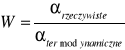
![]()
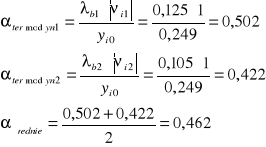
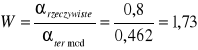
III. Zestawienie tabelaryczne dla poszczególnych aparatów oraz dla całego procesu.
Strumień |
Masa[kg/h] |
A |
900 |
B |
3060 |
C |
3960 |
D |
2319,24 |
E |
6279,23 |
F |
6279,23 |
G |
30923,03 |
H |
35012,06 |
I |
2190,2 |
J |
2190,2 |
L |
2184,37 |
K |
5,83 |
Strumień C
Składnik |
Masa |
Ułamek masowy |
Ułamek molowy |
H2O |
2169 |
0,548 |
0,3800 |
CO |
1134 |
0,286 |
0,1275 |
CO2 |
198 |
0,05 |
0,0142 |
H2 |
279 |
0,071 |
0,4432 |
CH4 |
180 |
0,045 |
0,0351 |
SUMA |
3960 |
1 |
1 |
Strumień D
Składnik |
Masa |
Ułamek masowy |
Ułamek molowy |
N2 |
1785,81 |
0,77 |
0,7935 |
O2 |
521,83 |
0,225 |
0,2029 |
Ar |
11,60 |
0,005 |
0,0036 |
SUMA |
2319,24 |
1 |
1 |
Strumień E
Składnik |
Masa |
Ułamek masowy |
Ułamek molowy |
CO |
1259,8 |
0,201 |
0,1076 |
CO2 |
495,24 |
0,079 |
0,0269 |
H2 |
355,35 |
0,057 |
0,4270 |
H2O |
1886,9 |
0,300 |
0,2497 |
N2 |
1785,81 |
0,284 |
0,1519 |
O2 |
484,53 |
0,077 |
0,0008 |
Ar |
11,60 |
0,002 |
0,0361 |
SUMA |
6279,23 |
1 |
1 |
Strumień F
Składnik |
Masa |
Ułamek masowy |
Ułamek molowy |
CO |
6,28 |
0,001 |
0,001 |
CO2 |
2465,06 |
0,393 |
0,139 |
H2 |
384,32 |
0,061 |
0,476 |
H2O |
1626,16 |
0,259 |
0,225 |
N2 |
1785,81 |
0,284 |
0,158 |
Ar |
11,60 |
0,002 |
0,001 |
SUMA |
6279,23 |
1 |
1 |
Strumień G
Składnik |
Masa |
Ułamek masowy |
Ułamek molowy |
H2O |
21646,12 |
0,7 |
0,9471 |
K2CO3 |
9276,91 |
0,3 |
0,0529 |
SUMA |
30923,03 |
1 |
1 |
Strumień H
Składnik |
Masa |
Ułamek masowy |
Ułamek molowy |
H2O |
22264,75 |
0,6359 |
0,9094 |
K2CO3 |
1552,45 |
0,0444 |
0,0083 |
KHCO3 |
11194,86 |
0,3197 |
0,0823 |
SUMA |
35012,06 |
1 |
1 |
Strumień I
Składnik |
Masa |
Ułamek masowy |
Ułamek molowy |
CO |
6,28 |
0,003 |
0,0009 |
CO2 |
2,19 |
0,001 |
0,0002 |
H2 |
384,32 |
0,176 |
0,7498 |
N2 |
1785,81 |
0,815 |
0,2480 |
Ar |
11,60 |
0,005 |
0,0011 |
SUMA |
2190,2 |
1 |
1 |
Strumień J
Składnik |
Masa |
Ułamek masowy |
Ułamek molowy |
H2O |
5,83 |
0,0026 |
0,0012 |
CH4 |
4,38 |
0,002 |
0,0011 |
H2 |
382,58 |
0,1747 |
0,7474 |
N2 |
1785,81 |
0,8154 |
0,2492 |
Ar |
11,60 |
0,0053 |
0,0011 |
SUMA |
2190,2 |
1 |
1 |
Strumień L
Składnik
|
Masa |
Ułamek masowy |
Ułamek molowy |
H2
|
382,58 |
0,1752 |
|
N2
|
1785,81 |
0,8175 |
|
CH4
|
4,38 |
0,0020 |
0,0011 |
Ar
|
11,60 |
0,0053 |
0,0011 |
SUMA
|
2184,37 |
1 |
1 |
Strumień K
Składnik |
Masa |
Ułamek masowy |
Ułamek molowy |
H2O |
5,83 |
1 |
1 |
SUMA |
5,83 |
1 |
1 |
IV. Bilans C, H i O dla całego procesu
C:
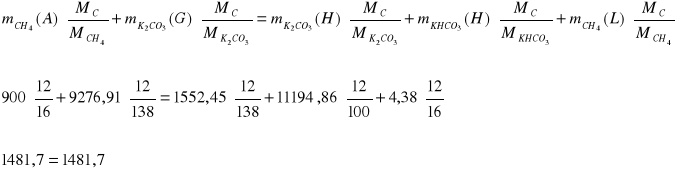
O:
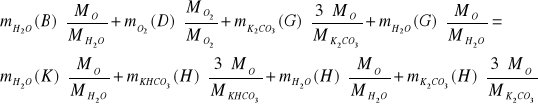
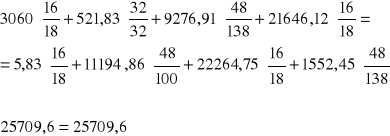
H:
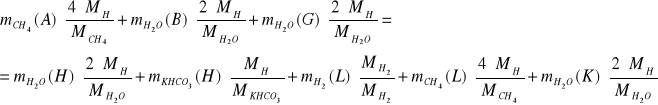
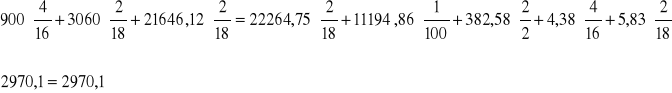
6. Gospodarka odpadami
Gaz wodorowy może być z wysoką efektywnością stosowany w procesach hydrorafinacyjnych. Procesy hydrorafinacyjne prowadzą nie tylko rafinerie przerabiające ropę, ale również liczne małe firmy, które przetwarzają odpadowe tworzywa sztuczne lub przepracowane oleje transformatorowe oraz smarowe poprzez ich termiczny kraking (pirolizę) do paliw płynnych.
Ditlenek węgla znajduje zastosowanie w przemyśle browarniczym, spożywczym, chemicznym oraz wydobyciu gazu i ropy naftowej. Dla zastosowań w przemyśle spożywczym (napoje gazowane, suchy lód dla potrzeb chłodniczych) i browarniczym wymagany stopień czystości stosowanego di tlenku węgla jest najwyższy.
W przemyśle chemicznym CO2 znalazł główne zastosowanie w produkcji mocznika.
Mimo ze jest gazem cieplarnianym, zastąpił on szkodliwe dla warstwy ozonowej freony wykorzystywane do produkcji aerozoli. Ditlenek węgla wykorzystywany jest również do schładzania reaktorów jądrowych.
Stosowany jest też do uzdatniania wód przemysłowych:
Neutralizacja poziomu pH wód ściekowych zanim zostaną zrzucone lub poddane biodegradacji.
Optymalna regulacja poziomu pH przed uzdatnianiem fizyko-chemicznym
( np. flokulacja itp.).
CO2 jako organiczne źródło dwutlenku węgla zamiast węglanów.
Odbudowa równowagi chemicznej np. w wodach wytrącających kamień.
Regeneracja wymienników jonów, stosując żywice denitryfikacyjne.
Wspomniany wcześniej suchy lód posiada również szerokie zastosowanie:
Czyszczenie suchym lodem jest to efektywny i ekonomiczny sposób podniesienia wydajności i jakości procesu mycia w wielu gałęziach przemysłu.
Transport kriogeniczny:
- Transport próbek tj. głęboko zmrożonych produktów spożywczych, czekolad
- Chłodzenie wózków cateringowych używanych przez linie lotnicze, kolej
- Transport materiałów biologicznych i laboratoryjnych tj. krew, organy
- Przesyłki lotnicze
7. Bibliografia
Bortel Edgard ,Koneczny Henryk " Zarys technologii chemicznej" Wydawnictwo Naukowe PWN Warszawa 1992
Więcław- Solny Lucyna, Łabojko Grzegorz,Babiński Piotr "Możliwość przemysłowego wykorzystania ditlenku węgla - badania nad zastosowaniem CO2 w procesie otrzymywania gazu syntezowego "- artykuł z serii Polityka Energetyczna Tom 12 zeszyt 2/2 2009
Edward Grzywa , Jacek Molenda „Technologia podstawowych syntez organicznych” Tom I Wydawnictwo Naukowo- Techniczne, Warszawa 1995
Jan Ogonowski „Przeróbka paliw stałych, ciekłych i gazowych” Pomoc dydaktyczna, Kraków 1994
Źródła internetowe:
http://polindustry.org.pl/przemysl/studium-wykonalnosci-zgazowania-wegla-w-%E2%80%9Epulawach%E2%80%9D-gotowe.html
http://www.nw.pwr.wroc.pl/~trawczynski/wyklady/%28wod_363r_www%29.pdf
Wyszukiwarka
Podobne podstrony:
projekt bilans, Uczelnia, Różne, UCZELNIA OD KOCHANEJ MONIKI, semestr 5, Surowce i procesy tecgnolog
Ściąga korozja, Uczelnia, Różne, UCZELNIA OD KOCHANEJ MONIKI, semestr 5, Korozja, Ściąga
korozja, Uczelnia, Różne, UCZELNIA OD KOCHANEJ MONIKI, semestr 5, Korozja, Ściąga
polaryzacja, Uczelnia, Różne, UCZELNIA OD KOCHANEJ MONIKI, semestr 5, Korozja, Zaliczenie
korozja1, Uczelnia, Różne, UCZELNIA OD KOCHANEJ MONIKI, semestr 5, Korozja, Ściąga
Pytania z zaliczenia z korozji, Uczelnia, Różne, UCZELNIA OD KOCHANEJ MONIKI, semestr 5, Korozja, Za
Korozja2, Uczelnia, Różne, UCZELNIA OD KOCHANEJ MONIKI, semestr 5, Korozja, Ściąga
02 Termin 2 Metody 2012, Uczelnia, Różne, UCZELNIA OD KOCHANEJ MONIKI, semestr 5
klasyfikator hydrauliczny, Uczelnia, Różne, UCZELNIA OD KOCHANEJ MONIKI, semestr 5, Inżynieria chemi
sprawozdanie 8, Uczelnia, Różne, UCZELNIA OD KOCHANEJ MONIKI, semestr 5, Inżynieria chemiczna, Labor
spis, Uczelnia, Różne, UCZELNIA OD KOCHANEJ MONIKI, semestr 5
korozja3, Uczelnia, Różne, UCZELNIA OD KOCHANEJ MONIKI, semestr 5, Korozja, Ściąga
Sprawko, Uczelnia, Różne, UCZELNIA OD KOCHANEJ MONIKI, semestr 5, Inżynieria chemiczna, Laborki
materiały - opracowane żurek, Uczelnia, Różne, UCZELNIA OD KOCHANEJ MONIKI, materiały wys. czyst
Wszystko -materialy Zurek, Uczelnia, Różne, UCZELNIA OD KOCHANEJ MONIKI, materiały wys. czyst, nowy
strona tytułowa projektu inżynierskiego pwr, Uczelnia PWR Technologia Chemiczna, Semestr 7, Różne pr
sprawko z polimerow od Agi, Uczelnia PWR Technologia Chemiczna, Semestr 7, Różne przydatne
więcej podobnych podstron