Oddziaływania międzycząsteczkowe:
Każda emisja lub absorpcja energii promieniowania odpowiada przejściu elektronu pomiędzy orbitami stacjonarnymi.
hv=E1-E2
gdzie h-stała Plancka, v- częstotliwość, E1 i E2 energie układu w obu stanach stacjonarnych.
Cząsteczki.
Cząsteczka powstaje tylko wtedy gdy energia cząsteczki jest mniejsza od sumy energii poszczególnych atomów w stanie swobodnym. O trwałości stanowi minimum energii potencjalnej takiego układu.
Siła oddziaływań.
Energia wiązania wewnątrzcząsteczkowego jest około 100 krotnie większa od energii wiązań międzycząsteczkowych.
Oddziaływania międzycząsteczkowe są dużo słabsze niż wewnątrzcżąsteczkowe.
Prawie wszystkie własności materii określone są przez charakter tych oddziaływań.
Cząsteczki, nawet pozbawione ładunku elektrycznego, oddziałują między sobą. Dzięki tym oddziaływaniom możliwe jest istnienie cieczy i większości ciał stałych.
Wyróżniamy dwa rodzaje oddziaływań międzycząsteczkowych:
Przyciąganie
Odpychanie (na bardzo małych odległościach)
Oddziaływania międzycząsteczkowe:
1. Siły elektrostatyczne
2. Wiązania wodorowe
3. Siły van der Waalsa
4. Oddziaływania hydrofobowe
Siły elektrostatyczne.
- przenikalność elektryczna ośrodka;
- względna przenikalność elektryczna ośrodka;
Elektroujemność.
Zdolność uzupełniania do trwałej powłoki przez przyłączenie elektronu.
Im wyższa elektroujemność tym silniejsze przyciąganie elektronów przez atom.
Najwyższą elektroujemność (4) ma atom fluoru.
Pierwiastek; Elektroujemność
Fluor 4,0
Tlen 3,5
Chlor 3,0
Azot 3,0
Brom 2,8
Siarka 2,5
Węgiel 2,5
Wodór 2,1
Cząsteczka wody.
Jeżeli wiązanie tworzą atomy pierwiastków o równej elektroujemności, to jedno z jąder atomowych przyciąga elektrony z większą siłą niż drugie. Prowadzi to do deformacji chmury elektronowe i nierównomiernego rozłożenia ładunku na cząsteczce. Taką cząsteczkę nazywamy wówczas dipolem i mówimy, że jest ona polarna.
Duża różnica elektroujemności między tlenem, a wodorem powoduje przesunięcie chmury elektronowe. Ponieważ oba atomy wodoru znajdują się po jednej stronie cząsteczki, jej moment dipolowy jest wysoki, a cząsteczka silnie polarna.
Wiązanie wodorowe.
Zbliżony charakter do kowalencyjnego, ale energia wiązania jest mniejsza.
(Atom elektroujemny + wodór) + atom elektroujemny
Występuje między: cząsteczkami, wewnątrz cząsteczek
Posiada ono bardzo duże znaczenie w układach biologicznych i jest odpowiedzialne za utrzymanie struktury białek, DNA unikalne własności wody.
Warunek powstania wiązania wodorowego
atom wodoru jest związany w cząsteczce z atomem pierwiastka silnie elektroujemnego, np. tlenem lub azotem
pomiędzy jądrem wodoru i jakimś innym atomem elektroujemnym może pojawić się przyciąganie elektrostatyczne
Drugorzędowe struktury białek.
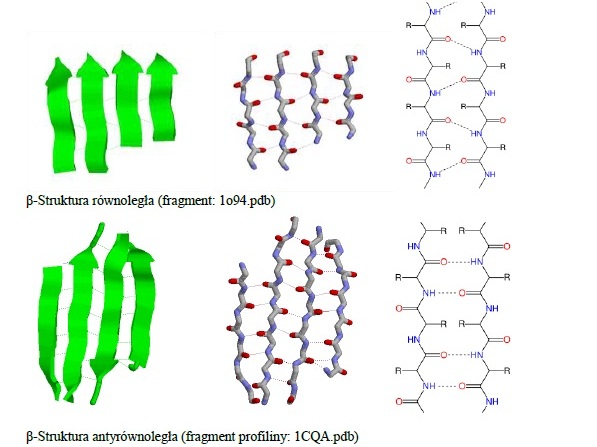
Wiązanie wodorowe jest głównym czynnikiem odpowiedzialnym za stabilność konformacji białka i aminokwasów.
Siły Van der Waalsa.
Oddziaływania pomiędzy cząsteczkami obojętnymi elektrycznie i energii E równej:
E=![]()
orientacyjne- oddziaływania między trwałymi dipolami
indukcyjne- oddziaływania między dipolami trwałymi i indukowanymi
dyspersyjne- oddziaływania między cząsteczkami, które nie są dipolami (występują między wszystkimi rodzajami cząsteczek, są silniejsze od oddziaływań indukcyjnych i orientacyjnych, stanowią główny składnik oddziaływań Van der Waalsa)
Siły dyspersyjne pomiędzy dwoma różnymi cząsteczkami mogą być zarówno siłami przyciągania jak i odpychania. Zależy to od rodzaju środowiska, w którym odbywa się oddziaływanie.
Oddziaływania hydrofobowe („nie lubi wody”)
Substancjami hydrofilowymi są substancje polarne elektrycznie, np. jony.
Substancjami hydrofobowymi są substancje niepolarne elektrycznie.
Cząsteczki amfifilowe.
Cząsteczki lipidów posiadają charakter amfifilowy, to znaczy że jedna część cząsteczki posiada własności hydrofobowe ("nie lubi wody") natomiast druga własności hydrofilowe ("lubi wodę").
Zachowanie lipidów w kontakcie z wodą.
Błony biologiczne.
Zaliczamy do nich zarówno błony komórkowe jak i błony organelli wewnętrznych. Bez względu na lokalizacje błony zbudowane są w identyczny nieomal sposób.
Funkcje błony biologicznej.
Odgradzają wnętrze danego przedziału (komórki lub organelli) od środowiska zewnętrznego
Utrzymywanie różnicy stężeń różnych substancji
Różnicy potencjałów elektrycznych pomiędzy wnętrzem i otoczeniem komórki
Kontrolują transport substancji z i do komórki
Zapewniają przenoszenie informacji pomiędzy wnętrzem a otoczeniem
Błony niektórych komórek (np. nerwowych) posiadają także zdolność do przetwarzania informacji
Stanowią strukturalną podstawę w właściwego funkcjonowania wielu enzymów
Rozpoznawanie obcych komórek
Model płynnej mozaiki
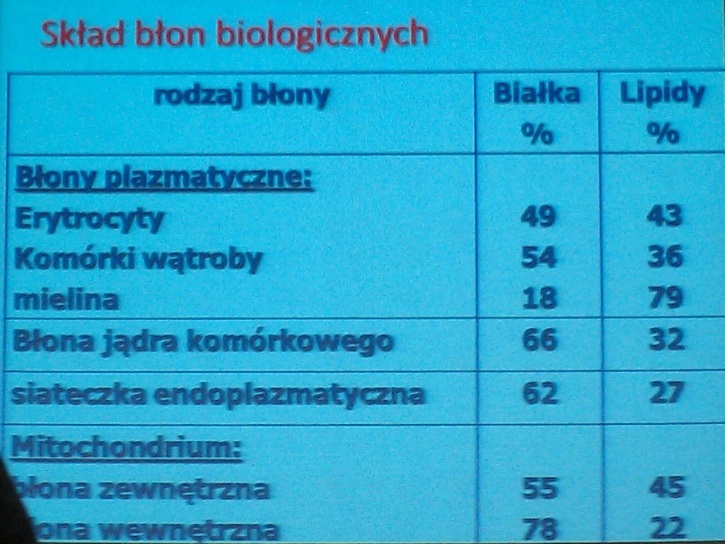
Składniki błon biologicznych:
- lipidy
- białka
- cukry
Lipidy.
Lipidami nazywamy grupę cząsteczek charakteryzujących się bardzo złą rozpuszczalnością w wodzie i dobrą rozpuszczalnością w rozpuszczalnikach niepolarnych (np. chloroformie).
Amfifilowy charakter lipidów.
Cząsteczki lipidów posiadają charakter amfifilowy. W środowisku wodnym spontanicznie grupują się one tak by z wodą kontaktowały się wyłącznie części hydrofilowe.
Frakcja lipidowa.
Fosfolipidy
Glikolipidy
Cholesterol
W błonach komórek przeważającą część frakcji lipidowej stanowią fosfolipidy.
Asymetria błony.
Lipidy:
inny skład chemiczny monowarstw lipidowych
występowanie domen
Białka:
Różne białka po stronie wewnętrznej i zewnętrznej błony
Cukry:
Występują głównie po zewnętrznej stronie błony
Temperatura
Długość węglowodorowych łańcuchów
Liczba wiązań podwójnych
Zawartość cholesterolu
Oddziaływania lipid-białko
Oddziaływania lipid-lipid
Przejście fazowe zachodzi w temperaturze przejścia fazowego.
Niezależne występowanie białek integralnych i powierzchniowych
Asymetria rozmieszczenia lipidów i białek
Płynność
Transport błonowy
Pojedynczych substancji- uniport
Dwóch substancji w tym samym kierunku- symport
Dwóch substancji w przeciwnych kierunkach- antysport
Bierny:
Aktywny:
Dyfuzja prosta
Substancje rozpuszczalne w lipidach (lipofilne)
Gazy: O2, N2, CO2
Małe, obojętne cząsteczki, np.: mocznik, etanol
Dyfuzja ułatwiona- transport na nośnikach
Cukry
Aminokwasy
Nukleotydy
Różnica ciśnień hydrostatycznych: filtracja i ultrafiltracja
Różnica potencjałów elektrycznych: elektrody fuzja
Oczyszczanie krwi z wody i niepotrzebnych składników w kłębuszkach nerkowych
Sztuczna nerka
Posiadające zdolność do kontrolowanego przepuszczania jonów
Otwierają się lub zamykają w zależności od czynników zewnętrznych
Kanały zależne od napięcia
Kanały zależne od ligandu (aktywowane chemicznie)
Kanały aktywowane naprężeniem mechanicznym
Kanał sodowy oznacza, iż kanał ten najlepiej przepuszcza jony sodu. Oprócz nich, choć znacznie gorzej, mogą przez ten kanał przechodzić także inne kationy.
Otwieranie kanałów jonowych jest procesem typu „wszystko albo nic”. Tzn., że kanał albo jest zamknięty i nie przewodzi jonów albo jest otwarty i wówczas jego przewodnictwo nie zależy od wielkości czynnika otwierającego.
Różnicę stężeń tego jonu po obydwu stronach błony komórkowej
Istniejącą w danej chwili różnicę potencjałów
Płynność błon biologicznych.
Dyfuzja boczna wsp. dyfuzji 10-8 cm2/s
Czynniki wpływające na płynność błony.
Wpływ temperatury na płynność błon
W określonej temperaturze układ przechodzi ze stanu ścisłego upakowania (żel) do stanu w którym łańcuchy węglowodorowe ulegają pofałdowaniu i tracą uporządkowanie w płaszczyźnie błony (zol).
Wpływ długości łańcuchów węglowodorowych na płynność błon
Im dłuższe łańcuchy węglowodorowe tym wyższa temperatura przejścia fazowego.
Wpływ liczby wiązań podwójnych na płynność błon
Im więcej wiązań nienasyconych tym niższa temperatura przejścia fazowego.
Wpływ cholesterolu na płynność błon
W błonach zawierających lipidy o przewadze wiązań nasyconych- cholesterol zwiększa płynność błony.
W błonach zawierających lipidy o wiązaniach nienasyconych- cholesterol zmniejsza płynność błony.
Główne cechy modelu płynnej mozaiki
Transport przez błony biologiczne.
Rodzaje transportu:
W tym transporcie nie jest wykorzystywana energia pochodząca z procesów metabolicznych.
Jest to transport wykorzystujący energię pochodzącą z procesów metabolicznych.
Transport bierny
Spontaniczny transport substancji wywołany różnicą stężeń w różnych punktach obszaru zajmowanego przez tę substancję.
Dyfuzja prosta przez błonę.
j=P*(cz-cw)
j- strumień substancji przechodzącej przez warstwę
P- przepuszczalność błony
cz i cw - stężenie substancji odpowiednio na zewnątrz błony i w cytoplazmie
W ten sposób przenikają do wnętrza komórki:
W błonach znajdują się białka odpowiedzialne za transport, zwane białkami transportowymi lub nośnikami.
Substancja + nośnik kompleks zmiana konformacji kompleksu substancja + nośnik
W komórkach nabłonka jelita, występuje symport 1 cząsteczki glukozy na 1 jon Na+.
W komórkach mięsni, występuje antyport 1jonu Ca2+ na 3 jony Na+.
W ten sposób przenikają do wnętrza komórki:
Dyfuzja złożona
Oprócz różnicy stężeń, na transport wpływają dodatkowe bodźce:
Filtracja- przepływ roztworu pod wpływem różnicy ciśnień hydrostatycznych
Ultrafiltracja- prze pływ substancji rozpuszczonej pod wpływem różnicy ciśnień hydrostatycznych
Filtracja i ultrafiltracja
Elektrodyfuzja
Wyspecjalizowane białka integralne, tzw. kanały jonowe tworzą wypełnione wodą pory, hydrofilowej przestrzeni wewnątrz białka, którymi przez błonę transportowane są jony.
Kanały jonowe
Ze względu na rodzaj czynnika otwierającego (aktywującego) kanały jonowe dzielimy:
Selektywność- zdolność do przepuszczania ściśle określonych typów jonów.
Mówimy więc o kanałach kationowych lub anionowych, a gdy kanały są jeszcze bardziej „wyspecjalizowane” to określamy je jako sodowe, potasowe itd.
Gradient elektrochemiczny
Przy maksymalnie otwartych kanałach jonowych wielkość strumienia określonego jonu zależy od gradientu elektrochemicznego, który tworzony jest łącznie przez:
Wyszukiwarka
Podobne podstrony:
Transport przez błony biologiczne, Studia, I rok, Wykłady z biofizyki
Biofizyka pytania z kola, Biotechnologia PWR, Semestr 5, Biofizyka - Wykład, Biofizyka - materiały
Wykład 1 Biofizyka komórki
BIOFIZYKA- rozwiązania, Biotechnologia PWR, Semestr 5, Biofizyka - Wykład, Biofizyka - materiały
BiophysicsKTprogramang-pol, Studia, I rok, Wykłady z biofizyki
Biofizyka - pytania z odpowiedziami, Biotechnologia PWR, Semestr 5, Biofizyka - Wykład, Biofizyka -
Wykłady z biofizyki, Szkoła, biofizyka
Wykłady z biofizyki4, Biofizyka
wykłady z biofizyki
zagadnienia wyklady, biofizyka
Transport przez błony biologiczne, Studia, I rok, Wykłady z biofizyki
biofizyka wyklad 09
biofizyka wyklad 04
biofizyka 2, różne gł medyczne, wykłady
Biofizyka pytania opracowane wykład 9
Wykład PŁ, bio, Chemia, Biofizyka, Toksykologia, Chemia i Technologia Wody
biofiz, Wykład V, Wykład V
biofizyka, nie wiem-wymiana ciepła, mam-Fizjoterapia1 - wykład 8
więcej podobnych podstron