mgr inż. Milena Dziębaj Wrocław, 11.04.2008
Materiałoznawstwo
materiały pomocnicze do wykładu
doc. dr inż. Grzegorza Pękalskiego
dla Studentów Wydziału Mechanicznego
kierunków Zarządzania i Inżynierii Produkcji, Mechatroniki i Studium Kształcenia Podstawowego
Co i gdzie tutaj znaleźć?
Dwa słowa wstępu
Materiał, który trzymasz przed sobą powstał, aby maksymalnie ułatwić Wam, Studentom, pracę nad zagadnieniami omawianymi na wykładzie z Materiałoznawstwa prowadzonym przez doc. dr inż. Grzegorza Pękalskiego. Jeśli przeczytasz ten tekst, łatwo spostrzeżesz, że zawiera on tylko najbardziej podstawowe wiadomości o czterech najważniejszych grupach materiałów inżynierskich. Bardziej szczegółowo zagadnienia te omówione one zostaną na kolejnych wykładach, w dostarczonych Wam materiałach lub po prostu życie i przyszła praca same skutecznie „zmuszą” Was do specjalistycznego dokształcenia się w danym obszarze.
Ponadto - jako jeszcze niedawna (a właściwie to również aktualna) studentka - starałam się ten materiał zredagować w sposób, jaki sama lubię w notatkach podczas nauki, czyli tak, aby „czytał się raz a i dobrze”, po prostu by wchodził do głowy po pierwszym czytaniu. Informacje poniekąd dodatkowe, ciekawostki, przykłady starałam się umieszczać w przypisach, co mam nadzieję również ułatwi szybkie przyswajanie materiału.
Aczkolwiek tym z Was, którzy w tym miejscu uznają, że w takim razie odłożą go na półkę aż do sesji - nie gwarantuję, że dotyczyć to będzie także jednego czytania dokonanego przez zmęczony mózg przepitego kawą Studenta/ki o 3 nad ranem w miesiącu ogólnie uznawanym za pracowity.
Tyle mianem wstępu, od tego miejsca przejdziemy już do sedna, a na „posłowie” zarezerwuję sobie jeszcze samą końcówkę tego opracowania.
Garść podstawowych definicji i schematów
Po pierwsze, warto abyście już na wstępie nastawili się na to, o czym będzie tutaj mowa. Tak więc:
Materiały naturalne - aby wykorzystać je technicznie wystarczy tylko nadać im odpowiedni kształt (np. drewno, kamienie, kości);
Materiały inżynierskie - nie występują naturalnie w przyrodzie i wymagają zastosowania złożonych procesów wytwórczych w celu przystosowania ich do potrzeb technicznych.
|
|
rys 2.1: Podstawowe grupy materiałów inżynierskich. |
rys 2.2: Rodzaje wiązań między atomami w podstawowych grupach materiałów inżynierskich. |
Systemów podziału materiałów inżynierskich jest dużo. Podstawą podanej tu klasyfikacji jest istota wiązań pomiędzy atomami tworzącymi dany materiał [rys.2.2]. Wiązania te (kowalencyjne, jonowe, metaliczne, wtórne) utrzymują materiał w skoordynowanych przestrzennie układach i determinują podstawowe właściwości materiału.
Metale i stopy, tworzywa metaliczne
Zastosowanie czystych metali, szczególnie w technice, jest bardzo ograniczone. Zazwyczaj wykorzystywane są stopy różnych metali, często jednak określenie ”metal” rozumie się jako „metal i jego stopy” - i niech też tak będzie. Zatem co to jest stop (tworzywo metaliczne)?
Stopy - to tworzywa powstałe w wyniku celowego wprowadzenia do rozpuszczalnika dodatków stopowych. I tak na przykład najstarszy brąz jest połączeniem miedzi (rozpuszczalnik) i cyny np. w ilości 10% (dodatek stopowy). Jako ciekawostkę powiem Wam, że taki brąz nazywa się „brązem cynowym”, a oprócz tego „na bazie miedzi” produkowane są też inne brązy. Ich nazwy wywodzą się od zastosowanych dodatków stopowych - czyli mamy brązy np. aluminiowe, ołowiowe (nie mylić przypadkiem ze słowem ołowiane, bo takie to mogą być żołnierzyki) czy też cynowo-cynkowo-ołowiowe.
Nie zawsze w skład tworzyw metalicznych wchodzą wyłącznie pierwiastki metali tak, jak było to w podanych powyżej brązach. Po przykłady nie trzeba sięgać daleko: kogokolwiek zapytamy o pierwsze skojarzenie ze słowem „metal” usłyszymy odpowiedzi: stal, niektórzy wymienią też staliwa i żeliwa, a wszystko to nic innego jak stopy żelaza (metal) z węglem (który - jak wiecie - metalem nie jest).
Czym są metale (stopy metali)? Właściwości.
Metale to odrębna grupa ciał stałych o pewnych specyficznych właściwościach:
Połysk metaliczny
Wynikający z odbijania promieni świetlnych od wypolerowanych powierzchni)
Dobre przewodnictwo cieplne i elektryczne
Dodatni temperaturowy współczynnik rezystywności
Opór rośnie wraz z temperaturą. „Winne” temu są drgania cieplne rdzeni elektronowych.
Zdolność do emisji termoelektronowej i fotoelektronowej
Plastyczność
Czyli zdolność do trwałych odkształceń pod wpływem przyłożonych naprężeń.
Wymieniony zestaw cech stanowi zwykle kryterium rozpoznawcze metali, jakkolwiek nie we wszystkich metalach właściwości te występują jednakowo intensywnie.
Właściwości metali są następstwem szczególnego wiązania atomowego, jakie występuje między ich atomami w stanie stałym i ciekłym. Jest to wiązanie metaliczne. Jest ono podobne do wiązania walencyjnego (atomowego) z tą różnicą, że pojawia się między atomami pierwiastków elektrododatnich, a więc wtedy, gdy liczba elektronów walencyjnych jest mała (a konkretnie: mniejsza niż 4).
Z powyższego stwierdzenia wynika, że w celu wyjaśnienia istoty wiązania metalicznego posłużyć można się modelem atomu Bohra. Robię to świadomie, mimo iż współczesny fizyk zapewne by zaprotestował. To uproszczenie, zwane fachowo działaniem heurystycznym, pozwala jednak obrazowo wyjaśnić takie zjawiska jak na przykład zmiany przewodności elektrycznej metali w funkcji temperatury oraz wykazać, że wiązanie metaliczne utrzymuje metal w przestrzennie skoordynowanych układach.
Istota wiązania walencyjnego
W przypadku, gdy liczba elektronów walencyjnych jest mniejsza od 4, powstanie par elektronowych nie zapewnia ośmioelektronowej powłoki zewnętrznej. Jeżeli jednak atom takiego pierwiastka otoczy większa liczba podobnych mu atomów, to elektrony walencyjne każdego z nich znajdują się przejściowo pomiędzy „swoim” atomem a jakimś jego sąsiadem. Te wolne elektrony wiążą się chwilowo z wolnymi elektronami „od sąsiada” - między tymi dwoma atomami tworzy się właśnie wiązanie kowalencyjne - by w następnym momencie utworzyć wiązanie z kolejnym atomem-sąsiadem.
W ten sposób elektrony walencyjne stają się własnością wspólną, przechodzą od jednego atomu do drugiego. Jest to tym łatwiejsze, że elektrony walencyjne w pierwiastkach elektrododatnich są słabo związane zresztą atomu.
Istota wiązania metalicznego
Wiązanie metaliczne jest zasadniczo nienasyconym wiązaniem kowalencyjnym umożliwiającym połączenie dużej liczby atomów przez kolektywizację, czyli uwspólnienie ich elektronów walencyjnych. W sposób uproszczony wiązanie metaliczne można wyobrazić sobie jako wynik elektrodynamicznego oddziaływania występującego pomiędzy elektronami walencyjnymi i kationami (dodatnimi jonami). Te ostatnie nazywane są rdzeniami atomowymi i są pozbawione elektronów na powłoce zewnętrznej, natomiast skolektywizowane elektrony nazywane są gazem elektronowym, co zawdzięczają swojej zdolności do swobodnego poruszania się.
Obecność w metalach swobodnych elektronów pociąga za sobą dobre przewodnictwo elektryczne, które może być ograniczone przez drgania cieplne rdzeni atomowych.
W metalach współistnienie innych rodzajów wiązań wraz z wiązaniem metalicznym pociąga za sobą zmniejszenie intensywności cech metalicznych, a więc np. brak plastyczności, zmniejszenie przewodności elektrycznej itp.
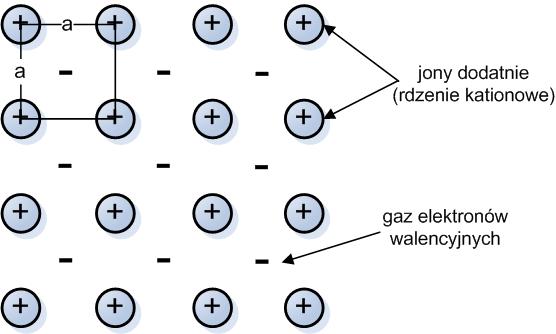
Z takich właśnie powtarzalnych „tworów” zbudowane są metale i stopy. Na rys.3.1 widać jedną płaszczyznę obsadzoną w sposób powtarzalny jonami dodatnimi. Środki ciężkości tych jonów w lewym górnym rogu schematu połączono liniami uzyskując kwadrat o boku długości a . Wyobraźmy sobie teraz, że w odległości a za kartką papieru i w odległości a przed tą kartką leżą płaszczyzny z identycznie rozłożonymi jonami dodatnimi. Połączmy ze sobą ich środki ciężkości i wtedy łatwo ujrzysz, Człowieku z wyobraźnią przestrzenną, dwa stykające się ze sobą sześciany. W ten sposób wyodrębniliśmy dwie komórki elementarne (sześcienne) sieci krystalicznej.
rys.3.1: Schemat wiązania metalicznego.
Sieci krystaliczne metali
Podstawową cechą stanu krystalicznego jest regularne i powtarzalne rozłożenie atomów w przestrzeni. Z cechy tej wynika fakt, że w krysztale każdy atom sąsiaduje z tą samą liczbą najbliższych atomów usytuowanych w jednakowej od niego odległości. Dążenie atomów (jonów) metalu do możliwie bliskiego i zwartego ułożenia w przestrzeni sprawia, że liczba spotykanych kombinacji wzajemnego ułożenia atomów metalu w kryształach jest niewielka. Ze wspomnianej w poprzednim zdaniu bliskości ułożenia wynika też inna cecha metali, a mianowicie fakt, że metale mają większą gęstość właściwą niż niemetale.
Najczęściej brane pod uwagę kombinacje wzajemnego ułożenia atomów w sieci krystalicznej są następujące:
|
|
(A3 - np. grafit) sieć Fe3C (cementyt) |
rys.3.2: Wybrane typy sieci krystalicznych metali.
Kilka słów o otrzymywaniu i obróbce metali
Metale otrzymujemy z rud metali, które są najczęściej tlenkami, dlatego też procesy metalurgiczne polegają zwykle na redukcji (która doprowadza do ekstrakcji metalu z rudy) oraz rafinacji (która usuwa z metalu zanieczyszczenia pozostałe po redukcji).
Zwykle części metaliczne wytwarzamy na drodze odlewania, przeróbki plastycznej lub obróbki skrawaniem lub też poprzez połączenie tych technologii. Coraz częściej, szczególnie w przypadku stopów będących fazami międzymetalicznymi, wykorzystuje się typową dla materiałów ceramicznych technologię spiekania.
Bardzo często zachodzi potrzeba nadania powierzchni części metalicznych szczególnych właściwości np. zwiększających ich odporność na ścieranie lub też poprawiających ich odporność na korozję. W tym celu możemy zmienić budowę fazową powierzchni przez zmodyfikowanie jej składu chemicznego. Problemami tymi zajmuje się dział inżynierii materiałowej zwany inżynierią powierzchni.
Polimery i tworzywa sztuczne
Nader często określenia polimer i tworzywo sztuczne traktowane są jako tożsame i stosowane są wymiennie. Należy jednak zwrócić uwagę na fakt, że w istocie polimer to tylko jeden ze składników tworzywa sztucznego. W skład tworzywa sztucznego (potocznie mówiąc: plastiku) oprócz polimeru wchodzą także różne inne dodatki:
Tworzywo sztuczne = polimer + [napełniacze + zmiękczacze + + stabilizatory + barwniki + środki smarujące] |
Polimery - są minerałami organicznymi złożonymi ze związków węgla, wodoru i innych pierwiastków (z górnego rogu układu okresowego: N, O, F, Si, S, Cl). Są one makrocząsteczkami powstającymi w wyniku połączenia wiązaniami walencyjnymi w łańcuch wielu grup atomowych zwanych monomerami. Najbardziej ogólnie polimery podzielić można na polimery naturalne i syntetyczne (sztuczne).
Polimery naturalne (tzw. biopolimery) są jednym z podstawowych budulców organizmów żywych produkowanych przez nie same. Każdy z Was na pewno wie o polisacharydach: celuloza, skrobia, pektyna, chityna, glikogen itp., polinukleotydach: DNA i RNA, polipeptydach czyli białkach lub słyszał o ligninie, inulinie, kauczuku czy melaninie.
Polimery syntetyczne są podstawowym budulcem tworzyw sztucznych, a także wielu innych powszechnie wykorzystywanych produktów chemicznych takich jak: farby, lakiery, oleje przemysłowe, środki smarujące, kleje itp.
rys.4.1: Schemat prostoliniowego odcinka łańcucha polietylenu. (Cały łańcuch może zawierać 50000 podstawowych jednostek monomerycznych.)
Prosty monomer jest cząsteczką etylenu C2H4. Jeśli atomy H w tych cząsteczkach zastąpimy:
związkiem CH3 - otrzymamy polipropylen;
związkiem C6H5 - otrzymamy polistyren;
pierwiastkiem N (azot) - otrzymamy nylon;
pierwiastkiem Si (krzem) - otrzymamy silikon;
pierwiastkiem F (fluor) - otrzymamy fluoroplastik;
zastąpienie wszystkich atomów H przez atomy F (fluor) w monomerze powoduje uzyskanie politetrafluoroetylenu czyli teflonu.
Podstawowe właściwości polimerów
Mała gęstość
Słabo odbijają światło i są zwykle przezroczyste.
Wiele polimerów jest giętkich i odkształcalnych, lecz nie nadają się do pracy w podwyższonych temperaturach.
Są zazwyczaj izolatorami cieplnymi i elektrycznymi.
Podstawowe grupy polimerów
Otrzymywanie polimerów
Materiały ceramiczne
Definicja i klasyfikacja ceramiki
Właściwości materiałów ceramicznych
Wysoką twardością i kruchością
Odpornością na działanie wysokich temperatur i agresywności środowiska (większą od metali)
Tendencją do przezroczystości
Małą przewodnością i rozszerzalnością cieplną
W zasadzie są izolatorami
Jak wytwarza się ceramikę?
Szkła
Budowa szkieł
Właściwości szkieł
Włókna szklane:
włókna szklane E zawierające aluminioborokrzemian wapnia i stężenie alkalinów mniejsze od 2% o ogólnych zastosowaniach i wymaganej wysokiej wytrzymałości i rezystywności
włókna szklane S zawierające aluminiokrzemian magnezu o wysokiej wytrzymałości na rozciąganie głównie o zastosowaniach militarnych
włówna szklane C sodowo-wapniowo-borokrzemianowe ze względu na stabilność chemiczną stosowane w środowisku korozyjnym i w materiałach kompozytowych kompozytowych kontaktujących się lub zawierającycj materiały kwaśne.
Ceramika szklana
Materiały kompozytowe
Wytwarzanie i zastosowanie kompozytów
Budowa i właściwości kompozytów
Dwa słowa podsumowania
Maciej W. Grabski, Jan A. Kozubowski - „Inżynieria materiałowa: geneza, istota, perspektywy“, Oficyna Wydawnicza Politechniki Warszawskiej, Warszawa 2003;
Leszek A. Dobrzański - „Podstawy nauki o materiałach i metaloznawstwo“, WNT, Gliwice-Warszawa 2002;
Grzegorz Pękalski - „Podstawy metaloznawstwa - raport dydaktyczny“, Wrocław 1993, IMMT
Od 0,83 g/cm3 do 2,29 g/cm3, dla porównania żelazo Fe ma gęstość 7,87 g/cm3.
Punkty 3 i 4 wymagają obecnie pewnego rozbudowania i uzupełnienia.
Ad.3) Dla większości popularnych tworzyw sztucznych zakres temperatur ciągłego stosowania mieści się w przedziale -200oC do +260oC. W nowoczesnych kotłach energetycznych pojawiły się już propozycje ochrony przed korozją rur ze stali niestopowej (węglowej) za pomocą żywic polimerowych na bazie fenolu (polifluorowęglowodory), które mogą pracować w zakresie temperatur pomiędzy 250 a 300 oC.
Ad.4) należy wspomnieć, że w latach '80 i '90 XX wieku w wyniku badań powstały tworzywa sztuczne, które przewodzą prąd elektryczny np. poliacetylen, polipirol, politiofen, poli-para-fenylen, polianilina). Znalazły one już zastosowanie praktyczne. Zatem nie można już dzisiaj twierdzić jednoznacznie, że tworzywa sztuczne nie nadają się do pracy w podwyższonych temperaturach. Warto też zapamiętać, że mogą one być stosowane w temperaturach obniżonych - nawet do -200 oC, czyli w temperaturze, w której wiele tworzyw metalicznych traci swoje właściwości stając się kruchymi.
Wspomniany tutaj został już najbardziej podstawowy podział polimerów na polimery naturalne i syntetyczne. Warto dokonać też kilku innych klasyfikacji. Ze względu na własności użytkowe polimery dzielą się na plastomery i elastomery.
rys.4.2: Podział polimerów ze względu na właściwości użytkowe.
Plastomerami - są polimery charakteryzujące się rozerwaniem przy wydłużaniu zwykle nie przekraczającym 200% (choć polietylen lub polipropylen wykazują maksymalne wydłużenie rzędu kilkuset procent i także zaliczane są do tej grupy). Wśród plastomerów wyróżniamy dwie grupy polimerów: termoplasty (polimery termoplastyczne) i duroplasty (polimery utwardzalne).
Elastomerami - (czyli gumami) nazywamy polimery, które cechuje skłonność do dużych odkształceń sprężystych, które ustępują (całkowicie lub w znacznej części) po odciążeniu (mowa tu o eksperymentach w temperaturze pokojowej). Ta ich właściwość wynika z niewielkiego stopnia usieciowienia elastomeru.
Zwykle surowcem do wytwarzania polimerów jest ropa naftowa. W takim przypadku łączenie monomerów w makrocząsteczki następuje podczas polireakcji tj. polimeryzacji (rys.4.3a), kopolimeryzacji, polikondensacji (rys.4.3b) lub poliaddycji (rys.4.3c). Polimery można również otrzymywać w wyniku modyfikacji polimerów naturalnych (np. pochodnych celulozy).
a) polimeryzacja
b) polikondensacja
c) poliaddycja
rys.4.3: Sposoby otrzymywania polimerów.
Ceramikę stanowią materiały nieorganiczne o wysokotemperaturowych procesach związanych z przebiegiem nieodwracalnych reakcji.
Najłatwiej więc jest zdefiniować ceramiki przez wykluczenie: są to niemetaliczne niepolimery.
Najogólniej do materiałów ceramicznych można zaliczyć: ceramikę inżynierską, cermetale, ceramikę porowatą, szkła, ceramikę szklaną. Do tej grupy materiałów zaliczane są również szkła, beton, cement - pomimo że przy ich wytwarzaniu nie zachodzą wszystkie z tych procesów. Do ceramiki zaliczamy także diament (składający się z połączonych kowalencyjnie atomów węgla oraz krzem i german, które mają takie same jak diament sieci krystaliczne. Ceramikę stanowi także „zwykły” kryształ lodu, w którym dominują wiązania wodorowe.
W skład ceramiki mogą wchodzić liczne pierwiastki metaliczne połączone z siedmioma pierwiastkami niemetalicznymi (B, C, N, O, Si, P, S).
rys.5.1: Ogólna klasyfikacja i przykłady zastosowań materiałów ceramicznych.
Większość materiałów ceramicznych charakteryzuje się:
Ponieważ charakter wiązań decyduje, że elektrony są unieruchomione.
Powyższe cechy wynikają z natury występujących w ceramice wiązań jonowych, jonowo-kowalencyjnych lub kowalencyjnych. Dzięki temu powstaje uporządkowana struktura krystaliczna, w której poszczególne rodzaje atomów zajmują ściśle określone położenia.
Ad.1.) Dzięki naturze występujących wiązań, ceramiki charakteryzują się wysoką wytrzymałością (duża twardość). Jednak wytrzymałość ta nie jest związana (tak jak w przypadku metali) z plastycznością, ze względu na znacznie większą odporność na działanie sił ścinających. Bowiem w przeciwieństwie do metali, przemieszczenie względem siebie płaszczyzn krystalicznych prowadzi w większości ceramik do zmiany rozłożenia ładunku elektrycznego, czemu przeciwstawiają się siły kulombowskie. Dzięki temu odpowiedzią materiału na przyłożone naprężenie będzie nie odkształcenie plastyczne, ale pęknięcie. Ten fakt w połączeniu z występowaniem w ceramice mikroszczelin (które są dogodnymi miejscami inicjacji pęknięć) stanowi powód kruchości ceramiki.
Ad.2.) Przenoszenie ciepła jest również utrudnione, ponieważ energia cieplna w całości musi być przenoszona przez drgania cieplne atomów, co jest znacznie powolniejszym procesem niż transport elektronowy (charakterystyczny dla metali). Przyczyna odporności ceramik na działanie wysokich temperatur (żaroodporność) i oddziaływanie agresywnych środowisk wynika nie tylko z siły wiązań, ale i z tego, że składa się ona zwykle z silnie utlenionych związków.
Ad.3.) Mało ruchliwe elektrony w ceramice mają niewielkie możliwości dopasowania swoich drgań do częstotliwości światła i przez to słabo absorbują promieniowanie widzialne. Dzięki temu ceramika wykazuje tendencję do przezroczystości - szczególnie gdy ma postać monokrystaliczną.
Ceramika polikrystaliczna, którą wytwarza się na drodze spiekania proszku, nigdy nie jest w pełni jednorodna, gdyż jej mikrostruktura zawiera znaczną liczbę drobnych mikroszczelin, które przyczyniają się do rozproszenia światła i zmniejszenia przezroczystości.
Istnieją znaczne możliwości manipulowania strukturą elektronową ceramik, co pozwala na otrzymanie w nich właściwości półprzewodnikowych (krzem, german), a nawet nadprzewodnictwa (YBa2Cu3O7).
Ceramikę wytwarzało się dawniej z surowców mineralnych (ceramika klasyczna), a obecnie coraz częściej wytwarza się ją na drodze syntezy substancji nie występujących w stanie naturalnym. Podobnie jak w przypadku tworzyw metalicznych o budowie fazowej, i możliwościach zastosowań tworzyw ceramicznych można sądzić na podstawie odpowiednich wykresów równowagi fazowej. Przykłady takich wykresów pokazane są na rysunkach 5.2 - 5.4.
|
|
rys.5.2: Dwuskładnikowy wykres równowagi fazowej Al2O3 - Cr2O3 .
|
rys.5.3: Dwuskładnikowy wykres równowagi fazowej SiO2 - Al2O3 .
|
rys.5.4: Trójskładnikowy wykres równowagi fazowej skaleń - glina - krzemionka.
Można również otrzymać ceramikę amorficzną (szkła ceramiczne).
Szkła mogą być uważane za odmianę materiałów ceramicznych, pomimo przewagi struktury bezpostaciowej nad krystaliczną. Stan struktury szkieł jest pośredni między stanami ciekłym i stałym. Stan ten nie jest stanem równowagi i jest osiągany przez powstrzymanie krystalizacji, w wyniku szybkiego chłodzenia w zakresie temperatury krzepnięcia, zapewniającej powstanie fazy krystalicznej w razie powolnego chłodzenia w warunkach zbliżonych do równowagowych. Szkło podlega odkształceniu (dewitryfikacji) stając się materiałem krystalicznym, lecz okres ten trwa minimum kilkaset lat.
Podstawowymi składnikami szkłotwórczymi są trzy tlenki kwasowe SiO2 , B2O3 i P2O5 , tlenki arsenu i germanu a także siarka, selen i fluorek ołowiu. W skład szkła, oprócz składników szkłotwórczych mogą wchodzić modyfikatory wiązań sieci przestrzennej oraz tlenki pośrednie.
Patrz: tab.5.1: Skład chemiczny i zastosowanie niektórych szkieł.
rys.5.5: Sieć SiO2.
Szkło jest izolatorem elektrycznym, a także cechuje się bardzo małą przewodnością cieplną. Szkło może być hartowane termicznie lub chemicznie lub też umacniane chemicznie niskotemperaturowo, co zapewnia umocnienie szkła lub jego powierzchni.
Szkło jest przezroczyste dla światła widzialnego, a współczynnik załamania światła może być regulowany przez odpowiednie dodatki tlenków np. ołowiu. Podobnie można zmieniać zabarwienie przez dodatki tlenków metali.
Patrz: tab.5.2: Właściwości szkieł.
rys.5.6: Wpływ różnych składników na właściwości szkieł (opracowano wg V.A.Greenhuta)
Przez wyciskanie ciekłego szkła przez oczko o średnicy 0,793-3,175 mm i następnie szybkie ciągnienie otrzymywane są ciągłe włókna szklane o końcowej średnicy 3-20 µm. Wydzielić można kilka typów włókien szklanych o różnym składzie chemicznym zapewniającym wymagane właściwości:
Patrz:
tab.5.3: Udział tlenków w różnych typach włókien szklanych stosowanych w materiałach kompozytowych.
tab.5.4: Orientacyjne właściwości mechaniczne różnych typów włókien szklanych.
Ceramika szklana (inne nazwy dewitryfikaty, pyroceramika) powstaje przez krystalizację (odszklenie) masy szklanej w ściśle określony sposób, umożliwiający utworzenie struktury bardzo drobnoziarnistej, bez porowatości, z pozostałością tylko ok.2% fazy szklistej.
Otrzymuje się ją w wyniku krystalizacji szkła na zarodkach tworzonych przez niewielkie dodatki Cu, Ag lub Au pod wpływem promieniowania ultrafioletowego. Możliwe jest również uzyskanie podobnych materiałów przez dodatki katalizatorów np. platynowców lub tlenków tytanu podczas obróbki cieplnej i bez konieczności napromieniowania. Materiały te mają dobre własności mechaniczne i lepszą odporność na udary cieplne znacznie większe od szkieł, a niektóre własności lepsze od ceramiki inżynierskiej.
Wyróżnia się 5 podstawowych typów ceramiki szklanej w zależności od obecności podstawowej fazy krystalicznej.
Patrz: tab.5.5: Orientacyjne składy chemiczne niektórych typów ceramiki szklanej (wg J.F.Shackelforda, W.Alexandra i J.S.Parka).
Rodzaj szkła |
Udział masowy [%] |
Uwagi |
|||||||||
|
SiO2 |
Na2O |
K2O |
CaO |
MgO |
BaO |
PbO |
B2O3 |
Al2O3 |
TiO2 |
|
Szkło sodowo-wapienne |
71-73 |
12-14 |
|
10-12 |
1-4 |
|
|
|
0,5-1,5 |
|
Łatwe do wytworzenia, ma szerokie zastosowanie w nieco różniących się odmianach na szyby okienne, zbiorniki i żarówki elektryczne |
Szkło ołowiowe |
63-65 |
7,6 |
6-7,2 |
0,3 |
0,2 |
|
21-58 |
0,2 |
0,6 |
|
Łatwo topliwe i łatwe do wytwarzania, o dobrych właściwościach elektrycznych. Przy dużej zawartości ołowiu absorbuje promieniowanie, dobrze załamuje światło i służy do wyrobu soczewek chromatycznych; dekoracyjne kryształy. |
Szkło boro-krzemianowe o małej rozszerzalności |
80,5 |
3,8 |
0,4 |
|
|
|
|
12,9 |
2,2 |
|
Mała rozszerzalność, dobra odporność na udary cieplne i stabilność chemiczna; szerokie zastosowanie w przemyśle chemicznym. |
Szkło glino-krzemianowe |
57 |
12-14 |
|
5,5 |
12 |
|
|
4 |
20,5 |
|
Wytrzymałość na wysokie temperatury, mała rozszerzalność. |
Krzemionka |
99,5 |
|
|
|
|
|
|
|
|
|
Trudnotopliwa i trudna do wytworzenia, lecz może być stosowana do 1000oC; bardzo mała rozszerzalność i duża odporność na udar cieplny. |
Ceramika szklana |
40-70 |
|
|
|
10-30 |
|
|
|
10-35 |
7-15 |
Ceramika drobnokrystaliczna otrzymana przez dewitryfikację szkła; łatwa do wytworzenia jako szkło; dobre właściwości; różne szkła i katalizatory. |
|
|
|
|
|
|
|
|
|
|
|
|
Szkło borokrzemianowe o małej stratności dielektrycznej |
70 |
|
05 |
|
|
|
1,2 |
28 |
1,1 |
|
Małe straty elektryczne |
Szkło glinoborokrzemianowe aparaturowe |
74,7 |
6,4 |
0,5 |
0,9 |
|
2,2 |
|
9,6 |
5,6 |
|
Podwyższony udział tlenku aluminium i mniejszy udział tlenku boru poprawiają trwałość chemiczną. |
Szkło glinoborokrzemianowe E o małej zawartości alkalii |
54,7 |
0,5 |
|
22 |
|
|
|
8,5 |
14,5 |
|
Szerokie zastosowanie na włókna w kompozytach z polimerów tworzyw sztucznych wzmocnionych szkłem. |
Krzemionka 96% |
96,3 |
<0,2 |
<0,2 |
|
|
|
|
2,9 |
0,4 |
|
Otrzymywana z dość miękkiego szkła borokrzemianowego, ogrzewana w celu oddzielania faz SiO2 i B2O3. Ługowana kwasem fazy B2O3, ogrzewana w celu zasklepienia porów. |
tab.5.1: Skład chemiczny i zastosowanie niektórych szkieł.
Właściwości |
Szkło sodowo-wapienne |
Szkło ołowiowe |
Szkło borokrzemianowe |
Krzemionka 96% |
Krzemionka |
Gęstość |
5 |
6 |
4 |
2 |
1 |
Wytrzymałość |
2 |
2 |
4 |
5 |
6 |
Obrabialność cieplna |
4 |
6 |
3 |
2 |
1 |
Odkształcalność na gorąco |
4 |
4 |
1 |
- |
- |
Odporność na udarowe ścieranie |
3 |
1 |
4 |
4 |
6 |
Odporność na udary cieplne |
2 |
2 |
4 |
5 |
6 |
Rezystywność elektryczna |
4 |
6 |
4 |
4 |
4 |
Odporność chemiczna |
1 |
3 |
4 |
5 |
6 |
Przepuszczalność promieniowania nadfioletowego |
1 |
1 |
3 |
4 |
4 |
Względny koszt |
1 |
2 |
4 |
5 |
6 |
|
|
|
|
|
|
1 - złe lub najniższe; 2 - słabe lub niskie, 3 - wystarczające, 4 - dobre lub średnie, 5 - bardzo dobre lub wysokie, 6 - najlepsze lub najwyższe |
|||||
tab.5.2: Właściwości szkieł.
Rodzaj tlenku |
Udział masowy we włóknach szklanych danego typu [%] |
||
|
E |
S |
C |
SiO2 |
52-56 |
65 |
64-68 |
Al2O3 |
12-16 |
25 |
3-5 |
B2O3 |
5-10 |
- |
4-6 |
Na2O ; K2O |
0-2 |
- |
7-10 |
MgO |
0-5 |
10 |
2-4 |
CaO |
16-25 |
- |
11-15 |
BaO |
- |
- |
0-1 |
TiO2 |
0-1,5 |
- |
- |
Fe2O3 |
0-0,8 |
- |
0-0,8 |
Fe |
0-1,5 |
- |
- |
tab.5.3: Udział tlenków w różnych typach włókien szklanych stosowanych w materiałach kompozytowych.
Typ włókna szklanego |
Gęstość [g/cm3] |
Wytrzymałość na rozciąganie [MPa] |
Moduł sprężystości wzdłużnej w 540oC [GPa] |
Wydłużenie [%] |
|||
|
|
w ~190oC |
w 25oC |
w 370oC |
w 540oC |
|
|
E |
2,62 |
5310 |
3445 |
2630 |
1725 |
81,3 |
4,88 |
S |
2,5 |
8275 |
4585 |
4445 |
2415 |
88,9 |
5,7 |
C |
2,56 |
5380 |
3310 |
- |
- |
- |
4,8 |
tab.5.4: Orientacyjne właściwości mechaniczne różnych typów włókien szklanych.
Typy ceramiki szklanej |
Orientacyjny udział masowy składników [%] |
|||||||
|
SiO2 |
LiO2 |
Al2O3 |
MgO |
ZnO |
B2O3 |
TiO2 |
P2O5 |
LiO2 - Al2O3 - SiO2 |
74 |
4 |
16 |
- |
- |
- |
6 |
- |
MgO - Al2O3 - SiO2 |
65 |
- |
19 |
9 |
- |
- |
7 |
- |
LiO2 - MgO - SiO2 |
73 |
11 |
- |
7 |
- |
6 |
- |
3 |
LiO2 - ZnO - SiO2 |
58 |
23 |
- |
- |
16 |
- |
- |
3 |
tab.5.5: Orientacyjne składy chemiczne niektórych typów ceramiki szklanej (wg J.F.Shackelforda, W.Alexandra i J.S.Parka).
Materiał kompozytowy jest kombinacją dwóch lub więcej materiałów (elementy wzmacniające, wypełniacze i lepiszcze stanowiące osnowę kompozytu) różniących się rodzajem lub składem chemicznym w skali makroskopowej. Składniki materiałów kompozytowych zachowują swoją tożsamość, ponieważ całkowicie nie rozpuszczają się w sobie, jak również nie łączą się w inne elementy, natomiast oddziałują wspólnie. Zwykle składniki te mogą być identyfikowalne fizycznie i wykazują powierzchnie rozdziału między sobą.
Materiały kompozytowe są zwykle sztucznie wytwarzane dla uzyskania właściwości, które nie mogą być uzyskane oddzielnie przez żaden z występujących składników.
Stosuje się je nie tylko w celu zapewnienia odpowiednich właściwości mechanicznych, lecz również elektrycznych, cieplnych, trybologicznych, związanych z pracą w różnych środowiskach i innych istotnych cech. Znajdują współczesne zastosowanie między innymi w sprzęcie kosmicznym, samolotach, samochodach, łodziach, jachtach, szybowcach i sprzęcie sportowym.
Najbardziej powszechne zastosowanie kompozytów związane jest z naśladowaniem znanych z przyrody naturalnych rozwiązań, zapewniających niedoścignione połączenie ogromnej sztywności konstrukcji z jej jednoczesną lekkością. Przykładami takich niezwykłych z mechanicznego punktu widzenia „konstrukcji” może być kość, trzcina lub pokazane na rysunku poniżej drewno (naturalny kompozyt).
rys.6.1: Struktura drewna: a) przekrój pnia drzewa, b) wycinek przedstawiający słój roczny, c) struktura ścianki komórki drewna, d) schemat mikrofibryli
Drewno może być traktowane jako kompleksowy materiał kompozytowy wzmacniany włóknami, złożony z długich, jednoosiowo zorientowanych komórek polimerowych w osnowie polimerowej. Pory tych komórek wypełnione są powietrzem i wodą (w proporcjach zmieniających się w zależności od warunków otoczenia, a głównie wilgotności). Układ ten zapewnia bardzo dobre właściwości wytrzymałościowe w kierunku wzdłużnym. Drewno, materiał kompozytowy, stosowane jest przez człowieka od bardzo dawna.
Najczęściej zawierają włókna lub cząsteczki faz i są sztywniejsze i bardziej wytrzymałe niż ciągła faza osnowy. Wiele elementów wzmacniających zapewnia im także dobrą przewodność cieplną i elektryczną oraz niższy współczynnik rozszerzalności cieplnej oraz/lub dobrą odporność na zużycie.
Materiały kompozytowe dzielą się ze względu na osnowę metalową, polimerową lub ceramiczną.
rys.6.2: Klasy materiałów kompozytowych.
Faza powodująca wzmocnienie kompozytów (nazywana także zbrojeniem) może być wprowadzona w postaci drobnych cząsteczek (niekiedy dyspersyjnych), krótkich (nieciągłych) włókien lub płatków, włókien ciągłych a także innych form.
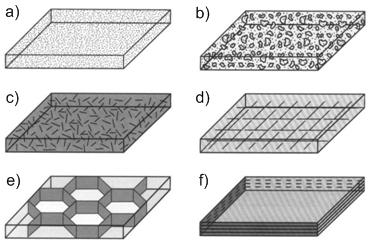
Rodzaje wzmocnień (zbrojeń) w kompozytach:
a) cząsteczki dyspersyjne
b) płatki
c) włókna nieciągłe
d) włókna ciągłe w postaci tkaniny
e) szkieletowe
f) warstwowe w laminatach
rys.6.3: Różne rodzaje wzmocnień występujących w materiałach kompozytowych.
Mam nadzieję, że ten materiał rzeczywiście będzie dla Was skuteczną pomocą naukową. Na koniec jeszcze jedna tabela z bardzo ogólnym podsumowaniem tego, o czym właśnie przeczytaliście:
Grupa |
Materiały |
Metale i ich stopy |
- żeliwo, stale i staliwa (stopy żelaza i węgla) |
|
- aluminium, miedź, nikiel, tytan i ich stopy |
Tworzywa sztuczne |
- polietylen (PE) |
|
- polimetaakrylan metylu (PMMA, pleksiglas) |
|
- nylon |
|
- polistyren (PS), poliuretan (PU) i polichlorek winylu (PVC) |
|
- gumy |
Ceramika |
- tlenki glinu (Al2O3, papier ścierny, szafir) |
|
- tlenek magnezu (magnezja MgO) |
|
- dwutlenek krzemu (krzemionka SiO2, szkła i krzemiany) |
|
- węglik krzemu (SiC) i azotek krzemu (Si3N4) |
|
- cement i beton |
Kompozyty |
- drewno |
|
- polimery zbrojone włóknem szklanym (GFRP) lub węglowym (CFRP) |
|
- polimery z wypełniaczami (cermetale) |
tab.7.1: Podstawowy podział materiałów inżynierskich.
Materiał ten jest moim uzupełnieniem, opracowaniem i niewielkim uaktualnieniem notatek do wykładów dostarczanych studentom w ubiegłych latach przez doc. dr inż. Grzegorza Pękalskiego, wykonanym zresztą na Jego prośbę. Został on opracowany na podstawie następujących książek:
Na koniec pozostaje mi pogratulować wytrwałości i sumienności tym, którzy doczytali do tego miejsca już teraz, zaś tym, którzy jednak odłożyli to aż do sesji :) - mam nadzieję, że przysłowiowe 3Z nie stanie się udziałem aż wszystkich informacji, które tu przedstawiliśmy.
Powodzenia!
Milena
Przykładowo: miedź ma bardzo przewodnictwo elektryczne, ale mangan już znacznie gorsze. Srebro jest bardzo plastyczne, natomiast mangan bardzo kruchy. Zdarza się także, żę niemetale wykazują niektóre z wymienionych charakterystycznych cech metali. Dobrym przykładem będzie tutaj grafit, który ma wysokie (i często wykorzystywane w praktyce) przewodnictwo elektryczne - i to w dodatku z charakterystycznym dla metali dodatnim współczynnikiem temperaturowym, a jednocześnie nie wykazuje innych cech metali.
Obecnie opis budowy atomu opiera się na mechanice kwantowej, zgodnie z którą stan energetyczny każdego elektronu jest określony czterema liczbami kwantowymi, pęd elektronu ma pewien zakres nieoznaczoności, ruch elektronów może być traktowany jako fala, a położenie elektronów traktuje się w kategoriach prawdopodobieństwa. Głównym sukcesem mechaniki kwantowej była interpretacja subtelnych linii widmowych, których nie można było wyjaśnić w oparciu o model atomu Bohra.
Zwane też „elektronami wartościowości”.
Jakimi są metale (leżące w lewej części układu okresowego).
Drgania te (występujące w wyższych temperaturach) utrudniają przemieszczanie się elektronów. Natomiast w niskich temperaturach natomiast amplituda drgań rdzeni atomowych szybko maleje, zaś to jest przyczyną wzrostu przewodności elektrycznej tych materiałów. W niektórzych metalach (a konkretnie w około 30 rodzajach) w bardzo niskich temperaturach (T< 20 K) występuje zjawisko nadprzewodnictwa.
„Meros” po grecku oznacza „część”.
Pozwólcie, że tylko hasłowo wspomnę, aby zatrzymać ten fakt w Waszej pamięci: wyświetlacze LCD, billboardy, zwijane (tak!) telewizory, przewodzące lub/i świecące folie, składniki sensorów biologicznych i elektrochemicznych, diody LED i fotowoltaiczne (ogniwa słoneczne), tranzystory polowe, ogniwa woltaiczne, kondensatory... i te przykłady można by jeszcze mnożyć, ale zainteresowani na pewno sami dotrą do podobnych ciekawostek.
Słowo ceramika pochodzi z martwego już języka sanskryckiego od słowa „keramos” oznaczającego „rzecz otrzymaną w wyniku działania ognia”. Odnosi się więc w zasadzie nie do natury tego materiału, ale do technologii jego wytwarzania.
Na pierwszy rzut oka podana klasyfikacja może wydawać się nierozsądna. Jednak pamiętajcie, że piękny, przezroczysty kryształ szafiru jest dokładnie tym samym materiałem co tradycyjnie zaliczany do ceramik izolator świecy samochodowej. Różnica między nimi polega (nie licząc ceny oczywiście!) wyłącznie na mikrostrukturze. Szafir bowiem jest naturalnie lub sztucznie wyhodowanym monokryształem domieszkowanego Al2O3, zaś izolator świecy samochodowej to polikryształ zbudowany ze wzajemnie zespolonych, różnie zorientowanych maleńkich ziarn, dodatkowo zawierających wiele zanieczyszczeń, co w sumie skutkuje zmniejszeniem jego przezroczystości.
Ale niektóre wykazują właściwości półprzewodnikowe, a niedawno odkryte wysokotemperaturowe nadprzewodniki również są ceramikami.
Otrzymuje się je w postaci bardzo drobnych proszków poddawanych następnie precyzyjnym procesom zagęszczania i wysokotemperaturowego spiekania (często w warunkach wysokiego ciśnienia hydrostatycznego) w celu nadania materiałowi odpowiedniego kształtu lub też procesowi krystalizacji (przy wykonywaniu monokryształów). Przykładem może tu być azotek boru (BN).
Ta część opracowania może wydać Wam się wybitnie przeładowana trudnymi do zapamiętania rysunkami i tabelami, ale wszystko to znalazło się tutaj ze względu na pewną trudność w dotarciu do rzetelnych informacji na temat szkieł i może przydać się Wam w przyszłości.
Właściwości kości biorą się z tego, że twardy szkielet (zbudowany z hydroksyapatytu - związku opartego na fosforanie wapnia) zespolony jest w jedną całość miękkimi organicznymi związkami proteinowymi tworząc tym samym lekką i wytrzymałą strukturę komórkową. Właściwości trzciny wynikają z zespolenia sztywnych włókien celulozy przez miękką ligniną.
Mało znanym, a pięknym przykładem ich zastosowania była polska kopia husarska: niezwykle lekka, pusta w środku konstrukcja wykonana z klejonych włókien drewnianych - dlatego mówimy o kruszeniu, a nie łamaniu kopi!
Są jednak wyjątki, które mogą również występować w materiałach kompozytowych, jak polimery modyfikowane kauczukiem, w których nieciągła faza jest bardziej podatna i bardziej ciągliwa niż polimer, co skutkuje zwiększeniem udarności. Podobnie druty stalowe mogą być stosowane do wzmacniania żeliwa szarego w bębnach hamulcowych samochodów ciężarowych i ciągników.
Z tej książki pochodzi większość zamieszczonych tutaj rysunków i tabel. Jeśli chcecie zainwestować na czas studiów w jakąś pozycję literaturową to tutaj macie naprawdę godnego polecenia kandydata.
1
Wyszukiwarka
Podobne podstrony:
Gronostajski,podstawy i techniki wytwarzania II,wielkości fizyczne charakteryzujące środki smarowe o
wzmacniacz operacyjny, Materiały, II Semestr, Podstawy elektroniki
budownictwo, OG LNA CHARAK DREWNA I KONS, Ogólna charak drewna i konstr drew Drewno jest podstaw mat
W1 Charakterystyka materiałów
wzmacniacz operacyjny, Materiały, II Semestr, Podstawy elektroniki
Podstawy stosunkow miedzynarodowych-apdejt, Politologia UMCS - materiały, II Semestr letni, Podstawy
Gronostajski,podstawy i techniki wytwarzania II, Materiały stosowane do wytwarzania form odlewniczyc
Charakterystyka podstawowych grup materia
Laborki 2, Studia, Wytrzymałość materiałów II, Test z laborek wydymalka, lab
quota, !!!Uczelnia, wsti, materialy, II SEM, systemy operacyjne linux
Temat3, Mechanika i Budowa Maszyn PG, semestr 2, Materiałoznawstwo II, laborki
Rekord?nych podstawowych materiału
05 dynamika punktu materialnego II
makro 1, Socjologia, Materiały II rok, Makrostruktury
Metale nieżelazne-GEPARD, AGH, Podstawy Materialoznawstwa
test z wydymałki, Przodki IL PW Inżynieria Lądowa budownictwo Politechnika Warszawska, Semestr 4, Wy
L4 - pytania, Studia, Wytrzymałość materiałów II, lab4 wm2 studek
więcej podobnych podstron