0000092 (3)

bez zmian w otoczeniu. Jest to jeden z aspektów drugiej zasady termodynamiki. Wszelkie procesy ustają, gdy znikną bodźce, układ znajdzie się wtedy w stanie równowagi.
Nasuwa się pytanie, czy istnieje jakieś uniwersalne kryterium pozwalające odróżnić procesy odwracalne od nieodwracalnych, ocenić stopień odchylenia od stanu równowagi, przewidzieć kierunek w jakim rozwinie się proces. Rolę tego rodzaju kryterium spełnia ważna wielkość zwana entropią S. Entropia jest funkcją stanu. Jak energia wewnętrzna U określa stan układu pod względem ilości energii, tak entropia określa go pod względem „jakości” energii, pod względem możliwości jej wykorzystania, np. do wykonania pracy. Zmiana stanu układu pociąga za sobą zmianę entropii o AS, przy czym wielkość tej zmiany zależy od tego, czy proces przebiega odwracalnie czy nieodwracalnie.
Entropia w procesach quasi-statycznych. Entropię S definiuje się tak, żeby jej przyrost AS w procesie quasi-statycznym był równy stosunkowi ilości ciepła AQk dostarczonego ciału do jego temperatury T
AQk
AS = —j— proces quasi-statyczny 4.9
{k oznacza, że proces przekazywania ciepła odbywa się quasi-statycznie).
Przyrost entropii jest dodatni, gdy ciepło zostaje ciału dostarczone z otoczenia; jest ujemny, gdy ciało oddaje ciepło do otoczenia. Jeżeli temperatura w czasie przebiegu procesu ulega zmianie, ilość ciepła dQk dostarczona ciału powinna być tak mała, żeby można było przyjąć, że jego temperatura się nie zmieniła. W takim procesie, zwanym elementarnym, przyrost entropii wyrazi się różniczką
dS =
d Qk T
proces quasi-statyczny, elementarny
W przemianie skończonej, przy przejściu układu ze stanu 1 do 2, zmiana jego entropii AS, wyraża się wzorem
Tx
proces quasi-statyczny, skończony
AS = S2—St =
r,
Można wykazać, że entropia układu izolowanego, w którym zachodzą procesy ąuasi--statycznc nie zmienia się (4.10), czyli że
AS =0, S = const układ izolowany, procesy quasi-statyczne (4.10)
Wykażemy to na przykładzie. Układ składa się z dwóch ciał A i B (ryc. 4.3). Między tymi ciałami zachodzi wymiana ciepła w sposób odwracalny. Ciało A ma temperaturę 7\,
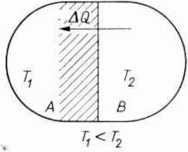
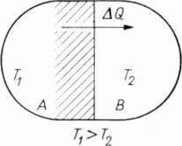
Ryc. 4.3. Wymiana ciepła między ciałami A i B jest odwracalna, jeżeli temperatury i T. różnią się nieskończenie mało; jest nieodwracalna, gdy różnice temperatur są skończone.
7* 99
Wyszukiwarka
Podobne podstrony:
gis1 A--- sTwórzyl EyŁawgTmaayji^ w- ■ mmmJz 2. TIN- WYBIERZ ZDANIE FAŁSZ YWE: ?.. nie jest to jede
1. Transmisja szeregowa Transmisja szeregowa jest to jeden z najtańszych sposobów na przesyłanie dan
11319 P1030016 (2) Jeremy Rifkin bez papieru, „ponieważ jest to bardziej sprawny sposób dostarczania
17851 SNC00135 (2) jest to jeden z najefektywniejszych systemów montażu obiektów wysokościowych o ko
Co to jest “jakość oprogramowania”? Jest to jeden z najbardziej istotnych problemów inżynierii
PROBLEMY FUNKCJONOWANIA DĄSY: Jeśli stwierdzisz, że twój model stale się dąsa, jest to jeden z
Stopa dyskontowa Jest to jeden z głównych parametrów wyceny dochodowej wartości
Budowa, właściwości i zastosowanie TBT Tributylocyna(TBT) jest to jeden z najpowszechniej występując
72075 ScannedImage 22 (2) rzowi Antoninowi Plusowi 1 senatowi powstało w r# 155. Jest to jeden z naj
SDC10123 1 Wybuch i jego parametry Wybuch jest to jeden z rodzajów spalania, a więc źródłem energii
Rzut oszczepem0059 Wegna600 lOOOm czewczęta 1C00—1SC0m — chłopcy. Oczywiście jest to jeden z przykła
Test 1 (4) iCo oznacza dla pielęgniarki być asertywnym. Asertywnośe to skuteczność bez uległości i a
więcej podobnych podstron