CCF20081011�011

Chemia Żywności - własność Katedra Analizy i Oceny Jakości Żywności AR w Krakowie - 2008/2009
mutarotacją. Mutarotacja zachodzi w roztworach. Formy a i p różnią się od siebie skręcalnością optyczną. Forma a-L)- glukozy krystalizuje z wody i wykazuję skręcalność właściwą (a]“ =+112,2 °, a forma p - krystalizująca z pirydyny - [ a]“ = + 19°.
Heksozy w roztworze rozcieńczonego wodorotlenku ulegają specyficznej izomeryzacji zwanej epimeryzacją. Podczas tej przemiany przegrupowaniu ulegają podstawniki przy Ci i C2 -tworząc enodiol, z którego powstają ketoza i 2 aldozy.
Aldozy te są dla siebie epimerami (różna konfiguracja przy tylko jednym z chiralnych atomów węgla) natomiast fruktoza jest dla nich izomerem konstytucyjnym.
Ogrzewanie cukrów w stężonych roztworach ługu powoduje przesunięcie wiązania enolowego w inne pozycje szkieletu węglowego wraz z przemianami polimeryzacyjnymi i degradacyjnymi. Roztwór cukru przybiera barwę żółtą, czerwoną aż do czarnej i wydziela się zapach karmelu (próba Mohra). Cukry nieredukujące nie ulegają tego rodzaju reakcjom.
GLIKOZYDY
Monosacharydy będące hemiacetalami mogą ulegać dalszym reakcjom tworząc acetale, których szczególnym przykładem są glikozydy, których cząsteczki składają się z jednostki cukrowej i aglikonu (np. reszty alkoholu, fenolu, amin, kwasów organicznych). Aglikon może być przyłączony za pośrednictwem atomu tlenu (O-glikozydy), azotu (N-glikozydy), siarki (S-glikozydy). Glikozydami są m.in. nukleozydy (składniki DNA i RNA), antocyjany (barwniki), streptomycyna (antybiotyk).
Dwucukry są glikozydami, w których aglikonem jest reszta cukrowa (holozydy). Jeżeli wiązanie glikozydowe powstaje z połączenia dwóch grup półacetalowych, związek nie wykazuje właściwości redukujących i jest zaliczany do grupy trehalozy a nazwa zakończona jest końcówką „ozyd” (np. sacharoza O-p-D-fruktofuranozylo-a-D-glukopiranozyd). Do grupy maltozy zaliczane są dwucukry powstałe z reakcji grupy hydroksylowej i półacetalowej. Ponieważ drugi półacetal jest wolny, wykazują one właściwości redukujące a nazwa ich zakończona jest końcówką „oza”(np. maltoza 4-O-a-D-glukopiranozylo-a-D-glukopiranoza).
POLARYMETRIA
Wielkość kąta skręcania płaszczyzny światła spolaryzowanego (a) jest proporcjonalna do stężenia danej substancji (p), grubości warstwy roztworu (/) (prawo Biota):
a = k x / x p
gdzie: k — współczynnik zależny od temperatury i długości fali.
Skręcalność właściwa ([«]“) jest to kąt, o który skręca płaszczyznę spolaryzowanego światła sodowego (linia D - 589,3 nm) w temp. 20°C warstwa roztworu o grubości 1 dm zawierającego I g substancji w 1 ml roztworu.
« = [«]»/>/
Jeśli stężenie roztworu p wyrażono w procentach wagowo-objętościowych (c-[g/100 ml]), to:
Znając skręcalność właściwą danej substancji można oznaczyć jej stężenie w roztworze.
Gdy długość rurki jest tak dobrana aby iloczyn jej długości i skręcalności właściwej wynosił 100, to odczytany kąt wyraża procentową zawartość substancji w roztworze. Polarymetry o takiej budowie nazywają się sacharymetrami.
Przed umieszczeniem w polarymetrze rurki z próbką należy ustawić ostrość tak, aby granica między jasnymi i ciemnymi polami w okularze były jak najbardziej wyraźne.
Do użytku wyłącznic przez studentów WTŻ AR w Krakowie na zajęciach z Chemii Żywności - 13/23
Następnie rurkę wypełniona badaną cieczą umieszcza się w polarymetrze.
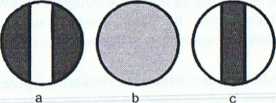
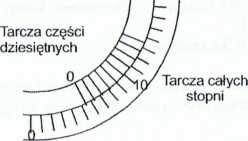
W celu poprawnego odczytania kąta skręcania światła spolaryzowanego, należy tak przekręcić tarczę analizatora, aby pole w okularze było jednolite (pole b). Następnie sprawdzamy pomiędzy którymi działkami tarczy stopni znajduje się działka 0 („zero”) stopni dziesiętnych. Odczytana wartość to liczba całych stopni (5°). Aby odczytać części dziesiąte sprawdzamy, która działka tarczy ułamkowej dziesiętnej(4) pokryła się z działką tarczy jedności. Otrzymany wynik np 5,4°. Pomiar należy powtórzyć trzykrotnie od momentu ustawiania jednolitego pola (b).
PRZEMIANY CHEMICZNE CUKRÓW
Sacharydy mogą ulegać różnym procesom utleniania zależnie od rodzaju utleniacza. Najłatwiej ulega utlenieniu grupa aldehydowa, trudniej utleniana jest grupa hydroksylowa przy atomie węgla C(, (najpierw do aldehydowej a później do karboksylowej) a najtrudniej -drugorzędowe grupy hydroksylowe do grup ketonowych. Przez zastosowanie odpowiednich reagentów (np. HI04) możliwe jest rozerwanie pierścienia między atomami węgla. Produktami utleniania cukrów są:
• kwasy glikonowe (aldonowe, onowc) i ich laktony (wewnątrzczą-steczkowe estry) po utlenieniu grupy aldehydowej aldoz (Ci) pod wpływem wody bromowej i bromianów(I) a próbom Tollensa(Ag7NH,/OI 1) i Trommera (Cu2 7NH,/0I1") ulegają również ketozy,
• kwasy glikarowc (cukrowe) pod wpływem UNO, lub tlenu z katalizatorami platynowymi przez utlenienie obu krańcowych atomów węgla do grup karboksylowych,
• kwasy glikuronowc (uronowc) przez utlenienie atomu C6 do grupy karboksylowej po zablokowaniu grupy aldehydowej Ci,
• kwas oraz aldehyd mrówkowy po rozerwaniu wiązań C-C w przypadku zastosowaniu metajodanu(VII).
Redukcja grupy karbonylowej w cząsteczce monosacharydu prowadzi do uzyskania acyklicznych polialkoholi zwanych alditolami. Ponieważ po redukcji aldoz oba końce łańcucha są symetryczne, niektóre powstałe alditole nie wykazują czynności optycznej (formy muzo), natomiast redukcja ketoz prowadzi do zwiększenia ilości czteropodstawiowych atomów węgla, zatem do zwiększenia ilości związków czynnych optycznie.
Odwodnienie cukrów następuje po wpływem stężonych kwasów mineralnych. Produktem odwodnienia pentoz jest furfural, a heksoz - hydroksymetylofurfural.
Zasady organiczne m.in. fenylohydrazyna (CJ-fNI 1NH,) wchodzą w reakcje kondensacji w grupami karbonylowymi aldoz i ketoz tworząc feny Iohyd rażony np. fenylohydrazon -D-glukozy. W przypadku nadmiaru fenylohydrazyny sąsiednia grupa hydroksylowa (Ci lub C2) ulega utlenieniu do grupy karbonylowej, która następnie reaguje z kolejną cząsteczki tworząc 1,2-difenylohydrazon zwany fenyloosazonem. Czas tworzenia osazonu, kształt kryształów oraz temperatura topnienia jest charakterystyczny i pozwala na identyfikację cukru. Jeżeli dwie heksozy tworzą ten sam osazon, mają identyczną konfigurację atomów C,, C4, C5.
Reakcje utlenienia, redukcji, kondensacji oraz odwodnienia sacharydów są wykorzystywane do analizy jakościowej i ilościowej cukrów:
l)o użytku wyłącznic przez studentów WTŻ AR w Krakowie na zajęciach z Chemii Żywności - 14/23
Wyszukiwarka
Podobne podstrony:
CCF20081011�001 Chemia Żywności - własność Katedra Analizy i Oceny Jakości Żywności AR w Krakowie -
CCF20081011�002 Chemia Żywności - własność Katedra Analizy i Oceny Jakości Żywności AR w Krakowie -
CCF20081011�003 Chemia Żywności - własność Katedra Analizy i Oceny Jakości Żywności AR w Krakowie -
CCF20081011�008 Chemia Żywności - własność Katedra Analizy i Oceny Jakości Żywności AR w Krakowie -
CCF20081011�009 Chemia Żywności - własność Katedra Analizy i Oceny Jakości Żywności AR w Krakowie -
CCF20081011�012 Chemia Żywności - własność Katedra Analizy i Oceny Jakości Żywności AR w Krakowie -
CCF20081011�013 Chemia Żywności - własność Katedra Analizy i Oceny Jakości Żywności AR w Krakowie -
CCF20091010�000 Chemia Żywności - własność Katedra Analizy i Oceny Jakości Żywności IJR w Krakowie -
CCF20091010�001 Chemia Żywności - własność Katedra Analizy i Oceny Jakości Żywności UR w Krakowie -
CCF20091010�002 Chemia Żywności - własność Katedra Analizy i Oceny Jakości Żywności UR w Krakowie— 2
CCF20091010�003 • • Chemia Żywności - własność Katedra Analizy i Oceny Jakości Żywności UR w Krakowi
CCF20091010�003 (2) Chemia Żywności - własność Katedra Analizy i Oceny Jakości Żywności CR w Krakowi
CCF20091010�004 Chemia Żywności - własność Katedra Analizy i Oceny Jakości Żywności UR w Krakowie -
CCF20091010�004 (2) Chemia Żywności - własność Katedra Analizy i Oceny Jakości Żywności UR w Krakowi
CCF20091010�006 Chemia Żywności - własność Katedra Analizy i Oceny Jakości Żywności UR w Krakowie —
CCF20091010�009 Chemia Żywności - własność Katedra Analizy i Oceny Jakości Żywności UR w Krakowie-
CCF20091010�010 Chemia Żywności - własność Katedra Analizy i Oceny Jakości Żywności DR w Krakowie- 2
CCF20091010�013 Chemia Żywności - własność Katedra Analizy i Oceny Jakości Żywności IJR w Krakowie -
więcej podobnych podstron