CCF20100324�003

Wykonanie:
A. Izolacja mitochondriów
Do homogenizacji tkanki i izolacji mitochondriów używamy roztworów schłodzonych w lodówce!!!
5 g tkanki serca drobno pociąć nożyczkami i dodać 5 objętości (25 ml) 10 mM buforu fosforanowego o pH 6,7 zawierający: 0,25 M sacharozę, 1,8 mM CaCl2 i ImM PMSF.
Naczynie z tkanką umieszczamy w lodzie i homogenizujemy w homogenizatorze nożykowym 3 razy po 30 sek. z 30 sekundowymi przerwami.
Uzyskany homogenat sączymy przez 4 warstwy gazy. Do oznaczeń aktywności DB i białka pobieramy lml homogenatu. Pozostałą część i wirujemy przez lOmin przy 1000xg. Supematant delikatnie dekantujemy i ponownie wirujemy przez 20min. przy 10 000xg. Uzyskany osad (w literaturze określany jako frakcja 10P) zawiera mitochondria Osad ten zawieszamy w 4 ml 50mM bufom Tris-HCl pH 7,6 z 0.32 M sacharoza. 4 mM CaCl2 i 25 mM KC1). Do oznaczeń pobieramy lml tej frakcji. Pozostałą część zawiesiny wirujemy jak wyżej. Osad, który zawiera oczyszczone mitochondria zawieszamy w lml 50 mM buforu Tris-HCl pH 7,6. We wszystkich uzyskanych frakcjach oznaczamy stężenie białka i aktywność dehydrogenazy.
B. Obliczanie szybkości obrotów wirówki/ niezbędnej do uzyskania stosownej siły odśrodkowej - g.
Przy obliczaniu liczby obrotów wirówki niezbędnych do uzyskania stosownego do badań wartości przyspieszenia stosujemy poniższy wzór.
Przyspieszenie - g ( Względna siła odśrodkowa) = (11,4 x 10'6) x r x /"
r = promień wirnika - 9,5 cm
X = liczba obrotów/ min
11,2 x 10'° = szybkość kątowa
C. Oznaczanie aktywności dehydrogenazy bursztynianowej
Do oznaczeń aktywności dehydrogenazy- bursztynianowej stosujemy metodę, w której akceptorem wodoru jest chlorek jodo-nitro-tetrazoliowy. Dehydrogenaza redukuje ten związek do formazanu zgodnie z reakcją (Ryc. 2). Powstający w tej reakcji INT-formazan jest związkiem barwnym absorbującym światło o długości fali X = 470 nm.
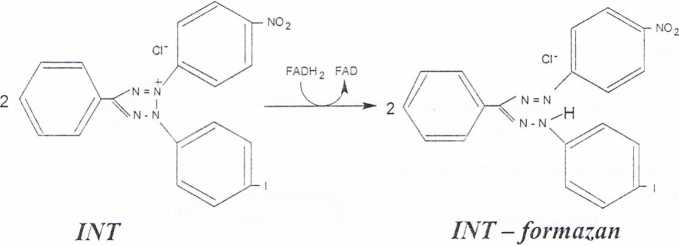
Ryc. 2. Redukcja chlorku jodo-nitro-tetrazoliowego (INT) do barwnego formazanu przez FADH2 powstający w reakcji utleniania bursztynianu z udziałem dehydrogenazy bursztynianowej.
Wyszukiwarka
Podobne podstrony:
34438 Zdjęcie0634 (2) 5. Izolacje przeciwwilgociowe (przeciwwodne) Do robót izolacyjnych zaliczamy w
SZCZEGÓŁY WYKONANIA IZOLACJI PRZECIWWILGOCIOWEJ izolację pionową murów fundamentowych połączyć z
prawidłowe wykonanie izolacji przeciwwilgociowej, - zastosowanie betonu odpowiedni
Przykłady wykonania izolacji urządzeń 11 klasy ochronności: a) z izolacją dodatkową, b) z izolacją
HPIM1785 1.12. przyziemi* budynku NAPRAWA IZOLACJI Usunięcie usterki wykonania izolacji Zdarza się.
DSC00062 (28) Tradycyjne sposoby wykonania izolacji w pomieszczeniach mokrych Izolacja wodoszczelna
brak miejscowych wycieków wody, wykonanie izolacji wewnętrznych. Należy zwracać szczególną uwagę, ab
pswip Polskie Stowarzyszenie Wykonawców Izolacji Przemysłowych
CCF20100324�004 Wykonanie oznaczenia: Aktywność dehydrogenazy oznaczamy w: 1/ homogenacie (20xrozcie
WYKONANIE IZOLACJI PRZECIWWOPNEJ TYPU CIĘŻKIEGO x Zagruntowanie podłoża betonowego x Ułożenie warstw
DSC03092 (2) p. Izolacje przeciwwilgociowe (przeciwwodne) B)o robot izolacyjnych zaliczamy wykonanie
CCF20121026�010 4. Wykrywanie kwasu fosforowego Wykonanie: Do 0,5 cm3 hydrolizatu kwasów nukleinowyc
numero uno Izolacja plazmidowego DNAOdczynniki 1. Roztwór I - bufor do rozpuszcz
więcej podobnych podstron