enzymy16

110 Sekcja C - Enz-wiimfl Kinetyka enzymów
Wykres
Lineweavera-Burka
Tematy pokrewne
równa stosunkowi sumy szybkości rozkładu kompleksu enzym-substrat do szybkości jego powstawania oraz stanowi miarę powinowactwa enzymu do substratu.
Wartości Vmax oraz Km można wyznaczyć doświadczalnie, mierząc V przy różnych stężeniach substratu, a następnie wykreślając 1/Vq jakc funkcję 1 / [S] w wykresie odwrotnościowym, czyli wykresie Lineweavera-Burka. Przecięcie na osi y jest równe wartości 1/V'maX/ przecięcie na osi x jest równe -1 /Km, a nachylenie krzywej jest równe wartości Km/Vmax.
Struktura białek (B3) Wprowadzenie do enzymów (Cl) Termodynamika (C2)
Inhibicja enzymów (C4) Regulacja aktywności enzymatycznej (C5) Łańcuchowa reakcja polimerazy (16)
Tempo przebiegu reakcji katalizowanej przez enzym jest określane y. szybkość reakcji. Szybkości działania enzymu podaje się zazwyczaj j« wartości w czasie zerowym (początkowa szybkość reakcji, symbol |imol-min_1), bowiem szybkość jest największa wtedy, gdy nie ma jes; produktu. Dzieje się tak dlatego, że w nieobecności produktu nie mc wystąpić efekt hamowania przez sprzężenie zwrotne własnym prodi tern — co jest częstym zjawiskiem w enzymach — ani też reakqa nie mc przebiegać w kierunku odwrotnym, zasilanym przez produkt, uniknąć wpływu wymienionych zjawisk, pomiaru Vq dokonuje się, zć więcej niż około 10% substratu zostanie przekształcone w prodi Typowy wykres powstawania produktu jako funkcji czasu dla real katalizowanej enzymatycznie wykazuje początkowy okres szybkie narastania produktu, co odpowiada prostoliniowemu odcinkowi wyl su (rys. 1). Po okresie tym następuje stopniowe zwalnianie szybkc działania enzymu w miarę zużywania substratu i/lub osłabienia akt) ności enzymu. Wartość Vo uzyskuje się, kreśląc linię prostą styczną początkowego odcinka krzywej, poczynając od czasu zerowego (rys. i) nachylenie tej prostej ma właśnie wartość Vq.
Jednostki
Aktywność
bardziej pcw.....”
zowanej pmol-mir.-] matyczne jja matyczną jjest stratu w enzymu. kr zdefiniowaną reakcji w spec aktywność: ni 1 pmol-mir ” \ całkowita ad w próbce ma tyczm. :r d jest miarą n>"3 a staje się rmuEu!
Normalny mi stratu ([5]«pi nie [S] pcw « większych sus [S] powoduje wysycający enzymu żarna enzymu jest wać z e wpływu. 1 jest nazywa®
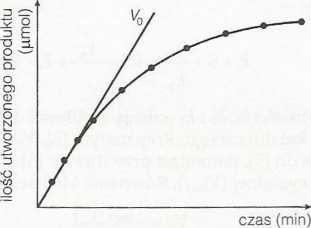

Rys. 1. Zależność między powstawaniem produktu a czasem trwania reakcji katalizowanej przez enzym
Rys. 2. Zaiez~.cs
Gdy się; mu mają r j podwojenie
przedstav.n=:i;ą
Temperatura
w dwojak: spnt
Wyszukiwarka
Podobne podstrony:
enzymy28 122 Sekcja C - Enz’ (a) Model jednoprzejściowy podjednostki w formie T podjednostki w formi
enzymy6 100 Sekcja C - Enzyrifl ■terowadzenie do enzymów Pomiar połączonych reakcji
enzymy18 - 112 Sekcja C - Enzym) inne tyka enzymów Wartość pH miczną cząsteczek substratu. To powodu
enzymy28 122 Sekcja C - Enz’ (a) Model jednoprzejściowy podjednostki w formie T podjednostki w formi
WYKŁAD 2 enzymy cz 1 (41) WYKRES LINEWEAVERA-BURKA Wykres Lineweavera-Burka jest to wykres podwój
Superhelisa3 11. Poniższy wykres Lineweavera-Burka dotyczy : I. inhibicji niekompe
szybkosc odwrotnosc stezenia RYS. 21. Wykres Lineweavera-Burka zależności odwrotności szybkości reak
enzymy17 111 Sekcja C - Enzyif - Kinetyka enzymów e mpleksu oraz stanowi miarę iriadczalnie, mierząc
enzymy15 Kinetyka enzymów -> E+P V Vn = ^ Aktywność enzymu wyraża się zwykle jako początkową szyb
enzymy30 124 Sekcja C - Enzym! Rys. 4. Wykres początkowej szybkości reakcji (/0) aiiosterycznego enz
enzymy22 116 Sekcja C - EnzyoMj Inhibicja enzymówInhibicja nieodwracalna kompetycyjną i niekompetycy
enzymy30 124 Sekcja C - Enzym! Rys. 4. Wykres początkowej szybkości reakcji (/0) aiiosterycznego enz
więcej podobnych podstron