enzymy18
-
112
Sekcja C - Enzym)

inne tyka enzymów
Wartość pH
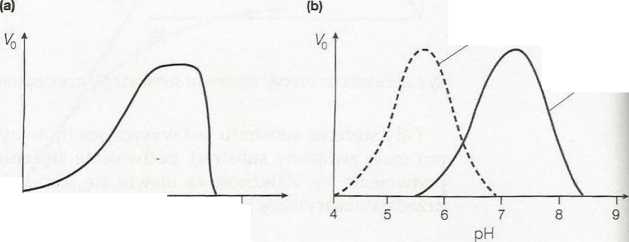
miczną cząsteczek substratu. To powoduje zwiększenie proporcji czasie-czek substratu, mających dostateczną ilość energii, aby przekroczyć zru nę energii swobodnej (Gibbsa) aktywacji (AG*) (patrz temat C2), a prze zwiększa szybkość reakcji. Równocześnie jednak w wyższych temperattu rach ujawnia się drugi efekt; wzrastająca energia termiczna cząstec które tworzą strukturę samego białka enzymatycznego, zwiększa S2 zerwania licznych słabych wiązań niekowalencyjnych (wiązania wc rowe, siły van der Waalsa itd.), utrzymujących przestrzenną strukt enzymu (patrz temat B3). W końcowym efekcie będzie to prowadzić i|l denaturacji (rozfałdowania) enzymu, a nawet małe zmiany trójwymiai§*| wego kształtu enzymu mogą zmienić strukturę miejsca aktywó^B i doprowadzić do spadku aktywności katalitycznej. Ostateczny wpły* podwyższenia temperatury na szybkość reakcji enzymatycznej jest wytśh kiem równowagi między tymi dwoma przeciwnymi efektami. Dlatego te wykres zależności Vq od temperatury będzie miał kształt krzywej o v>cvB raźnie zaznaczonym optimum termicznym (rys. 3a). Dla wielu enzym ssaków przypada ono na około 37°C, ale istnieją organizmy, któryś enzymy zaadaptowały się do działania w temperaturach zarówno zna nie wyższych, jak i niższych. Na przykład polimeraza Taq, której użw się w łańcuchowej reakqi polimerazy (patrz temat 16), występuje u bć rii żyjącej w gorących źródłach, a więc jest przystosowana do optyma pracy w wysokich temperaturach.
Każdy enzym ma optymalne pH działania, w którym szybkość kataliz wanej przez niego reakq'i jest maksymalna. Małe odchylenia pH od war ści optymalnej powodują spadek aktywności, wywołany zmianami jc zacji grup w miejscu aktywnym enzymu. Większe odchylenia pH prowa dzą do denaturacji samego białka enzymatycznego w wyniku zakłócał licznych słabych oddziaływań niekowalencyjnych, utrzymujących pr2 strzenną strukturę białka. Wykres Vo jako funkcji pH daje zazwyc krzywą o kształcie dzwonu (rys. 3b). Wiele enzymów wykazuje optimi aktywności w pobliżu pH 6,8, ale ogólnie istnieje duże zróżnicowć optimum pH enzymów, wywołane różnicami środowiska, w któr) enzymom przyszło działać. Na przykład enzym trawienny pepsyna j« przystosowany do działania w kwaśnym pH żołądka (ok. pH 2,0).
Ejpj enzyst-sa
E + 5 . _c opisu a sa muje sir.,, przeksztai akcję tę w przr. r iiii szość kość ez i stawę c małvcn: prop: ran kość zrmiii nieź (w un»t"f
enzym 2
enzym 1
1
37 50
temperatura (°C)
Rys. 3. Wpływ (a) temperatury oraz (b) pH na aktywność enzymu
Rys. 4. J (V0); (s.S które s.s
cdii
czona prze! nie na,
(patrz W cel'.! nanie naasi
hamerni
Wyszukiwarka
Podobne podstrony:
enzymy6 100 Sekcja C - Enzyrifl ■terowadzenie do enzymów Pomiar połączonych reakcji
enzymy30 124 Sekcja C - Enzym! Rys. 4. Wykres początkowej szybkości reakcji (/0) aiiosterycznego enz
enzymy16 110 Sekcja C - Enz-wiimfl Kinetyka enzymów Wykres Lineweavera-Burka Tematy pokrewneSzy
enzymy30 124 Sekcja C - Enzym! Rys. 4. Wykres początkowej szybkości reakcji (/0) aiiosterycznego enz
CCF20130426�004 naczy. Zależnie od wartości pH środowiska, w cząsteczkach aminokwasów zaznaczony jes
enzymy24 118 Sekcja C - EnzywJB , Italia C-Enzy*^__ enzymu do substratu pozostaje niezmienione, a wi
enzymy17 111 Sekcja C - Enzyif - Kinetyka enzymów e mpleksu oraz stanowi miarę iriadczalnie, mierząc
enzymy22 116 Sekcja C - EnzyoMj Inhibicja enzymówInhibicja nieodwracalna kompetycyjną i niekompetycy
PB030080 WPŁYW pH NA AKTYWNOŚĆ ENZYMÓW Wpływ pH na aktywność enzymu związany jest z wartością
więcej podobnych podstron