skanuj0008
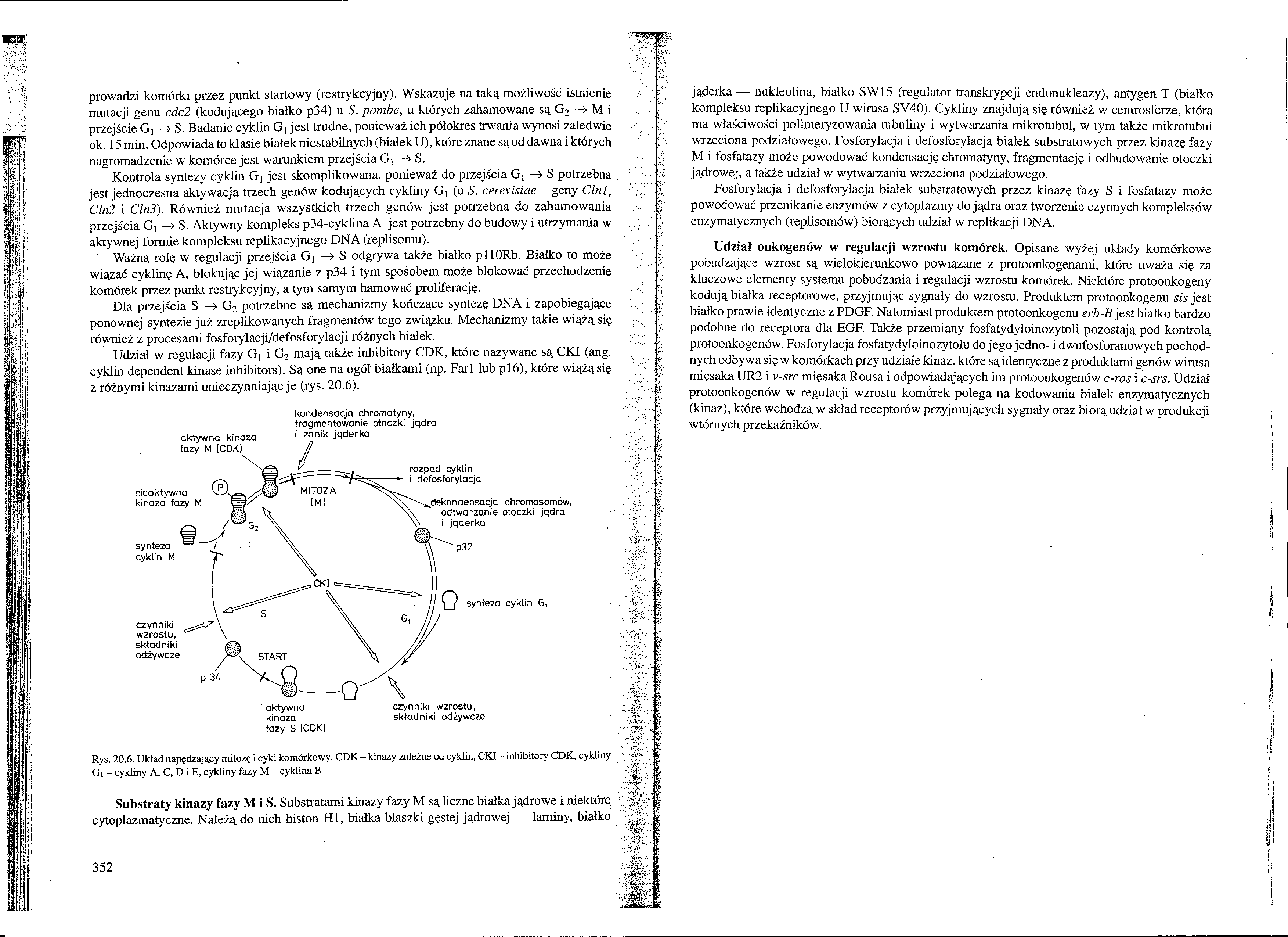
prowadzi komórki przez punkt startowy (restrykcyjny). Wskazuje na taką możliwość istnienie mutacji genu cdc2 (kodującego białko p34) u S. pombe, u których zahamowane są G2 —» M i przejście G, —> S. Badanie cyklin Gi jest trudne, ponieważ ich półokres trwania wynosi zaledwie ok. 15 min. Odpowiada to klasie białek niestabilnych (białek U), które znane są od dawna i których nagromadzenie w komórce jest warunkiem przejścia Gt —> S.
Kontrola syntezy cyklin G! jest skomplikowana, ponieważ do przejścia Gj —> S potrzebna jest jednoczesna aktywacja trzech genów kodujących cykliny Gj (u S. cerevisiae - geny Clnl, Cln2 i Cln3). Również mutacja wszystkich trzech genów jest potrzebna do zahamowania przejścia Gt —» S. Aktywny kompleks p34-cyklina A jest potrzebny do budowy i utrzymania w aktywnej formie kompleksu replikacyjnego DNA (replisomu).
Ważną rolę w regulacji przejścia Gj —> S odgrywa także białko pllORb. Białko to może wiązać cyklinę A, blokując jej wiązanie z p34 i tym sposobem może blokować przechodzenie komórek przez punkt restrykcyjny, a tym samym hamować proliferację.
Dla przejścia S —» G2 potrzebne są mechanizmy kończące syntezę DNA i zapobiegające ponownej syntezie już zreplikowanych fragmentów tego związku. Mechanizmy takie wiążą się również z procesami fosforylacji/defosforylacji różnych białek.
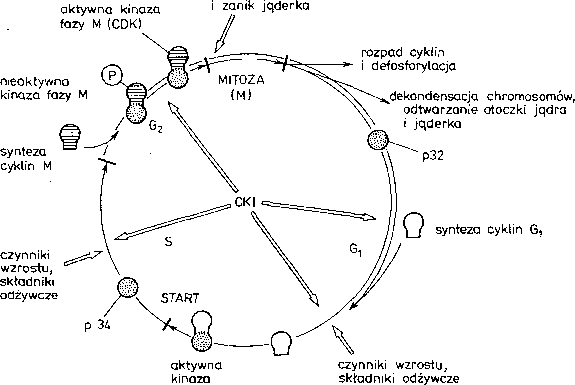
Udział w regulacji fazy G[ i G2 mają także inhibitory CDK, które nazywane są CKI (ang. cyklin dependent kinase inhibitors). Są one na ogól białkami (np. Farl lub pló), które wiążą się z różnymi kinazami unieczynniając je (rys. 20.6).
kondensacja chromatyny, fragmentowanie otoczki jądra
fazy S (CDK)
Rys. 20.6. Układ napędzający mitozę i cykl komórkowy. CDK - kinazy zależne od cyklin, CKI - inhibitory CDK, cykliny Gi - cykliny A, C, D i E, cykliny fazy M - cyklina B
Substraty kinazy fazy M i S. Substratami kinazy fazy M są liczne białka jądrowe i niektóre cytoplazmatyczne. Należą do nich histon HI, białka blaszki gęstej jądrowej — laminy, białko
jąderka — nukłeolina, białko SW15 (regulator transkrypcji endonukleazy), antygen T (białko kompleksu replikacyjnego U wirusa SV40). Cykliny znajdują się również w centrosferze, która ma właściwości polimeryzowania tubuliny i wytwarzania mikrotubul, w tym także mikrotubul wrzeciona podziałowego. Fosforylacja i defosforylacja białek substratowych przez kinazę fazy M i fosfatazy może powodować kondensację chromatyny, fragmentację i odbudowanie otoczki jądrowej, a także udział w wytwarzaniu wrzeciona podziałowego.
Fosforylacja i defosforylacja białek substratowych przez kinazę fazy S i fosfatazy może powodować przenikanie enzymów z cytoplazmy do jądra oraz tworzenie czynnych kompleksów enzymatycznych (replisomów) biorących udział w replikacji DNA.
Udział onkogenów w regulacji wzrostu komórek. Opisane wyżej układy komórkowe pobudzające wzrost są wielokierunkowo powiązane z protoonkogenami, które uważa się za kluczowe elementy systemu pobudzania i regulacji wzrostu komórek. Niektóre protoonkogeny kodują białka receptorowe, przyjmując sygnały do wzrostu. Produktem protoonkogenu sis jest białko prawie identyczne z PDGF. Natomiast produktem protoonkogenu erb-B jest białko bardzo podobne do receptora dla EGF. Także przemiany fosfatydyloinozytoli pozostają pod kontrolą protoonkogenów. Fosforylacja fosfatydyloinozytolu do jego jedno- i dwufosforanowych pochodnych odbywa się w komórkach przy udziale kinaz, które są identyczne z produktami genów wirusa mięsaka UR2 i v-src mięsaka Rousa i odpowiadających im protoonkogenów c-ros i c-srs. Udział protoonkogenów w regulacji wzrostu komórek polega na kodowaniu białek enzymatycznych (kinaz), które wchodzą w skład receptorów przyjmujących sygnały oraz biorą udział w produkcji wtórnych przekaźników.
Wyszukiwarka
Podobne podstrony:
skanuj0036 238 Ocalenie przez muzykę pokusa jedności i poczucie — na różnym poziom W
skanuj0037 (74) 4.6. Ekosystemy specjalnej troski 127 ■atomiast wskazuje na ich dużą wartość przyrod
skanuj0035 (94) Rozdział 2.1 Analiza czynników przedstawionych w tabeli 2-1 wskazuje na istotną rolę
skanuj0012 ty same przez się przenosiły się z miejsca na miejsce, czółna fruwały w powietrzu, ludzie
skanuj0052 3 Ostatnim wykrywanym przez nas kationem jest jon Na . Praktycznie wszystkie jego sole są
Zapisy studentów na zajęcia prowadzone są przez Internet Rejestracja odbywa się na serwerze USOS
75660 skanuj0031 (157) logia nazwy muchomora w wielu językach wskazuje na jego wspólne znaczenie i w
DSC09478 (4) Prosta przechodząca przez punkt i prostopadła do płaszczyzny Na rzutni poziomej jt, nal
Obraz (1322) Przyjęty przez EBC i przez to również stosowany przez NBP podział instrumentów wskazuje
skanuj0052 (2) Ostatnim wykrywanym przez nas kationem jest jon Na . Praktycznie wszystkie jego sole
118 Układy regulacji automatycznej Uzyskany wynik wskazuje na duże możliwości kształtowania
50639 SNB13940 zewnętrznych, jednak wskazują na realne możliwości optymalizacji opiek, i trudności w
więcej podobnych podstron