0000009 3

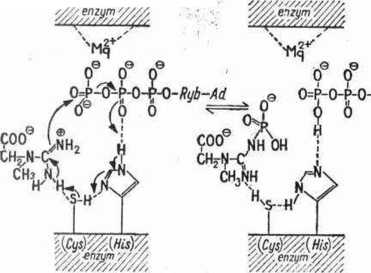
Rys. 31. Mechanizm przeniesienia reszty fosforanowej pomiędzy kreatyną i ADP w powiązaniu z enzymem
rozluźnione wiązanie między skrajną resztą fosforanową i ADP, natomiast tworzy się nowe, pomiędzy tą resztą i azotem kreatyny.
Badania nad wyjaśnieniem mechanizmu poszczególnych reakcji enzymatycznych są żmudne i wymagają przede wszystkim ustalenia budowy centrum aktywnego i udziału poszczególnych jego grup funkcyjnych w wiązaniu sub-stratu. Badania tego rodzaju prowadzi się: przy użyciu specyficznych inhibitorów niewspółzawodniczych, które blokują określone grupy funkcyjne, przy użyciu określonych inhibitorów współzawodniczych lub zmodyfikowanych w niewielkim stopniu substratów, pozwalających następnie poprzez hydrolizę białek enzymowych na wyizolowanie i szczegółowe przebadanie fragmentu enzymu biorącego bezpośredni udział w reakcji i wreszcie przez określenie właściwości fizyko-chemicznych kompleksu enzymu z substratem, którego wyodrębnienie lub wykazanie obecności udało się w kilku przypadkach.
Kontrola aktywności enzymów
Działalność metaboliczna' komórki jest uzależniona od wielu czynników i w związku z tym^musi być regulowana. Tym samym szybkość reakcji katalizowanych przez enzymy powinna być pod stałą kontrolą. Komórka jest więc wyposażona w wiele możliwości regulowania działania enzymów. Regulacja ta jest potrzebna ze względu na konieczność przystosowania się do zmiennych warunków otoczenia oraz zmieniających się i 'funkcji komórki w Zależności od wieku. Istnieją zasadniczo dwa typy regulowania procesów metabolicznych:
1) regulacja genetyczria polegająca na kontroli syntezy enzymów (rozdz. 8, str. 192) i
2) regulacja szybkości działania istniejących już enzymów.
Poza hamowaniem reakcji enzymatycznych, omówionych na
str. 96, podstawową rolę odgrywają czynniki kinetyczne oraz czynniki strukturalne, a także aktywacja enzymów (str. 102).
Czynniki kinetyczne. Czynniki te zostały szerzej omówione w poprzedniej części rozdziału. Należą do nich: stężenia enzymu, substratu i 10
Wyszukiwarka
Podobne podstrony:
0000031 5 nym może być odwracalne przeniesienie fosforanu między kreatyną i ADP (reakcja 6-9) lub np
img195 Typy reakcji, w których ATP uczestniczy jako koenzym: 1. Przeniesienie pojedyńczej reszty fos
star266157 Mosty napędowe 157 Mosty napędowe 157 Rys. 7-31. Ułożenie mechanizmu różnicowego w gniazd
Mechanika ogolna0030 60 Wektor K0 pokazano na rys. 31.ZA u K0 = Kz=Kzk y -► Rys. 31 Zmianę krętu bry
0000008 4 + H.0 OH 9 ?*" R-C-0-R,^R-C;0-R, (a>WD
83422 Untitled Scanned 43 (3) a l-a 31 Mechanika budowli t. Ł Rys. 13.43
img411 Mechanizm redukcji rybonukleotydów 1. Elektron zostaje przeniesiony z reszty cysternowej podj
67506 star266157 Mosty napędowe 157 Mosty napędowe 157 Rys. 7-31. Ułożenie mechanizmu różnicowego w
Image105 Al bramka ta pobiera prąd wejściowy o 25*% większy w porównaniu z bramką standardową (rys.
Image348 W układzie przedstawionym na rys. 4.399 sygnał przeniesienia blokującego propaguje tylko pr
więcej podobnych podstron