091 3

Klnelyc/Jto-moIrkuUma teoria gazów. Prawa przemian gazów doskonałych
Podstawowe prawa gazowe wygodnie jest podać na podstawie rozważań kine-ryczno molekularnej teorii gazów*. Nie wchodząc w szczegóły tej teorii można stwierdzić. Ze gaz składa się z olbrzymiej ilości cząstek znajdujących się w sunie bezładnego mchu cieplnego. Cząsteczki te zderzają s»ę ze sobą. zmieniając swoją prędkość i kierunek ruchu Jeden mol dowolnego gazu zajmuje w warunkach normalnych objętość 22.4 • 10“* m* i zawiera około 6.02 - I02’ cząstek gazu. Odległość międ/yc/ąsCec/kowa wynosi około 3 • 10“* m i jest o jeden rząd większa od odległości międzycząsteczkowych w cieczach i ciałach stałych (3 • IO‘,0m). Jeżeli gaz. znajduje się w zbiorniku, to efektem olbrzymiej ilości zderzeń cząstek gazu ze ściankami zbiornika jest występowanie ciśnienia (p) wywieranego przez gaz na ściany zbsomika. Przyjmując, że zbiornik ma objętość (V). liczba cząstek gazu jest
m
równa (Aż), a —;— = £k - jest średnią energią kinetyczną cząsteczki (gdzie C2 jest
średnim kwadratem prędkości cząsteczki). Z teoni kinetycznej gazów wynika, że ciśnienie /> określa równanie:
Pm
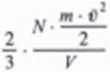
(6.28)
pdm £% ■ N ■ ******* kinctycną wywlach c/atirc/rk ga/u w /bioanU
Gdy założymy, że ilość gazu w zbiorniku równa jest jednemu molowi, wtedy N m Na m 6,02 • 102* cząstek oraz
pVm-RT (6.29)
Równanie (6.29) nosi nazwę równania Clapeymna gazów- doskonałych. Porów nując powyższe równania oraz dokonując pewnych przekształceń, uzyskujemy związek pomiędzy średnią energią kinetyczną mchu postępowego cząsteczek a temperaturą bezwzględną T w postaci:
Ex = | • k T (6.30)
ptx* k • I JM l(X21 7 BotLmunru. %ul* Boiumaiuu k • ; ftl/w R - tuto ga/im>
Ostatnie równanie (6.30) przedstawia kinetyczne okreHenie temperatury. które ma sens tylko w odniesieniu do wielkiej liczby cząsteczek gazu.
4
91
Wyszukiwarka
Podobne podstrony:
Slajd18 Prawa przemian gazów doskonałych Przemiana izotermiczna. Prawo Boyle’a-Mariotte’a Przemiana
Slajd16 Prawa przemian gazów doskonałychRównanie Clapeyrona gazów doskonałych s Jeśli gaz znajduje s
38419 Slajd17 Prawa przemian gazów doskonałychPrawo Daltona Całkowite ciśnienie mieszaniny gazów (P)
39043 Slajd20 Prawa przemian gazów doskonałych Przemiana izochoryczna. Prawo Charlesa Przemiana izoc
40520 Slajd19 Prawa przemian gazów doskonałych Przemiana izobaryczna. Prawo Gay-Lussaca Przemiana iz
Prawa gazów doskonałych: Prawa gazu doskonałego Czynnikiem termodynamicznym jest najczęściej
Kinetyczna teoria gazów (gazy doskonałe) Liczbę moli (n) w próbce można też wyznaczyć, znając masę
CCF20090321�025 4dyfuzja gazów i zasada ewolucji (24) kinetyczna teoria gazów Kinetyczna teoria gazó
3. Równania stanu 3.1. Równanie stanu Van der Waalsa Teoria kinetyczna gazów, na podstawie której
DSC00327 (6) ogólna charakterystyka stanów skupienia materii, kinetyczna teoria gazów, ciecze, ciała
Teoria PRYMATU PRAWA WEWN. : w razie konfliktu norm, pierwszeństwo należy się normom wewnętrznym. Po
więcej podobnych podstron