CCF20110121�168

[[>Beata Ostrowska [£> Twoja matura - chemia
8. z — warunki zadania, n — warunki normalne;
nRT = pV => nR =
T
= const.
p V p V p V T
i z z jT n a _ r z z n
t' n nr p
1 z 1 n 1 z rn
1,2 x 0,5 x 273 flOO + 273 jxl
0,44 m3
atm x m3 T K atm
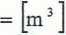
L cp - —
p 15 + 135
x 100 % = 10 %
2.
w. x 100 %
m.
Cp x m, 100 %
M
n x M =
C „x m ,
100 %
Cpxw,
100 % X M
n = 0,0016 «o/ćz
3. Cp = 20%; Cm = 1,7 mol/dm3
4. 15 moli
5. Cm = 0,017 mol/dm3
6. Należy odważyć 30 g NaOH i 470 g wody.
Opis czynności:
Na wadze laboratoryjnej należy odważyć 30 g pastylek NaOH. Trzeba zrobić to szybko, ale ostrożnie, ponieważ wodorotlenek sodu jest żrący i higroskopijny. Następnie należy odmierzyć przy użyciu cylindra miarowego 470 cm3 wody destylowanej. Do zlewki o pojemności 600 cm3 wprowadzamy połowę odmierzonej objętości wody, wsypujemy wodorotlenek i dodajemy resztę wody. Składniki roztworu mieszamy, aż się rozpuszczą.
|
1. |
3,73 mol/dm3 |
|
2. |
219,6 g NaOH |
|
3. |
150 g H20 |
|
4. |
906,25 g H20 |
|
5. |
31,25% |
|
6. |
0,96 mola KCł |
Poziom rozszerzony
7. 13,1%
8. 150 g H20
9. 2,7 mol/dm3
10. 21,5 cm3, 25,6 g
Opis czynności eksperymentatora:
Należy przygotować: kolbę miarową o pojemności 500 cm3, pipetę z podziałką lub biuretę o pojemności 25 cm3, cylinder miarowy, tryskawkę z wodą destylowaną, gruszkę gumową lub nasadkę do pipety.
Do kolby wlewamy około 100 cm3 wody destylowanej. Z butelki z kwasem pobieramy przy użyciu pipety 21,5 cm3 roztworu kwasu i przenosimy go do kolby miarowej. Zawartość kolby uzupełniamy wodą do kreski. A
Wyszukiwarka
Podobne podstrony:
CCF20110121�001 U> Beata Ostrowska [£> Twoja matura - ChemiaSpis
CCF20110121�003 D> Beata Ostrowska [£> Twoja matura - ChemiaBudowa atomu i promieniotwórczośćP
CCF20110121�005 B> Beata Ostrowska [£> Twoja matura - Chemia Pisać konfiguracje trwałych jonów
CCF20110121�013 l> Beata Ostrowska [£> Twoja matura - Chemia b) Jak zmienia się aktywność meta
CCF20110121�019 n> Beata Ostrowska [£> Twoja matura - ChemiaWiązania chemicznePoziom rozszerzo
CCF20110121�021 U> Beata Ostrowska [£> Twoja matura - Chemia Rozumieć istotę różnic w
CCF20110121�025 5. d> Beata Ostrowska [£> Twoja matura - Chemia Pisać pełne równania reakcji o
CCF20110121�027 [J> Beata Ostrowska [£> Twoja matura - Chemia b) Podaj wzory produktów organic
CCF20110121�029
CCF20110121�031 [[> Beata Ostrowska [£> Twoja matura - Chemia 4. Wiedząc, że metan jest gazem
CCF20110121�035 H> Beata Ostrowska
CCF20110121�041 O Beata Ostrowska [£> Twoja matura - Chemia 0-1 p. 0-1 p. c) Podaj nazwę
CCF20110121�051 n> Beata Ostrowska [£> Twoja matura - Chemia b) Której z substancji Li2C03 czy
CCF20110121�053
CCF20110121�055 K> Beata Ostrowska [£> Twoja matura - Chemia 11 . W tabeli podano rozpuszczaln
CCF20110121�059 Q> Beata Ostrowska
CCF20110121�063 u> Beata Ostrowska [£> Twoja matura - Chemia Stężenie procentowe i stężenie mo
CCF20110121�075 s> Beata Ostrowska [£> Twoja matura - Chemia a) Uporządkuj związki w kolejnośc
CCF20110121�085 U> Beata Ostrowska [£> Twoja matura - ChemiaTlenki, kwasy, zasady i solePoziom
więcej podobnych podstron