img046 3

Model kinetyczny Michaelisa-Menten opisuje własności wielu enzymów:
( przy stałym stężeniu enzymu)
v, =
Vmax[S]
{Km + [S]}
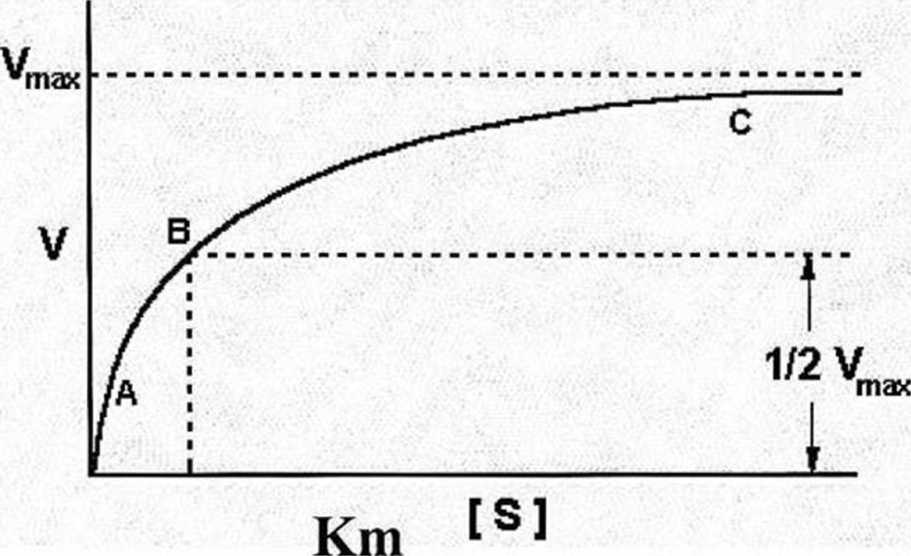
Km jest równe stężeniu substratu, dla którego szybkość reakcji osiąga połowę swojej wartości maksymalnej. Km informuje o aktywności enzymów (im mniejsza Km tym enzym aktywniejszy).
Wyszukiwarka
Podobne podstrony:
img046 5 Model kinetyczny Michaelisa-Menten opisuje własności wielu enzymów: ( przy stałym stężeniu
LastScan3 (4) WŁAŚCIWOŚCI KINETYCZNE ENZYMÓW MODEL MICHAELISA - MENTENWYZNACZANIE WARTOŚCI KM ORAZ V
B. Model kinetyczny nieodwracalnej reakcji enzymatycznej wg Michaelisa-Menten Założenia
LastScan3(2) WŁAŚCIWOŚCI KINETYCZNE ENZYMÓW MODEL MICHAELISA - MENTENWYZNACZANIE WARTOŚCI KM ORAZ Vm
LastScan3 (4) WŁAŚCIWOŚCI KINETYCZNE ENZYMÓW MODEL MICHAELISA - MENTENWYZNACZANIE WARTOŚCI KM ORAZ V
LastScan3 (5) WŁAŚCIWOŚCI KINETYCZNE ENZYMÓW MODEL MICHAELISA - MENTEN ..... • E + S ES E + P *
V = k3 [ESJ Opisując kinetykę tak działającego enzymu Michaelis i Menten oparli się na następujących
skanowanie0011 Kinetyka reakcji enzymatycznych Wyprowadzenie równania Michaelisa-Menten. Stała Micha
SkanT 16. kinetyka rakcji enzymatycznej- toria Michaelisa- Menten. I>jjJniczym
Zdjęcie0160 Reakcje większości enzymów opisuje równanie Michaellsa-Menten: szybkość maksymalna szybk
WYKŁAD 2 enzymy cz 1 (35) model michaelisa-menten V 1913 roku Leonor Michaelis i Maud Menten zapr
38568 skanowanie0014 Enzymy nie podlegające analizie Michaelisa-Menten model sekwencyjny model jedno
IMAG0392 (3) ANALIZA RÓWNANIA MICHAELISA-MENTENW KU+[S] r Zgodnie z równaniem (23): V,™, ,=*[ &
więcej podobnych podstron