skanowanie0023(1)
U£S Jlllilllli
|
1 |
2 |
3 |
4 |
5 |
6 | |||
|
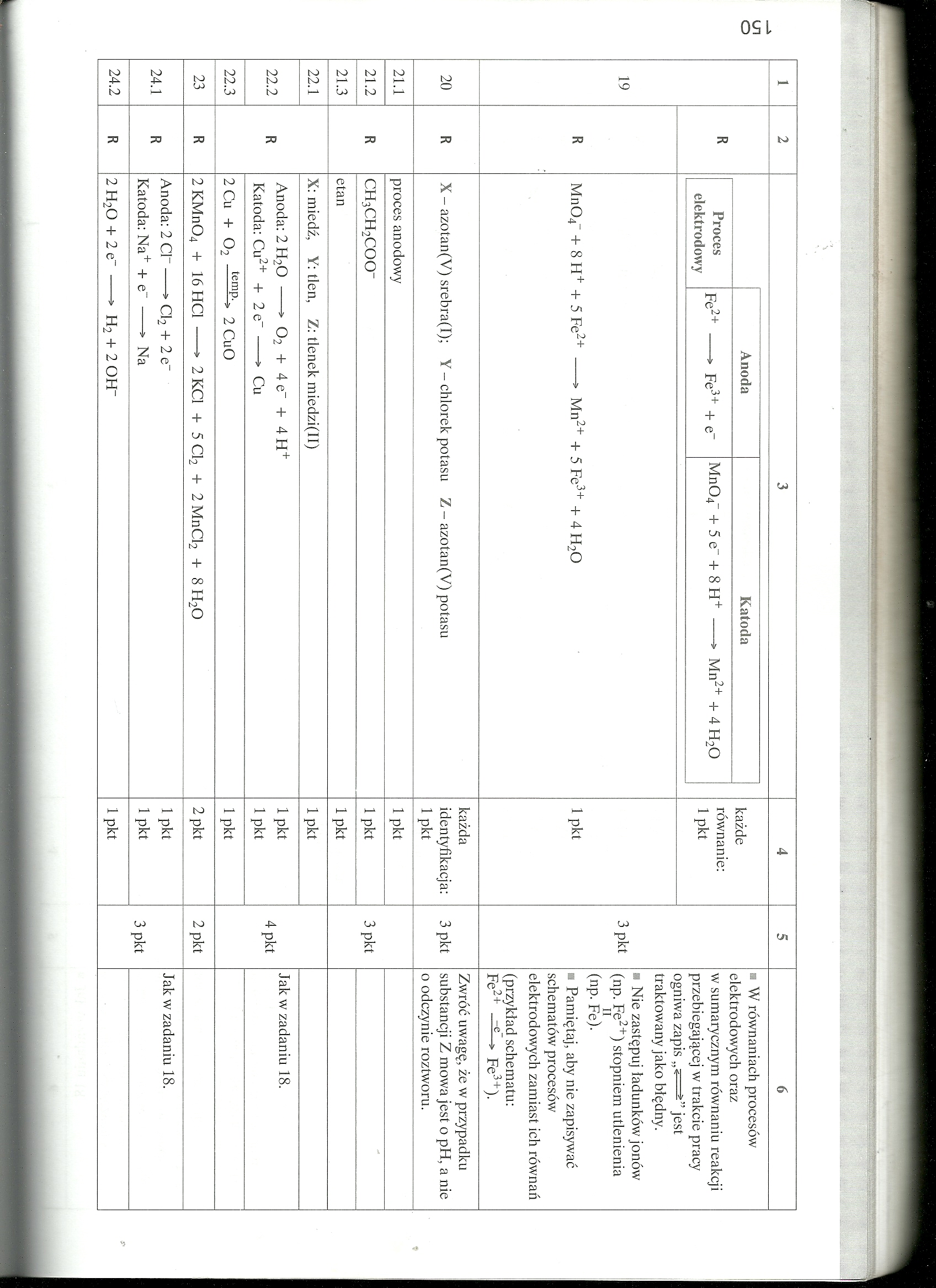
19 |
R |
Anoda |
Katoda |
każde równanie: 1 pkt |
3 pkt |
■ W równaniach procesów elektrodowych oraz w sumarycznym równaniu reakcji przebiegającej w trakcie pracy ogniwa zapis „< >” jest traktowany jako błędny. ■ Nie zastępuj ładunków jonów (np. Fe2+) stopniem utlenienia (np. Fe). ■ Pamiętaj, aby nie zapisywać schematów procesów elektrodowych zamiast ich równań (przykład schematu: Fe2+ Fe3+). | ||
|
Proces elektrodowy |
Fe2+ -> Fe3+ + e" |
Mn04“ + 5 e + 8 H+---> Mn2+ + 4 H20 | ||||||
|
R |
Mn04- + 8 H+ + 5 Fe2+ -* Mn2+ + 5 Fe3+ + 4 H20 |
1 pkt | ||||||
|
20 |
R |
X - azotan(V) srebra(I); Y - chlorek potasu Z - azotan(V) potasu |
każda identyfikacja: 1 pkt |
3 pkt |
Zwróć uwagę, że w przypadku substancji Z mowa jest o pH, a nie o odczynie roztworu. | |||
|
21.1 |
R |
proces anodowy |
1 pkt |
3 pkt | ||||
|
21.2 |
CH3CH2COO“ |
1 pkt | ||||||
|
21.3 |
etan |
1 pkt | ||||||
|
22.1 |
R |
X: miedź, Y: tlen, Z: tlenek miedzi(II) |
1 pkt |
4 pkt | ||||
|
22.2 |
Anoda: 2 H20 -> 02 + 4e" + 4H+ Katoda: Cu2+ + 2 e“ -* Cu |
1 pkt 1 pkt |
Jak w zadaniu 18. | |||||
|
22.3 |
2 Cu + 02 temp~> 2 CuO |
1 pkt | ||||||
|
23 |
R |
2 KMn04 + 16HC1 -> 2KC1 + 5 Cl2 + 2MnCl2 + 8H20 |
2 pkt |
2 pkt | ||||
|
24.1 |
R |
Anoda: 2 Cl"->Cl2 + 2e" Katoda: Na+ + e" -> Na |
1 pkt 1 pkt |
3 pkt |
Jak w zadaniu 18. | |||
|
24.2 |
R |
2 H2Q + 2 e" -* H2 + 2 OH" |
1 pkt | |||||
Wyszukiwarka
Podobne podstrony:
Skanowanie) 03 2009# 19 (3) PRZYKŁAD 3 WARTOŚĆ P ROD U KG I W 2000 R (ZŁ) WYSZCZ. MIESIĄCE
skanowanie7 (3) 2.30. Podane funkcje są rozwiązaniami wskazanych równań liniowych niciednorodnvch. W
page0379 371Równania od piątego, uważanych w ogomej ich postaci. D’AIembert postawił prawo, że każde
skanowanie0007 3 Opis teoretyczny : Iteracyjne metody rozwiązywania układów równań - Metoda Jacobieg
Działo elektronowe z pośrednio żarzoną katodą chłodzony uchwyt katody spirala grzejna anoda katoda
IMAG0413 (4) Schemat ogniwa:Anoda I I Katoda (pólogniwo lewe) (pólogniwo prawe) . utlenianie
skanowanie0010 ■ MATEMATYKA - POZIOM PODSTAWOWY x = 5 y = 10 Rozwiązanie uktadu równań: ^ = 20 U^
Skanowanie 12 01 19 41 (12) nie wiem czy kolejność jest dobrze zapisana. wątroba na pewno pierwsza.
więcej podobnych podstron