skanuj0132 [1600x1200]
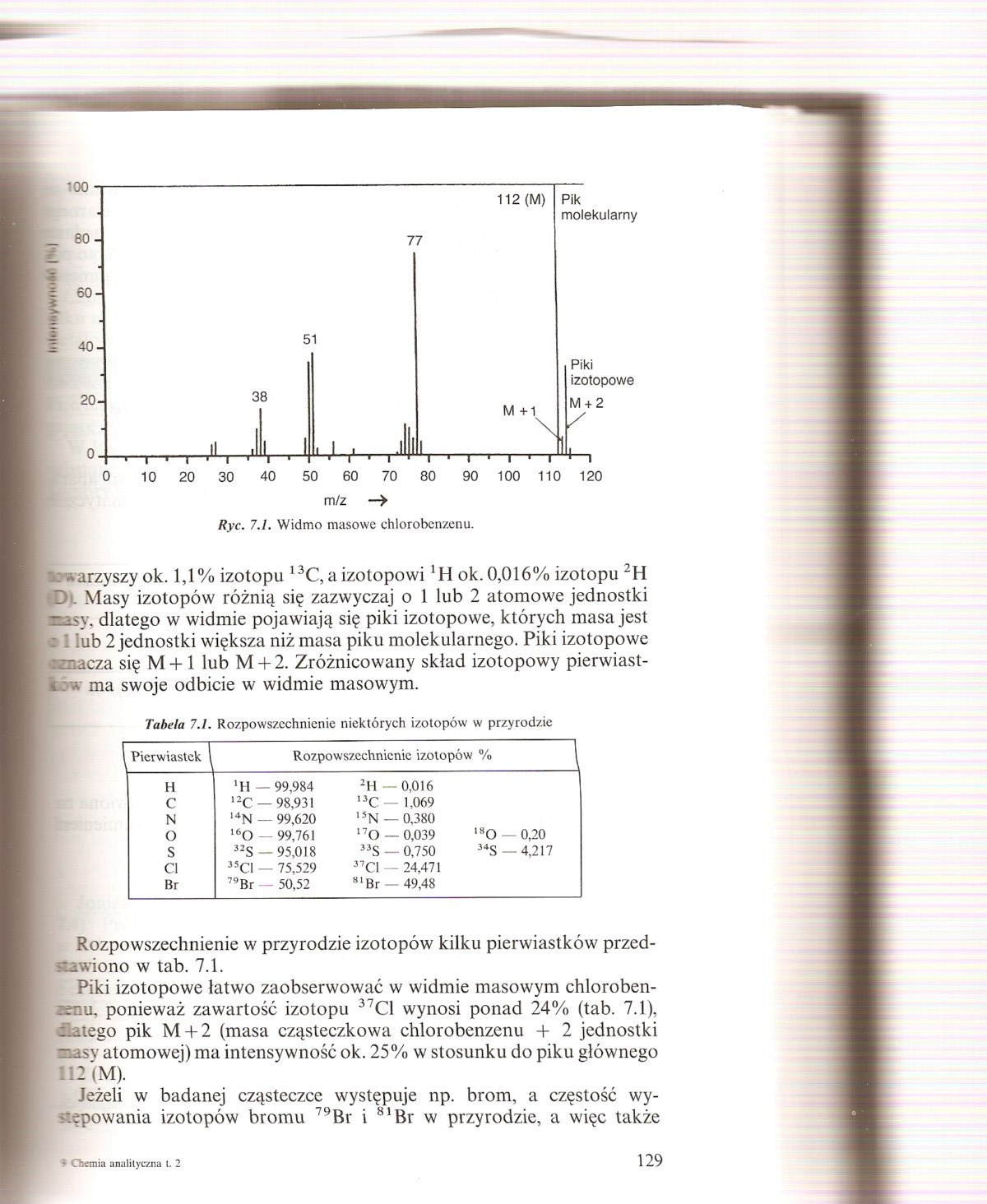

*: -tarzyszy ok. 1,1% izotopu 13C, a izotopowi 'H ok.0,016% izotopu 2H I . Masy izotopów różnią się zazwyczaj o 1 lub 2 atomowe jednostki tmsy, dlatego w widmie pojawiają się piki izotopowe, których masa jest 9 '.ub 2 jednostki większa niż masa piku molekularnego. Piki izotopowe € macza się M + 1 lub M + 2. Zróżnicowany skład izotopowy pierwiastków ma swoje odbicie w widmie masowym.
Tabela 7.1. Rozpowszechnienie niektórych izotopów w przyrodzie
|
, Pierwiastek 1 |
Rozpowszechnienie izotopów % 1 |
|
H |
‘H — 99,984 2H— 0,016 |
|
C |
12C — 98,931 ,3C —1,069 |
|
N |
14N — 99,620 15N —0,380 |
|
O |
I60 — 99,761 170 — 0,039 , 80 — 0,20 |
|
s |
32S —95,018 33S — 0,750 34S — 4,217 |
|
Cl |
35C1 — 75,529 37C1 — 24,471 |
|
Br |
79Br — 50,52 81 Br — 49,48 |
Rozpowszechnienie w przyrodzie izotopów kilku pierwiastków przędna wiono w tab. 7.1.
Piki izotopowe łatwo zaobserwować w widmie masowym chloroben-:mu, ponieważ zawartość izotopu 37C1 wynosi ponad 24% (tab. 7.1), -iatego pik M + 2 (masa cząsteczkowa chlorobenzenu -1- 2 jednostki ■lasy atomowej) ma intensywność ok. 25% w stosunku do piku głównego 112 (M).
Jeżeli w badanej cząsteczce występuje np. brom, a częstość występowania izotopów bromu 7t,Br i 8'Br w przyrodzie, a więc także
- Chemia analityczna t. 2 129
Wyszukiwarka
Podobne podstrony:
Protony + neutrony liczba masowa A określa masę nuklidu (jądra określonego izotopu) Izotopy: różnią
skanuj0138 [1600x1200] onizacji elektronowej pik molekularny ma intensywność ok. 5%. W widmie, w któ
skanuj0100 (14) ^nęstotliwości ok. 800-1000 kHz ma dużą zdolność penetracji i stosować wysokich natę
skanuj0012 (108) ^ **dM-ł=Ok> toveX«^«r ^S,S* -S ^O. *-(
skanuj0128 [1600x1200] Największy wpływ na wartość przesunięcia chemicznego w spektroskopii 13C NMR
skanuj0018 THE HiRtOWOm* óK THE EŁEMEŚTS • m.......i *H «r W «* 4 - - -
skanuj0014 ATOMY, PIERWIASTKI CHEMICZNE I IZOTOPY Większymi cząstkami materii są atomy, które składa
79223 skanuj0004 (499) - obojnaki - ok. 35000 gat. w Polsce ok.
65563 skanuj0100 (14) ^nęstotliwości ok. 800-1000 kHz ma dużą zdolność penetracji i stosować wysokic
skanuj0008 (HC13-6%, H202 1%, ok. 20 h w temp. 20°C wytłoki: roztwór 1:4) 11 płukanie i
skanuj0014 H^duob (> ^° o^>Ua.^OK^.
skanuj0176 [1600x1200] Monochromator W aparatach AAS produkowanych seryjnie stosuje się monochroma-t
skanuj0106 [1600x1200] mmmm Jak wiadomo energia promieniowania jest odwrotnie proporcjonalna ilugośc
więcej podobnych podstron