skanuj0014

ATOMY, PIERWIASTKI CHEMICZNE I IZOTOPY
Większymi cząstkami materii są atomy, które składają się z jądra i rozmieszczonych wokół niego elektronów. W skład jądra wchodzą nukleony, które - w zależności od ładunku elektrycznego bądź jego braku - są protonami lub neutronami. Liczba protonów w jądrze, równa liczbie elektronów atomu obojętnego, nosi nazwę liczby atomowej Z. Liczba atomowa jednoznacznie określa przynależność atomu do danego pierwiastka chemicznego.
Pierwiastek chemiczny jest zbiorem atomów o jednakowych ładunkach jąder. W przyrodzie występują pierwiastki chemiczne o liczbach atomowych od 1 (H - wodór) do 94 (Pu - pluton). W reaktorach jądrowych - w sposób sztuczny -zdołano otrzymać pierwiastki o większej liczbie atomowej, w tym o liczbie atomowej 118.
Liczba nukleonów w jądrze jest nazywana liczbą masową A. Ponieważ liczba neutronów w atomach danego pierwiastka chemicznego może być różna, atomy tego samego pierwiastka chemicznego mogą się różnić liczbą masową. Odmiany pierwiastków chemicznych o jednakowej liczbie ;atc/fr1Ći\&ej Z, lecz różniące się iićzfc)% maŚową^A; są nazywane izotopami. Wszystkie pierwiastki chemiczne mają izotopy.
Atomy, których jądra różnią się liczbą protonów i neutronów, nazywane są nuklidami. Nuklidy tego samego pierwiastka chemicznego są zatem izotopami. Pierwiastki chemiczne są więc mieszaniną izotopów. Z tego względu masy atomowe pierwiastków chemicznych nie są liczbami całkowitymi. Masą atomową danego pierwiastka chemicznego jest stosunek średniej masy atomu tego pierwiastka do masy 1/12 atomu izotopu węgla o liczbie masowej równej 12.
Budowa atomu
WYKORZYSTANIE MECHANIKI FALOWEJ W TEORII BUDOWY ATOMU
Teorię budowy atomu opracowano z wykorzystaniem mechaniki falowej. Mechanika falowa umożliwia opisanie zachowania się elektronów w atomach i kryształach. Zgodnie z założeniami mechaniki falowej cząstkom materii przypisuje się własności charakterystyczne dla światła. Molekularny i falowy charakter światła należy rozumieć w taki sposób, że światło złożone z tzw. fotonów porusza się zgodnie z prawami mechaniki falowej. Doświadczalne potwierdzenie słuszności założeń mechaniki falowej w odniesieniu do atomu stanowi dyfrakcja (ugięcie) elektronów przechodzących przez kryształy.
STRUKTURA ELEKTRONOWA ATOMU Rysunek 2.1
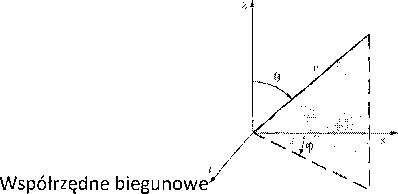
Położenia i prędkości elektronów otaczających jądro atomu, zgodnie z zasadą nieoznaczoności, nie można dokładnie opisać. Można tylko określić prawdopodobieństwo znalezienia się elektronu w poszczególnych miejscach otaczających jądro. Strukturę elektronową należy sobie wyobrażać jako chmurę elektronową wokół jądra. Duże prawdopodobieństwo znalezienia się elektronu w danym miejscu odpowiada dużej gęstości chmury elektronowej.
Gęstość chmury elektronowej na jednostkę objętości p można przedstawić jako iloczyn trzech funkcji, z których każda jest uzależniona odpowiednio od odległości promieniowej od jądra r lub kątów 0 i (p, określających położenie danego punktu względem jądra we współrzędnych biegunowych (rys. 2.1):
STANY ENERGETYCZNE ELEKTRONU W ATOMIE
Elektron poruszający się w polu jądrowym może zajmować tylko ściśle określone stany energetyczne związane z gęstościami chmur elektronowych. Stan energetyczny elektronu charakteryzują cztery liczby kwantowe:
0 główna n = 1, 2, 3, 4, 5, 6 lub 7, n > 1,
1 poboczna I = 0,1, 2, 3, 4, 5, 6, I < n -1, i magnetyczna -I < ml< +1,
0 spinowa ms = ±1/2.
Główna liczba kwantowa n określa liczbę powierzchni węzłowych kulistych, ze środkiem w jądrze, lub płaszczyzn przechodzących przez jądro, na których gęstość chmury elektronowej jest równa zeru. Większe liczby świadczą o dużej wielkości chmur elektronowych. Główna liczba kwantowa określa zatem tzw. powłoki elektronowe poszczególnych stanów energetycznych, oznaczane kolejno liczbami od 1 do 7 lub dużymi literami K, L, M, N, O, P i Q.
Poboczna liczba kwantowa I określa podpowłoki elektronowe, oznaczane odpowiednio s, p, d, f, gdy I = 0,1, 2, 3. Określa ona liczbę płaszczyzn węzłowych przechodzących przez jądro atomu i charakteryzuje moment pędu elektronu. Magnetyczna liczba kwantowa ml jest miarą orientacji momentu pędu elektronu i określa składową tego momentu w kierunku przyłożonego pola magnetycznego.
Spinowa liczba kwantowa ms ujmuje wpływ pola magnetycznego wytwarzanego przez elektron wirujący wokół swojej osi. Znak liczby spinowej zależy od tego, czy elektron jest ustawiony równolegle, czy antyrównolegle do linii sił pola magnetycznego.
4
Wyszukiwarka
Podobne podstrony:
ATOM PIERWIASTEK CHEMICZNY ZWIĄZEK CHEMICZNY Materia ma budowę ziarnistą i składa się z
skanuj0024 (Kopiowanie) Skład chemiczny komórki. Najważniejszymi składnikami komórki są woda, sole m
skanuj0013 (279) 26 Cele edukacji Cele operacyjne przybliżają nam procesy psychiczne składające się
skanuj0022 (133) WALORY KULTUROWE OBSZARÓW WIEJSKICH W POLSCE 141 Na działania promocyjne składają s
skanuj0013 (279) 26 Cele edukacji Cele operacyjne przybliżają nam procesy psychiczne składające się
7 (174) odczynników chemicznych, substancjami niebezpiecznymi i preparatami niebezpiecznymi są te, k
Zeta sizer 2 małe cząstki mogą tworzyć aglomeraty, które zachowują się jak duże cząstki i niekorzyst
Jako materiał drewnopochodny produkowane są panele podłogowe, składające się z kilku warstw
DSC00144 (11) roces wyciskania Materiał po obróbce -masa, składająca się pęcherzyków powietrza; półp
Uprawa 1 10. Własności fizyczne i chemiczne nawozów mineralnych Nawozy mineralne (tab. 11-16) składa
DSC00864(1) Inżynieria Chemiczna dr inź. Wojciech Skrzypiński Zestaw Nr 1 I. Chłodnica składa się z
Większość zdających poprawnie sporządziła wykaz prac składających się na przygotowanie gabinetu oraz
więcej podobnych podstron