(3)

dobiera się lak, by produkt reakcji był zabarwiony lub fluoryzował. W niektórych reakcjach na barwnym tle pozostają bezbarwne plamy w miejscu lokalizacji enzymu. Metody te są przeważnie łatwe w stosowaniu i działają bardzo specyficznie.
Izoenzymy
Barwienie histochemiczne eleklroferograntu horaogenatu określonej tkanki wykazuje często obecność w niej kilku form tego samego enzymu. Zróżnicowanie zawartości form enzymów o tym samym działaniu występuje również często między różnymi organizmami, zarówno w obrębie gatunku jak i wyższych jednostek systematycznych. Różne formy tego samego enzymu są nazywane izoenzymami, izozymami lub izoformami eznymów. Profil izocnzymatyczny określonej aktywności w określonym osobniku można traktować jako swego rodzaju "fenotyp enzymatyczny", który można interpretować w odniesieniu do genotypu - do genów i alleli. Dzięki temu że geny kodujące białka są poimiorficzne (występują w postaci kilku alleli tego samego genu) oraz temu, że obydwa allele są aktywne w procesie biosyntezy białek i są widoczne w profilu izoenzymatycz- nym (wykazująkodominacją).
Najważniejszym czynnikiem wpływającym na różnice ruchliwości elcktroforetycznej izoenzymów' są zmiany w pierwszorzędowej strukturze białka, będące odbiciem różnic w allelach tego samego genu. Dla prostego przedstawienia tych zależności rozważmy hipotetyczny polipeplyd złożony z dziewięciu aminokwasów:
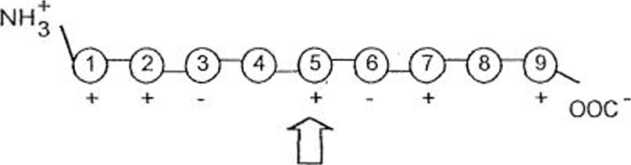
W środowisku w którym przeprowadzamy elektroforezę reszty aminokwasów 1,2,5,7 i 9 są zjoiuzw wane dodatnio j reszty aminokwasów 3 i 6 są /jonizowane ujcmruc. Wypadkowy ładunek cząsteczki wynosi więc +3. Załóżmy, że aminokwas 5 to lizyna, kodowana w genie przez kodon TTC. Możliwe jest kilka rodzajów mutacji punktowych j>olegających na zamianie w tym kodonic jednej zasady azotowej na inną:
O zamiana kodonu TTC na TCC spowoduje zamianę z lizyny na argininę, dzięki czemu otrzymamy nowy allel, kodujący nową alloproteine (inną formę tego samego białka). Ponieważ reszta argininowa podobnie jak lizynowa ma ładunek dodatni, białko będzie miało wypadkowy' ładunek nadal równy +3;
O Jeżeli kodon TTC zmutuje do TGC, nowa ałloproteina będzie miała treoninę w poz. 5. Ponieważ aminokwas ten jest neutralny, cząsteczka będzie miała wypadkowy ładunek
+2.
© Mutacja TTC do CTC spowroduje wbudowywanie w miejscu lizyny glutaminy, dysocjującej na jon ujemny. Wypadkowy ładunek będzie wynosił +1.
© W końcu, jeżeli kodon TTC zmutuje do TTT, jego znaczenie pozostanie takie samo (będzie nadal kodował lizynę).
Jeżeli powstałe w efekcie mutacji alloproteiny poddamy elektroforezie, będą one migrować do katody z szybkością proporcjonalną do ich ładunku. Po przeprowadzeniu
3.
Wyszukiwarka
Podobne podstrony:
108 MALI BRACIA starają się o to, by mieć w tym samym mieście lub okolicy jedną Placówkę Adoracji i
DSC00057 (35) Na razie wydaje się Na razi* wydaje się ze głównymi produktami mi»roiyiUmiy«ywi
IMAG0920 • Narysuj produkty reakcji i na jednym przykładzie przedstaw jej mechanizm OH EtOH,
Obraz (146) 2 i ludzie łącznie = 54,6%) oraz nieumiejętnością związania się uczuciowego (brak FC). R
Pomyśl 6 latku wm U/ każdym akwarium dorysuj tyle rybek, by byto ich więcej, mniej lub tyle sam
PC020579 Zakłada się, ie produkty reakcji mogą powstać wyłącznie przez rozpad stanu przejściowego,
Wstyd i przemo0095 188 Wstyd i przemoc Dunn opisuje swoją reakcję jako „strach, chęć przeżycia. Kied
- stopniowe narastanie ciśnienia Gazy powstające jako produkt reakcji rozprężają s
nukleotydów (do 2 tys). Produkty reakcji poddaje się elektroforezie w żelu agarozowym i wizualizacji
79247 s che 1A jako produkt reakcji pojawiły się jony wodorotlenowe, które spowodowały, żc odczyn ro
Okazuje się, w świetle owych przykładów, że sama intencja nie jest wystarczająca do tego, by dany cz
Okazuje się. w świetle owych przykładów. Ze sama intencja nie jest wystarczająca do tego, by dany cz
81631 Zaprawa więzienna (159) celu mumi polońt się na brzuchu na stole r/y biurku (n.ijłipicj w lak
więcej podobnych podstron