LastScan6

1. Reakcje transaminacji są katalizowane przez aminotransferazy, enzymy należące do klasy transferaz.
2. Aminotransferazy współdziałają z fosforanem pirydoksalu jako grupą prostetyczną, tworzą z substratem połączenie typu zasady Schiffa.
3. Reakcje katalizowane przez aminotransferazy nie wymagają udziału energii metabolicznej (ATP), są całkowicie odwracalne.
4. Reakcje transaminacji polegają na przeniesieniu grupy - NH2 razem z protonem i parą elektronów z 2- L-aminokwasu na 2-oksokwas.
5. W wyniku reakcji powstaje nowy 2-L-aminokwas oraz 2-oksokwasowa pochodna aminokwasu, który był dawcą grupy aminowej.
|
cxxr i |
cocr | ||
|
cocr I |
T1 |
COO" |
1 ** |
|
?• |
F |
_ p |
1 <*7 |
|
h-c-nh; |
+ c=o |
•f 1 - O-1 | |
|
cocr |
cocr |
ćocr |
COO' |
|
asparaginian |
a-kełoglutaran |
szczawiooctan |
glutaminian |
|
W | |||
|
COO" |
COO- |

fys i. Struktura ta) Wydoteyny (włammy Be), (bl fosforanu p/rydoksau < (c) toskranu piryMsaminy
|
1 „ H-C-NH, |
1 i |
1 C=0 + |
1 ** H —C—NH3 |
|
coo- |
CO0 |
cocr |
1 COO- |
|
alanina |
a-ketogłutaran |
pirogronian |
glutammian |
Rys. 3 Reakcje katalizowane przez (a) amnotransferazę asparagimanową i (b) aminotransferazę alaninową

«xr
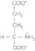

Rys. 5 Sumaryczna reakc/a rranseminacfi
Hames i inni, Biochemia, 2002
Wyszukiwarka
Podobne podstrony:
20757 justy019 Reakcja ta jest katalizowana przez aspartazę i również jest odwracalna. Hydroliza moc
wymaganiaF bmp mechanizm wyjaśniając kinetykę reakcji hydrolizy sacharozy,katalizowanej przez Inwert
d) Reakcje utleniania są katalizowane metalami tworzącymi tlenki na różnym stopniu utlenienia (V, Ag
ObrazE175 Tymczasem w glikolizie zachodzi podczas dwóch reakcji syntezy ATI (katalizowane przez kina
DSC01113 (6) Oksydacyjna deamłnacja W reakcji oksydacyjnej deaminacji. katalizowane) przez dehydroge
DSC01106 (8) Odłączanie grup a-aminowych z wolnych aminokwasów Transaminacja — reakcja katalizowana
LastScan11 (3) 1.2. 3.4. 5.REAKCJE KATALIZOWANE PRZEZ KOMPLEKS DEHYDROGENAZY PIROGRONIANOWEJEtapy re
LastScan10 (3) REAKCJA KATALIZOWANA PRZEZ DEHYDROGENAZĘ PIROGRONIANOWĄCoA C02COCrI c=oI ch3 Pirogron
P5101345 I Praykbuiowa reakcja i udziałem katalizatora: woda utleniona - rozkład katalizowany przez:
13495 Obraz 7 (25) IM Podobnie jak hydroliza estrów, hydroliza amidów jest katalizowana przez kwasy
IMAG0079 Przykład (biologia) ^ ^tuidurdomf entalpię reakcji katalizowanej przez heksokinazę >
więcej podobnych podstron