Scan Pic0034

więc:
IWl = NRT.
Przemiana ze stanu 2 do 3 jest izochoryczna (W= 0).
Rozwiązanie zadania 2.9 Prawidłowa odpowiedź: D.
Równanie stanu gazu informuje nas, że niezależnie od wartości poszczególnych parametrów, dla stałej masy gazu, zachodzi: vV
-^jŁ= const = NR,
T
gdzie N jest liczbą moli gazu.
Jeśli przemiana gazu jest izobaryczna {p = const), to:
V NR
— =-= const.
T V
Zależność objętości gazu od temperatury jest więc funkcją liniową:
y=NR_T,
V
znaną z matematyki w postaci y = ax, gdzie współczynnik kierunkowy
jest równy a =
do osi T.
Jeśli więc przemiana izobaryczna jest przeprowadzona pod stałym, wysokim ciśnieniem pv to
:tg«i
ma wartość małą, jeśli zaś pod stałym lecz niskim ciśnieniem p2, to
NR
tza-
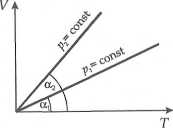
Vi
ma dużą wartość.
W rozpatrywanym zadaniu wystarczy więc przez każdy z punktów 1, 2, 3, 4 przeprowadzić izobarę i sprawdzić, który kąt nachylenia jest najmniejszy (patrz rysunek obok).
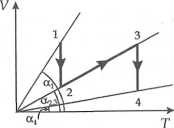
Rozwiązanie zadania 2.10 Prawidłowa odpowiedź: B. Przemiana: 1—*2 - izotermiczna
2— >3 - izochoryczna
3— A. - izobaryczna
Rozwiązanie zadania 2.11 Prawidłowa odpowiedź: D.
Dla przemiany izobarycznej 1—*2
Z wykresu widzimy, że Vl = V3 i T2 = T3, V2 = V4. Dla przemiany 3—4
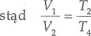
A zatem
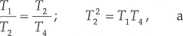
więc T2 = JTJ4 .
Rozwiązanie zadania 2.12 Prawidłowa odpowiedź: A.
Przy przejściu ze stanu K do stanu L wszystkie parametry ulegają zmianie:
Pkvk = Plvl T T '
■*K 1L
ale Tl=2Tk i pL=4pK,'
więc
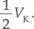
Vk=2Vl' oraz VL =
Jeśli objętość danej masy gazu zmalała dwukrotnie, to gęstość gazu p{^p- dwukrotnie wzrosła.
- 67 -
Wyszukiwarka
Podobne podstrony:
Image14 (36) 117 Rozwiązania zadań ze zbioru "MENDLA Ze stanu 1 do stanu 2 gaz rozszerza się iz
Image15 (36) 119 Rozwiązania zadań ze zbioru "MENDLA Gaz przechodząc ze stanu A do stanu B zost
Image33 (24) 153_Rozwiązania zadań ze zbioru "MENDLA "_ Ze stanu 2 do 3 gaz przeszedł w wy
Image11 dokonuje się inwersji‘wyjść pamięci. Podobnie rozwiązano problem wyjścia ze stanu 2 do stanu
Zniekształcenia twarzy�4 międzyludzkich z osobami ze zniekształceniem twarzy. A więc stad$
Scan Pic0033 - ROZWIĄZANIA ZADAŃ Rozwiązanie zadania 2.1 Prawidłowa odpowiedź: B. Energia wewnętrzna
maszyny; jeśli w maszynie istnieje przejście ze stanu s do stanu s przy wejściu a, to diagram przej
Zniekształcenia twarzy�4 międzyludzkich z osobami ze zniekształceniem twarzy. A więc stad$
więcej podobnych podstron