skan0293

296 Elektrochemia
oraz
BH+ + H20 ^ B + H30+, (6.70)
Aa = ————, (6.71)
<7bH+
Przykład 6.16. Roztwory słabych kwasów i ich soli z mocnymi zasadami lub słabych zasad i ich soli z mocnymi kwasami tworzą tzw. roztwory buforowe. Obliczyć w 25°C pH roztworów: a) CH3COOH (pKa = 4,756); b) CH3COOH i CH3COONa; c) NH4OH (pAb = 4,75); d) NH4OH i NH4C1. W 25°C Kw = 1,008 ■ • 10-14. Stężenie każdego z tych składników wynosiło 0,1 M.
Rozwiązanie, a) stałą dysocjacji kwasu octowego HAc ^ H+ + Ac-wyraża równanie
Ka =
aH+aAc~
aHAc
Kwas octowy o stężeniu 0,1 M jest zdysocjowany w ok. 1%, toteż z dobrym przybliżeniem można przyjąć, że
= ^HAc _
"HAc- c& ~ c® ■
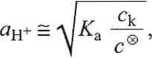
Wstawiając to do równania (1), po przekształceniu otrzymujemy wyrażenie
skąd możemy obliczyć przybliżoną wartość pH:
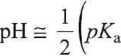
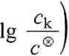
Y (4.756 -lg 0,1) = 2,878.
Dokładną wartość pH otrzymamy przekształcając równanie na Aa:
(ck-x)c®
gdzie ck jest początkowym stężeniem kwasu, a jc oznacza stężenie jonów H+. Współczynnik aktywności niezdysocjowanego kwasu przyjęto, jak zwykle, za równy 1.
x2yl + Kd c®x -Kackc® = 0. (2)
Wyróżnikiem tego równania jest wyrażenie
(3)
A = Kac® (Aac® + 4y+ck).
Wyszukiwarka
Podobne podstrony:
skan0273 276 Elektrochemia oraz w II prawie Ficka (6.31)dci = n d2Cj(x,t) dt U* dx
39748 skan0283 286 Elektrochemia Poza stanami równowagi 286 Elektrochemia oraz AG = -nFE, dE dT ,p A
skan0283 286 Elektrochemia Poza stanami równowagi 286 Elektrochemia oraz AG = -nFE, dE dT ,p AS = nF
img009 (70) nu fotosyntezy z odpowiednio wbudowanymi w błony fotosyntomami 1 przenośnikami elektronó
39748 skan0283 286 Elektrochemia Poza stanami równowagi 286 Elektrochemia oraz AG = -nFE, dE dT ,p A
image10 (3) 137. Narysuj schematy walencyjne, wzory elektronowe oraz budowę
536 KRONIKA usług administracyjnych świadczonych drogą elektroniczną oraz zagadnień zarządzania
s 78 78 ładowania zależą od struktury krystalicznej materiałów elektrodowych oraz od pasożytniczych
skan0284 287 Elektrochemia Jeśli zapisać E°(T) = a0 + axT + a2T2 + a2T3, to (dE°\~w)p = a +2aiT+^T =
skan0297 300 Elektrochemia 300 Elektrochemia ^nh4oh aNH4 pA b = pOH + lg skąd, po uwzględnieniu (6.6
więcej podobnych podstron