39748 skan0283

286 Elektrochemia
Poza stanami równowagi
286 Elektrochemia
oraz
AG = -nFE,
dE dT ,p
AS = nF
AH = nF
dE
dT
-E
(6.51)
(6.52)
(6.53)
gdzie AH, AS i AG oznaczają zmiany funkcji termodynamicznych w reakcji ogniwa w temperaturze T.
Przykład 6.13. Standardowa SEM ogniwa o schemacie -Pt,H2(l bar) |HC1| AgCl, Ag+ zmienia się z temperaturą t (°C) zgodnie z równaniem
E° = 0,23659 - 4.8564 • 1CT4/ - 3,4205 • 1()-6/2 + 5,869 • 10-9?3[V].
Obliczyć AG0, AH°, AS° i ACp dla reakcji ogniwa w 25°C oraz, korzystając z poniższych danych obliczyć wartości AG°, AH°, S° tworzenia jonu Cl- w temperaturze 25°C.
|
Funkcja |
H2 |
Cl2 |
Ag |
AgCl |
|
AH§9g [kJ • moR1] |
0 |
0 |
0 |
-126,8 |
|
S%>8 [J • K-1 • mol”1] |
130,5 |
223,0 |
42,69 |
96,07 |
Rozwiązanie. W rozważanym ogniwie, dla n = 1, biegnie reakcja (zob. przykład 6.12)
-jH2 + AgCl = H+ + Cl" + Ag.
Stosując podstawienie ł = T- 273,15, otrzymuje się
E°{T) = -5,5742 • 1(T3 + 2,6967 • 10”3 • T- 8,2299 • 10-6 • T2 + 5,8690 • 10“9 • T\
W T = 298,15 K, E° = 0,2224 V, toteż, zgodnie z równaniem (6.51), w tej temperaturze
AG° = -nFE° = -1 • 96485 • 10“3 • 0,2224 = -21,46 kJ • mol"1.
Według równania (6.52)
AS0 - nF
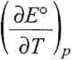
Wyszukiwarka
Podobne podstrony:
39748 skan0283 286 Elektrochemia Poza stanami równowagi 286 Elektrochemia oraz AG = -nFE, dE dT ,p A
skan0283 286 Elektrochemia Poza stanami równowagi 286 Elektrochemia oraz AG = -nFE, dE dT ,p AS = nF
skan0273 276 Elektrochemia oraz w II prawie Ficka (6.31)dci = n d2Cj(x,t) dt U* dx
skan0293 296 Elektrochemia oraz BH+ + H20 ^ B + H30+, (6.70) Aa = ————,
skan0284 287 Elektrochemia Jeśli zapisać E°(T) = a0 + axT + a2T2 + a2T3, to (dE°\~w)p = a +2aiT+^T =
skan0297 300 Elektrochemia 300 Elektrochemia ^nh4oh aNH4 pA b = pOH + lg skąd, po uwzględnieniu (6.6
skan0299 302 Elektrochemia ba rodzajów cząstek, które należy wziąć pod uwagę, wynosi 5 (ET, OH-, HA-
skan0281 284 Elektrochemia dla kilku molalności m w temperaturze 25°C wynosi m ■ 103 [mol • kg
skan0289 292 Elektrochemia Tabela 6.9 i /[M] Ig y± y± c [M] A ■, = C/_! - Ci 1 1,889 •
więcej podobnych podstron