skanowanie0010b
W reakcji I rzędu laki sam czas jest polr/uhtiy ilu się stę
żenia substratu od wartości C() do —% jak I od Wkirlnilul J do ^ czy od
2 ' 2 4
—p do -1-. Wszystkie te czasy są oczywiście równe okresowi połowicznej 4 8
przemiany. Ilustruje to rycina 1.12.
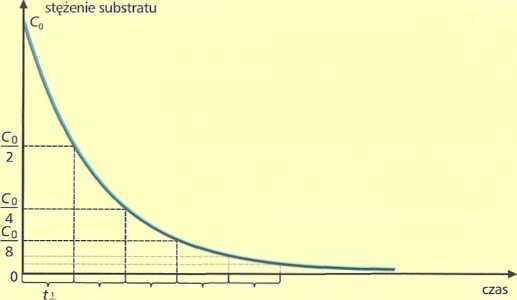
Ryc 1.12. Czas połowicznej przemiany w reakcji I rzędu nie jest zależny od początkowej] ilości substratu.
Czas połowicz-nej przemiany jest to czas potrzebny do zaniku potowy sub-Btratu.
W reakcji I rzędu jest on niezależny od początkowej ilości substratu.
Czas połowicznej przemiany najczęściej podaje się w celu scharakteryzowania szybkości rozpadu promieniotwórczego. Nazywa się go wtedy; również okresem półtrwania.
Bazując na szybkości rozpadu nuklidu U6C, można określać wiek zabyt-J kowych przedmiotów wykonanych z drewna. Zawartość 146Cw drewnie żyj wego drzewa jest równa zawartości tego nuklidu w atmosferze ze względia na ciągłą wymianę węgla w postaci C02 między organizmami żywymi a at-| mosferą. Od momentu ścięcia drzewa zawartość U6C w jego tkankach] stopniowo maleje. Oznaczając zawartość !JC w drewnianym zabytku i po-< równując ją z zawartością tego nuklidu w żywych tkankach roślinnych] można oszacować czas, jaki upłynął od ścięcia drzewa, z którego pozyskaj no drewno, czyli w przybliżeniu określić czas wykonania przedmiotu.
Przykład 3
Określ wiek drewnianego przedmiotu, wiedząc, że zawartość węgla ‘^C w przedmiocie jest równa 30% zawartości tego nuklidu w żywych tkankach roślinnych. Czas połowicznego rozpadu “C wynosi 5760 lat.
Rozwiązanie
I krok. Obliczenie wartości stałej szybkości rozpadu promieniotwórczego.
Jeśli
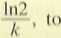
k
ln2
fi ’
czyli A
r krok. Obliczenie WAPtoloi C.
Ii mII zawartość 1'),(.! stanowi 30% zawartości początkowej, to: C f1 - 0,3 C0.
I kroki Wybór odpowiedniego wzoru.
I'imloważ należy policzyć t, mając dane C i C0, wybieramy wzór:
ln|p=8-«
krok. Obliczenie wartości liczbowej t.
tapSj- = 1,2*10 ~4-^r't
0,3 CM rok
rok
•t
i /V'l I i
1,204
= 104 lat
rok
1,2 ■ 10"4-
t Mlpowiedź: Wiek przedmiotu wynosi 10 tysięcy lat.
1 1.7. Reakcje II rzędu
Reakcje II rzędu są opisywane równaniem kinetycznym o postaci: v = k - [A] • [B]
|ak W wypadku reakcji syntezy jodowodoru: H2 + I2 —► 2 HI lub:
v = k - [A]2
|fik w wypadku reakcji rozpadu jodowodoru, gdzie reagują ze sobą dwie HtyNtCCzki tego samego substratu:
2 HI — H2 + I2
Zajmiemy się wyłącznie drugim rodzajem reakcji, w których w równaniu kinetycznym występuje stężenie tylko jednego substratu. Thk samo pi wprowadza się obliczenia dla reakcji o dwóch różnych substratach, je-<*li Roataly one użyte do procesu w jednakowych stężeniach. Wyrażenie lliml rujące zmianę stężenia substratu podczas przebiegu reakcji ma w ta-klill wypadku postać:
Jodnoslka itnln| szybkości roakojl II rzędu ma po*
8tań . mol • GZiłN •
na przykład; diii" djif mol1 ii 1 iiiuMr
g.l/lc r„ oznacza początkowe stężenie molowe substratu, C - stężenie molowe substratu pozostałe po czusic I od zapoczątkowania reakcji, A - siali) szybkości reakcji, i - c/as przebiegu reakcji. Zwróćcie uwagę, że W wypadku reakcji II rzędu w wymieniu lym ule można zastąpić stężeniu siihslrnlu Inną wielkością (np. masą tzy liyubą moli subslralu).
Wyszukiwarka
Podobne podstrony:
skanowanie0023 (3) pojem. (ładowanie kondensatora, nielarailayow.ski} jest baid/.o mnie i daje się z
IMG284 (5) Metrologia PW1 przypadkowy jest to błąd zmieniający się w sposób zarówno co do wartości b
skanowanie0006 (162) -fKwmSiiHfowodoru wm gazowej jest reakcją rzędu drugi§jS(pierwszego rzędu w-śra
skanowanie6 ■ Jak widać, wpływ dorosłego jest niewątpliwy. Ale zdaje się. że mamy tu także reakcję s
skanowanie0009o dwóm reakcjom I rzędu o dwóch równych wiiilnftiimli niulc
skanowanie0008jf niimiKłi i mwiiiłwngn onamioznn —_1.1.6. Reakcje I rzędu Szybkość
57630 skanuj0012 (342) ŚCISKANIE METALI KRUCHYCH Sposób przeprowadzenia próby jest w lym przypadku l
więcej podobnych podstron