skanuj0001 (590)

Analiza HPLC
Ćwiczenie:
Analiza materiału biologicznego za pomocą HPLC (wysokosprawnej chromatografii cieczowej)
I. Podstawy teoretyczne metody wysokosprawnej chromatografii cieczowej
Nazwą chromatografia obejmuje się metody rozdzielania mieszanin różnych substancji różniących się między sobą współczynnikiem podziału między fazą ruchomą i nieruchomą układu. Fazą nieruchomą może być ciało stałe lub ciecz naniesiona na odpowiedni nośnik, fazę ruchomą tworzą ciecze lub gazy. Wszystkie procesy chromatograficzne prowadzą do ustalenia się stanu równowagi podziału danej substancji między te dwie fazy. Rozdzielenie substancji następuje wtedy, gdy współczynniki podziału zmieszanych substancji wystarczająco różnią się od siebie. Drugą cecha wspólną metod chromatograficznych jest sposób postępowania polegający na tym, że mieszaninę rozdzielanych składników wprowadza się na początek warstwy fazy nieruchomej i przepuszczając następnie fazę ruchomą wzdłuż tego podłoża powoduję się wędrówkę po nim składników z różną szybkością co prowadzi do całkowitego lub częściowego rozdzielenia mieszaniny.
Klasyfikacja metod chromatograficznych:
a) stan skupienia fazy ruchomej gazowa (GC)
cieczowa (LC) w fazie nadkrytycznej (SFC)
b) stan skupienia fazy stacjonarnej gaz/ciecz
ciecz/ciecz gaz/ciało stałe ciecz/ciało stałe
c) natura zjawisk będących podstawą procesu chromatograficznego adsorpcyjna
podziałowa
jonowymienna
sitowa
Wysokosprawna chromatografia cieczowa (High Performance Liquid Chromatography, HPLC) jest szeroko stosowaną metodą analityczną i preparatywną analogiczną do chromatografii gazowej. Każda z nich ma jednak swój zakres zastosowań. Związki organiczne o niskiej lotności i trwałości mogą być analizowane tylko z zastosowaniem wysokosprawnej chromatografii cieczowej (HPLC).
W chromatografii cieczowej stosowane są dwie konkurujące fazy: ruchoma i stacjonarną dzięki czemu możliwe jest rozdzielenie niemożliwe do osiągnięcia metodą chromatografii gazowej.
Faza ruchoma (eluent) składa się zazwyczaj z dwóch mieszających się rozpuszczalników. Jest ona pompowana przez kolumnę tak, aby możliwe było rozdzielenie wszystkich składników w odpowiednim czasie. W przypadku rozdzielania w normalnym układzie faz zdolność elucyjna rozpuszczalnika wzrasta wraz z jego polamością W odwróconym układzie faz zdolność elucyjna rozpuszczalnika zmniejsza się wraz ze wzrostem jego polamości. Rozpuszczalniki stosowane jako fazy ruchome powinny odznaczać się niską reaktywnością Fazą stacjonarną zazwyczaj jest ciało stałe (chromatografia adsorbcyjna), najczęściej krzemionki lub usieciowane kopolimery styrenu z diwynylobenzenem Może to być także ciecz osadzona na nośniku (chromatografia podziałowa).
Zasada działania chromatografu cieczowego.
Ze zbiornika za pomocą pompy zasysana jest faza ruchoma zwana eluentem (rozpuszczalnik). Eluent wtłaczany jest pod zwiększonym ciśnieniem do kolumny wypełnionej fazą stacjonarną. Kolumna może być umieszczona w termostacie. Za pomocą mikrostrzykawki do strumienia cieczy wprowadzana jest próbka, której składniki rozdzielane są w kolumnie i wykrywane przez detektor. Sygnał elektryczny z detektora po wzmocnieniu, zapisywany jest w pamięci komputera w postaci serii pików chromatograficznych.
Schemat blokowy chromatografu cieczowego:
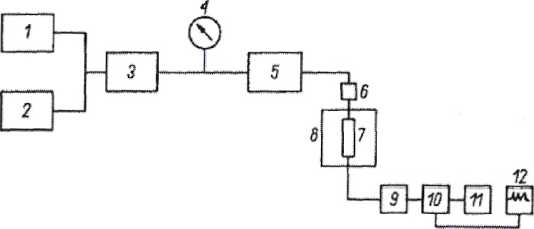
1,2 - zbiorniki eluentów
3 -pompa
4 - manometr
5 - dozownik
6 - przedkolumna
7 - kolumna chromatograficzna
8 - termostat kolumny
9 - przepływomierz
10 -detektor
11 - kolektor frakcji
12 - rejestrator lub komputer
W chromatografii cieczowej stosowane są różnego rodzaju detektory m.in:
|| detektory spektrofotometryczne UV-VIS (działanie oparte na pomiarze absorbancji rozdzielanych składników, zawierających grupy chromoforowe, w zakresie nadfioletu lub światła widzialnego)
2. detektory fluoiymetryczne (reagują selektywnie na substancje, które same fluoryzują)
3. detektory refraktometryczne (działanie zależy od różnicy między współczynnikami załamania światła czystej fazy ruchomej i tej z rozpuszczonym składnikiem próbki).
2
Wyszukiwarka
Podobne podstrony:
Zastosowanie metod chromatograficznych w analizie materiału biologicznego Każdy układ biologiczny je
skanuj0066 2 strzeni poetyckiej. Analizują środki językowe, za pomocą których Mickiewicz opisał oglą
18
Przeprowadzono analizę poziomu nasłonecznienia za pomocą narzędzia LSS Chronolux programu Sketchup 7
Analiza jakości i odnowienia produkcji • analiza jakości produkcji za pomocą znaku
Momentów akurat nie można przewidzieć za pomocą analizy rozumowej, jedynie za pomocą wróżb, proroczy
8. Analiza skoków i wyskoków za pomocą platformy piezoelektrycznej Kistlera. 9.
Genowefa Ślósarek Analiza strukturalna białek za pomocą spektroskopii NMR Wydawnictwo Naukowe UAM
_Jan Sebastian Bach i retoryka. Analiza kantaty BWV159_ Za pomocą figury circolo odtwarza Bach słowo
Alfabetyczny wykaz kursów Alternatywne antropologie psychologiczne Analiza wyników badań za pomocą
Ćwiczenie nr 2-15 (GR2) Temat: Badanie struktur biologicznych za pomocą mikroskopu akustycznego Opie
Ćwiczenie nr 2-15 (GR2) Temat: Badanie struktur biologicznych za pomocą mikroskopu akustycznego Opie
skanuj0021 Ćwiczenie 1Wyznaczanie przyspieszenia ziemskiego za pomocą wahadła prostego 1.
Ćwiczenie 9Wyznaczanie napięcia powierzchniowego za pomocą kapilary 9.1. Wstęp teoretyczny Napięcie
więcej podobnych podstron