Img00012 (2)
16
E = hv = hc/A. (1.12 1)
gdzie: h jest stałą Plancka, równą 6,625 • 10 34 J-s, a c — prędkością światła w próżni, równą 3 • 108 m/s.
a)
E, eV
0
■ ■ - 0,85 ■- 1,5
--3,i
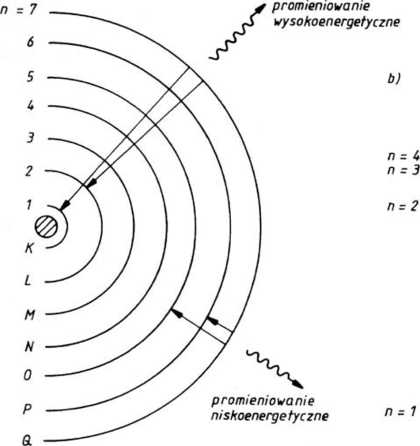
Rys. 1.12-1. Powłoki elektronowe atomu (a); poziomy energetyczne atomu wodoru (b)
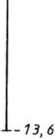
Liczba stanów kwantowych jest teoretycznie nieograniczona. W praktyce, elektrony przebywają najczęściej w stanie o najniższej wartości energii i taki stan nosi nazwę stanu podstawowego (por. rys. 1.12-lb dla atomu wodoru). Ujemna wartość energii wynika z założenia, że energia elektronu w odległości nieskończenie wielkiej od jądra jest równa zeru. W miarę zbliżania się do jądra energia elektronu przyjmuje wartości coraz bardziej ujemne. Wszystkie inne stany ponad podstawowym nazywane są stanami wzbudzonymi. W normalnych warunkach ciśnienia i temperatury atomy znajdują się w stanie podstawowym.
1.13. Druga liczba, zwana orbitalną liczbą kwantową /, określa możliwość istnienia w poszczególnych powłokach elektronowych różnych warstw orbit (zwanych nieraz podpowłokami) o jednakowych kształtach.
W odróżnieniu od głównej liczby kwantowej liczba orbitalna może przybierać ograniczoną liczbę wartości — maksymalnie n. Przybiera ona wartości liczb
Wyszukiwarka
Podobne podstrony:
2 (E ) równy cenie p. Pochodna funkcji przychodu całkowitego w postaci py, gdzie p jest stałą jest r
Untitled 12 (5) GDZIE JEST BUT? ©W8R RELACJE CZASOWE 1 PRZESTRZENNE
82889 Untitled 12 (5) GDZIE JEST BUT? ©W8R RELACJE CZASOWE 1 PRZESTRZENNE
skanuj0029 56 56 jest czę gdzie O jest stałą, nazywaną amplitudą (kątową) drgań, co = stością kołową
DSCF6584 124 gdzie A jest stałą o wymiarze lepkości, E,^ oznacza energię aktywacji, R - stałą gazową
2012 12 10! 24 16 iii5.12*K>12i 1. ha ciało o masie 20 leg ? = -jx .5**, gdzie
Zdjęcie06p 12 Czym jest preszpan i gdzie jest stosowany 13 Wymie
img016 16 dl a 0,1 M an (14) gdzie 0,1 na jest, jak poprzednio, najmniejszą długoś
img035 35 Rozdział 3. Liniowe sieci neuronowe albo prościejv 3)=ww gdzie A jest pewną ustaloną stalą
img049 49 t &FM[x(t)] * k J x(t)dt (1.2.31) ♦o gdzie k [rad/Vs] jest stałą »od
skanowanie0064 gdzie n jest koncentracją atomów, k - stała Boltzmana.11. Iloczyn skalarny dwóch wekt
K Ml objytoić jest stała można ja wprowadzić pod znak róźnczki I wtad<f- gdzie: C - Myźenia motow
więcej podobnych podstron