IMGX13 (4)

5
Teoria orbitali molekularnych w odniesieniu do kompleksów jonów metali przejściowych nosi nazwę teorii pola ligandów. Podobnie jak elektrony d rozpatrywane są także elektrony /
Elektrony d rozmieszczają się na orbitalach kolejno począwszy od najniższych, przy czym oprócz zakazu Pauliego, który pozwala na obecność na jednym poziomie d tylko dwóch elektronów o spinach antyrównoległych, obowiązuje reguła Himda, w myśl której układ jest tym bardziej stabilny im więcej elektronów na orbitalach tego samego typu (w tym przypadku d) ma spiny równoległe.
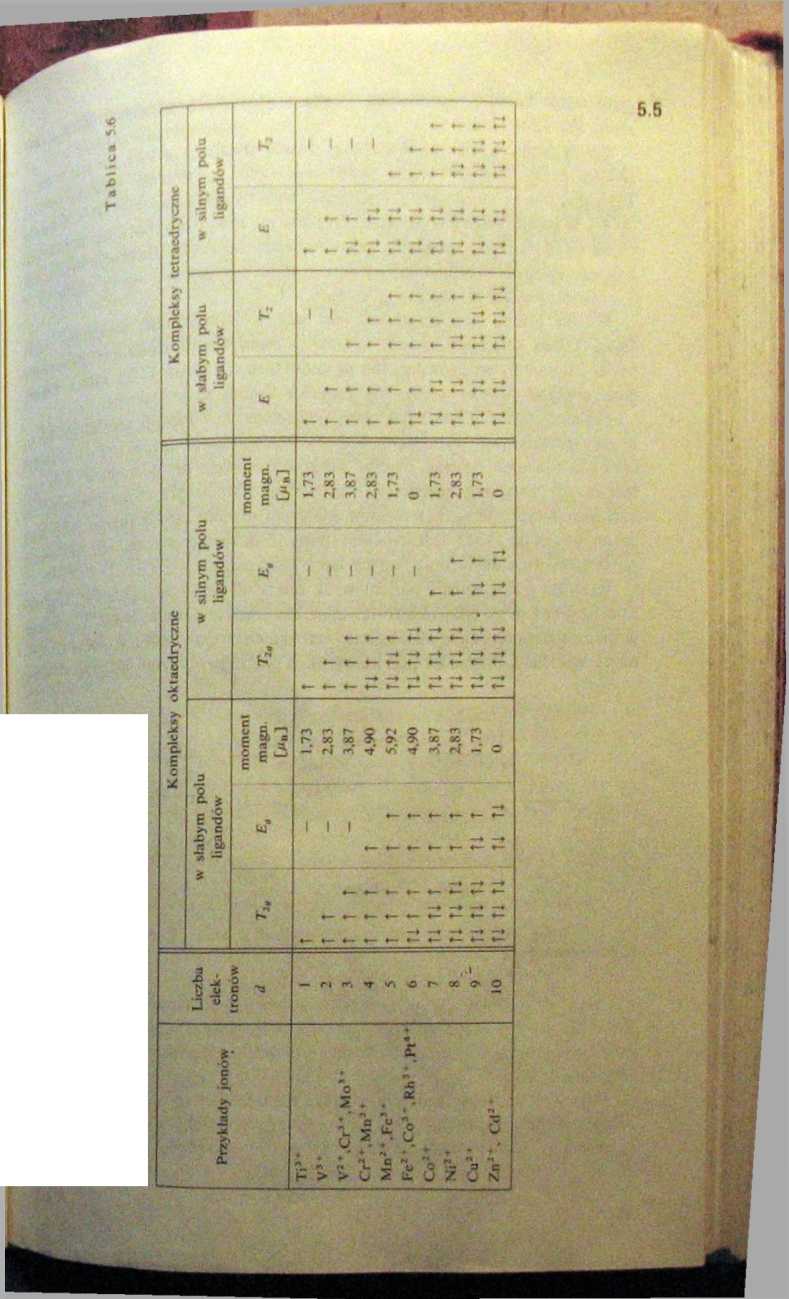
W kompleksach oktaedrycznych mających do trzech elektronów d potrójny poziom Tlg o niższej energii zostaje zapełniony elektronami p spinach równoległych. Czwarty i piąty elektron d w myśl reguły Hunda powinien się znaleźć na podwójnym poziomie E„, ale poziom ten ma wyższą energię, co nie sprzyja trwałości układa W konkurencji tych dwóch przeciwstawnych efektów któryś przeważa, zależnie od rodzaju tigandów i wielkości rozszczepienia poziomów, A. W słabym polu ligandów, gdy A jest małe, trwalszy jest układ spełniający regułę Hunda, natomiast w silnym polu ligandów, w którym A jest duże, układem trwalszym jest układ o maksymalnej liczbie sparowanych elektronów. Jako przykład może posłużyć jon Fe2* o konfiguracji elektronowej 3d6. W kompleksie [Fe(H20)6]J+, w którym A jest małe (10400 cm-1), przeważa rozkład zgodny z regułą Hunda, czyli cztery niesparowant elektrony. Taki kompleks ma duży moment magnetyczny i nazywany jest wysoko-spinowym. W kompleksie [Fe(CN)6]4“ wartość A wynosi 33000 cm”1 i znalezienie się elektronów d na wyższym poziomie Eg byłoby energetycznie bardzo niekorzystne, toteż wszystkie elektrony znajdują się na niższym poziomie % i muszą być parami antyrównoległe. Ten kompleks nie ma momentu magnetycznego i nazywa się niskoSpinowym.
W kompleksach tetraedrycznych niższym poziomem jest dwukrotnie zdegenero-wany poziom E i rozkłady elektronów są inne. Obsadzenia poziomów d w kompleksach oktaedrycznych i tetraedrycznych przedstawiono w taH. 5.6.
Rozszczepienie poziomu d stwarza sytuacje, w których elektrony mogą sę przenosić z poziomu niższego na wyższy, pochłaniając foton o częstości v = d. Tafcie przejścia elektronowe nazywamy przejściami d-d. Różne możliwości tych przejść w jonach mających od 1 do 9 elektronów d wynikają z analizy danych zawartych w tabl. 5.6.
Trzeba teraz zastanowić się nad regułami wyboru. Przede wszystkim w kompleksach oktaedrycznych, które mają środek symetrii, oba orbitale TJf i £f są symetryczne względem środka symetrii (indeks g). Reguła Laporte'a głosi, a przejścia g~*g Jub u -* u są zabronione, bo momenty tyvń przejść [wzór (5.13)] f równe zeru. Oznacza to, że w kompleksach oktaedrycznych przejścia d-4 zabronione. Mimo to przejścia te następują. Naruszenie reguły Laporte'a wyniki stąd, że ligandy wykonują oscylacje względem jonu centralnego, w czasie których symetria kompleksu chwilowo się obniża i pojawiają się domieszki przejść g -*tt które są dozwolone. W rezultacie tego sprzężenia wibronowego pojawiają się pasma absorpcji o niewielkiej intensywności. Moc oscylatora takich przejść jest rzędu ||®| a współczynnik absorpcji b&h rzędu 10.
W kompleksach tetraedrycznych nie mą środka symetrii i przejścia d-d nie |
Rozkład elektronów d w kompleksach jonów metali przejściowych
Wyszukiwarka
Podobne podstrony:
DSCN2172 (2) orbitali molekularnych mamy do czynienia z poziomami homo i lumo, to w tej teorii wystę
6. Wprowadzenie do struktury cząsteczek. Teoria orbitali molekularnych (LCAO
DSC01341 (9) Teoria orbitali molekularnych RZĄD WIĄZANIA dla cząsteczki Oz Oz: log2 lou2 2og2 In,,1
Scanned picture 27 (5) jpeg kowych w odniesieniu do stężenia jonów wodorowych. Przy pi I 4.6 białka
W LADO MOŚCI 1998, 52, 1-2 chemiczne pl issn 0043-5104 ŁAD W BEZŁADZIE, CZYLI KOMPLEKSY JONÓW METALI
29 Teoria J. Kornai‘a bedzie jeszcze przywoływana w niniejszej pracy. Jej zasadność w odniesieniu do
CCF20071022�007 254 Psychologia rodziny: teoria i badania i rozwój, mogą się uaktywniać w odniesieni
7 (741) SYSTEMATYKA: MORFOLOGICZNA I MOLEKULARNA 79 ; Cecha pierwotna w odniesieniu do innych v
nacisk na niepewność przyszłości w odniesieniu do przyczyn. Drugi nurt związany jest z teorią zarząd
edta2 2 Podaj kolejność tworzenia się kompleksów podczas dodawania EDTA do mieszaniny jonów Cu2* Ba2
TEORIA SKONCENTROWANA NA OSOBIE teoria powstała w odniesieniu do doświadczeń z psychicznej
3. Teoria działania komunikacyjnego J. Habermas Czyste typy działań, odniesienie do świata i roszcze
więcej podobnych podstron