P5101287
Odpowiedź:
Zadanie 10 (4 punkty)
W oparciu o koncepcję VSEPR uzupełnij tabelkę:
|
cząsteczka lub jon |
NH, |
NH/ |
h2o |
HjO* |
|
typ hybrydyzacji atomu centralnego |
spJ |
sp5 | ||
|
liczba wolnych par elektronowych na atomie centralnym |
brak |
1 | ||
|
liczba wiązań o | ||||
|
kształt przestrzenny |
tetraedr |
piramida trygonalna | ||
|
kąt między wiązaniami |
-107° |
-105° |
H
a
Odpowiedź:
|
cząsteczka lub jon |
NH, |
NH/ |
h2o |
H}0+ |
|
typ hybrydyzacji atomu centralnego |
sp* |
sp5 |
sp5 |
sp* |
|
liczba wolnych par elektronowych na atomie centralnym |
1 |
brak |
2 |
1 |
|
liczba wiązań o |
3 |
4 |
2 |
3 |
|
kształt przestrzenny |
piramida trygonalna |
tetraedr |
układ kątowy |
piramida trygonalna |
|
1 kąt między wiązaniami |
-107° |
109°28’ |
-105° |
-107° |
Zadanie 11 (1 punkt)
Który z modeli nakładania się dwóch orbitali atomowych ilustruje powstawanie wiązania sigma, a który pi? Wpisz właściwą odpowiedź.
Odpowiedź:
Wiązanie sigma: a, c, d. Wiązanie pi: b.
Zadanie 12 (2 punkty)
Omów mechanizm tworzenia cząsteczki amoniaku, a następnie przedstaw na rysunku jej budowę przestrzenną.
Odpowiedź:
AE = 3,0 - 2,1 = 0,9 => pomiędzy atomem wodoru a atomem azotu tworzy się wiązanie atomowe spolaryzowane
Atom azotu do tworzenia tych wiązań wykorzystał już trzy z pięciu elektronów walencyjnych - dwa pozostałe stanowią wolną parę elektronową => cząsteczka ma kształt piramidy trygonalnej.

H
Zadanie 13 (2 punkty)
Przedstaw schemat nakładania się zhybrydyzowanych orbitali atomu berylu (hybrydyzacja sp) z orbitalami 3py atomów chloru w cząsteczce BcClr Przyjmij, że oś y jest osią łączącą jądra atomów.
Odpowiedź:
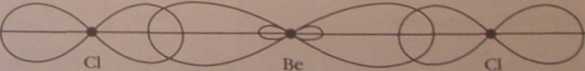
Wiązania i In nikno Bodowa cząscccskL
41
Wyszukiwarka
Podobne podstrony:
P5101382 Zadanie 10 (2 punkty) yń
Zadanie 10. (3 punkty)Przy każdym utworze podaj nazwę środka stylistycznego często wykorzystywanego
PRZYKŁADOWE ODPOWIEDZI Zadanie 10. (0-3) Przeczytaj tekst. Uzupełnij w e-mailu luki 10.1.-10.3. zgod
P5101423 Zadanie 10 (4 punkty) Sacharoza - w przeciwieństwie do innych disacharydów - nie wykazuje w
P5101429 Zadanie 10 (2 punkty) Jak doświadczalnie sprawdzić, czy: - winogrona zawi
89308 P5101343 Zadanie 10 (2 punkty) w tabeli podano wartości entalpii tworzenia określonych
arkusz dII + odpowiedzi0003 Zadanie 10. (4 pkt.) W stanic równowagi reakcji N2<s> + 3H2Ik, ► 2
arkusz eI + odpowiedzi0003 Zadanie 10. (4 pkt.) Ustal, ile dmł wodv i ile gramów 98-orocentowego roz
więcej podobnych podstron