39601 Obraz (2638)
24
Wyznaczenie i^iAłaia następuje na podstawie równania (3.51) przez pomiary SEM przy różnych, niezbyt wysokich stężeniach HC1, a następnie przez graficzną ekstrapolację otrzymanych wyników.
Gdy już znamy £2^ Ag możemy wyliczyć średnie współczynniki aktywności roztworu kwasu solnego dla dowolnych jego stężeń korzystając z pomiaru SEM w danym roztworze.
Weżm> z kolei ogniwo:
Zn|ZnCl2(m), Hg2Cl2|Hg
o reakcji sumarycznej:
Zn + Hg2Cl2 — Zn1'-2CI'+2Hg
i SEM określonej równaniem:
(3.54)
(3-55)
£■*£•• — — lnaŁi • aa
podstawiając:
Qzn“ = mm aa- - 2my_; y\ = y+yl
mamy:
£ = £°-|Jln4mV±
skąd
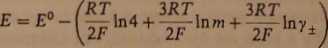
(3.56)
i konsekwentnie dalej:
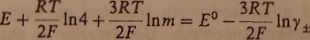

(3.57)
(3.58)
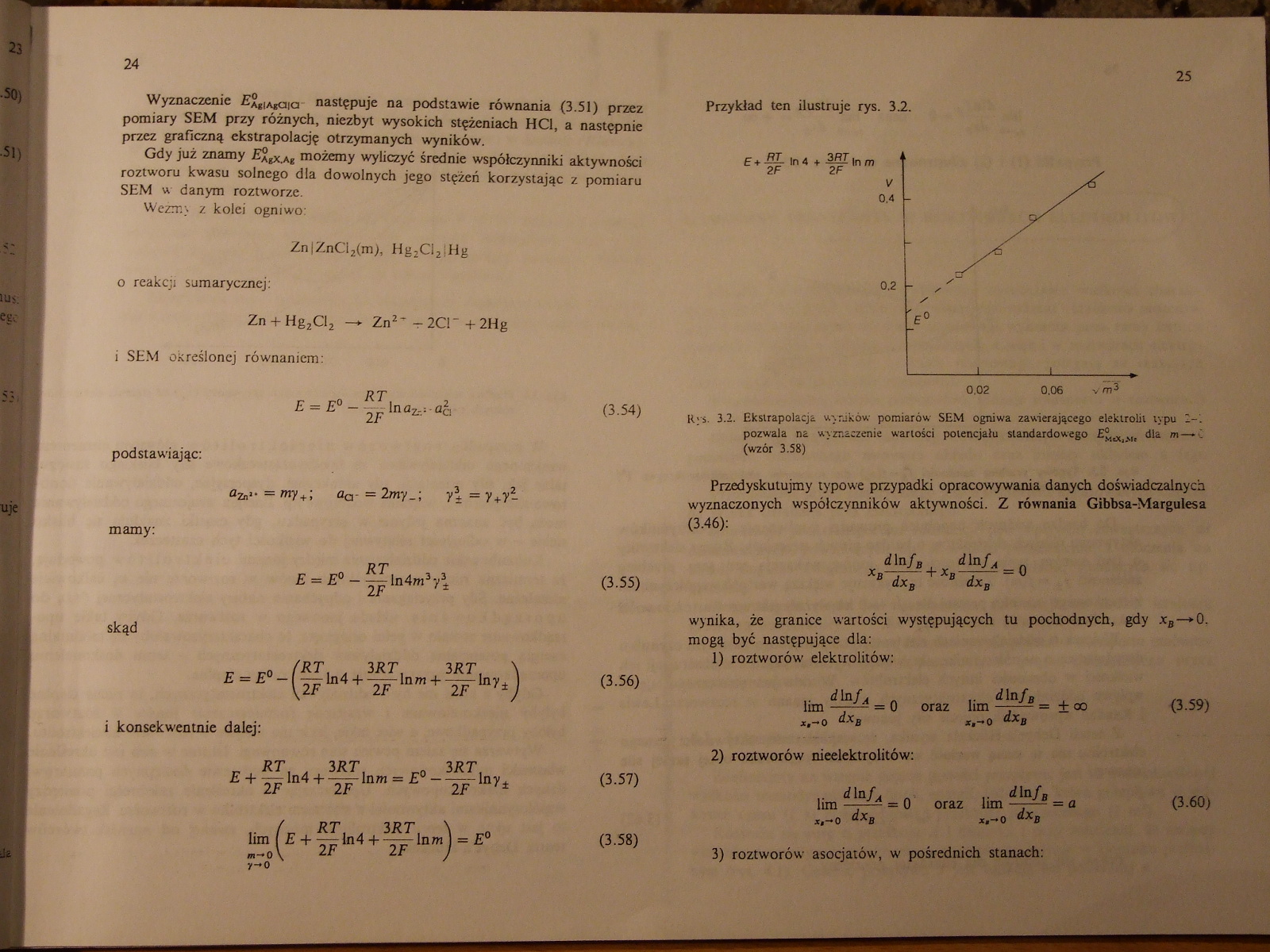
Przykład ten ilustruje rys. 32.

V
0.4

0.02
0,06
Rys. 3.2. Ekstrapolacji wyników pomiarów SEM ogniwa zawierającego elektrolit typu 2-'.
pozwala na wyznaczenie wartości potencjału standardowego Ej,^,, dla m—■ C (wzór 3.58)
Przedyskutujmy typowe przypadki opracowywania danych doświadczalnych wyznaczonych współczynników aktywności. Z równania Gibbsa-Margulesa
(3.46):
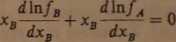
wynika, że granice wartości występujących tu pochodnych, gdy xB—*0. mogą być następujące dla:
1) roztworów elektrolitów:

(3.59)
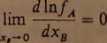
.. dlnfB oraz lun —
roztworów nieelektrolitów:
(3.60)
roztworów asocjatów, w pośrednich stanach:
Wyszukiwarka
Podobne podstrony:
Obraz 5 4 192 Następnie na podstawie próby obliczamy wartość empiryczną sprawdzianu: 192 /i fi u Jeś
14 Egzamin maturalny z historii sztuki Poziom podstawowyZadanie 24. (2 pkt) Wykonaj polecenia na pod
P1270011 24. Normy stenowe opracowane na podstawie próby studentów III roku psychologii sł przykłade
Rozwiązanie i likwidacja zgrupowania 9Rozwiązanie zgrupowania następuje na podstawie decyzji członkó
Sposób zawarcia umowy o pracę i formy:_Najczęściej zawarcie umowy następuje na podstawie przyjęcia p
Krzywa przepływu: Krzywa przepływu pomaga nam wyznaczyć natężenie przepływu na podstawie stanu
Slajd9 (106) Współpraca z magistralą (BIU) Układ sprzęgający BIU wyznacza adres fizyczny na podstawi
skany018 gdzie lD ID(UD) - zgodnie z charakterystyką diody. Zatem na podstawie równania (3.12) wyzna
skany032 gdzie I0 --- ID(UD) - zgodnie z charakterystyką diody. Zatem na podstawie równania (3.12) w
więcej podobnych podstron