54244 skan0267

270 Elektrochemia
270 Elektrochemia
8,199- 105 (cT)m
8,199 • 105 (78,54-298,15)372
= 0,2288 [M-1/2],
8,246-lO^4__8,246 • 10~4_
rj{eT)m ~ 0,894 • 10~3(78,54 ■ 298,15)172
= 6,027 • 10~3 [S • m7/2 • mor372].
Dla elektrolitu 1-1 siła jonowa jest równa stężeniu, / = c. (w równaniu (6.14a) stężenie wyrażono, jak zazwyczaj, w [M]). Po wstawieniu wartości tych stałych do równania (6.14) otrzymamy
A = 272,6 • 10"4 - (0,2288 • 272,6 • 10-4 + 6,027 • 10"3) • Vo7oT =
= 260,3 • 10“4 S • m2 • mol-1. ■
Wielkość
Xj = \Zj\n}F (6.18)
nosi nazwę przewodności jonowej jonu i, gdzie n-t jest jego ruchliwością. Zgodnie z prawem Kohlrauscha o niezależnej wędrówce jonów w rozcieńczeniu nieskończenie wielkim
A0 = I(v,vioi). (6.19)
I
gdzie sumowanie rozciąga się na kationy i aniony, na które dysocjuje cząsteczka elektrolitu Av Bv_. Między przewodnością jonową a używaną dawniej przewodnością równoważnikową jonu /,• istnieje prosty związek:
K = \zj\ - /,-. (6.20)
Dla słabych elektrolitów, zgodnie z równaniem Arrheniusa, stopień dyso-cjacji a wynosi
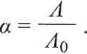
(6.21)
Przykład 6.5. Graniczna przewodność molowa kwasu octowego w 25°C wynosi A0 = 390,5 • 10-4 fiT1 • m2 • mol-1. Oporności naczynka o stałej k = 20,6 m-1, zanurzonego w roztworach kwasu octowego o różnych stężeniach, wynoszą
|
c • 103 [M] |
0,49 |
0,99 |
3,14 |
15,81 |
63,23 |
252,9 |
|
R[Q] |
6146 |
4210 |
2305 |
1004 |
497 |
253 |
Wyznaczyć zależność A od stężenia oraz stałą dysocjacji kwasu octowego.
Wyszukiwarka
Podobne podstrony:
skan0284 287 Elektrochemia Jeśli zapisać E°(T) = a0 + axT + a2T2 + a2T3, to (dE°\~w)p = a +2aiT+^T =
skan0297 300 Elektrochemia 300 Elektrochemia ^nh4oh aNH4 pA b = pOH + lg skąd, po uwzględnieniu (6.6
skan0299 302 Elektrochemia ba rodzajów cząstek, które należy wziąć pod uwagę, wynosi 5 (ET, OH-, HA-
39748 skan0283 286 Elektrochemia Poza stanami równowagi 286 Elektrochemia oraz AG = -nFE, dE dT ,p A
elektro2 2 .4 i £ 105 ~ p4 =)
skan0281 284 Elektrochemia dla kilku molalności m w temperaturze 25°C wynosi m ■ 103 [mol • kg
skan0289 292 Elektrochemia Tabela 6.9 i /[M] Ig y± y± c [M] A ■, = C/_! - Ci 1 1,889 •
skan0277 280 Elektrochemia z którego można łatwo obliczyć wartość A. Dla wody w 25°C statyczna przen
więcej podobnych podstron