63960 skan0295

298 Elektrochemia
a stąd
(6)
_ (^soli (-H+) aAc~~ ę ® );± •>
gdyż dla elektrolitu 1-1, zgodnie z teorią Debye’a-Hiickla, y± = y_ = y+. Współczynnik aktywności niezdysocjowanego kwasu jest równy 1, a zatem
(7)
_ (<T ~ CH+) flHAc ~ c®
cH+ (oznaczone, jak poprzednio, przez x) oraz y± wyznaczymy z wyrażenia na 7Ca:
„ _ (aH+aAc-) _ x{csoh + x)yl
«HAc (ck-*)c®
Po jego przekształceniu dostajemy równanie kwadratowe
x2yl + x(csouy± + A'ac®) -K.dckc® = 0. (8)
Tak jak poprzednio, metodą kolejnych przybliżeń, znajdujemy stężenie jonów H+ i współczynnik aktywności, który obliczamy, korzystając z prawa De-bye’a-Huckla (6.39):
0,509111 • (-1)lV(cs„ii + *) lgy± =--i -•
1 + Wsoli + X)
Wyniki obliczeń zestawiono w tab. 6.12.
Tabela 6.12
|
i |
7[M] |
log y± |
y± |
A |
xi [M] |
aH- |
pH | |||
|
1 |
1 |
1,001 • |
10“2 |
1,753 |
10“5 |
1,753 • |
10“5 |
4,756 | ||
|
2 |
0,1000 |
-0,12232 |
0,755 |
3,247 |
10“3 |
3,079 |
lO"5 |
2,323 • |
io~5 |
4,634 |
|
3 |
0,1000 |
-0,12233 |
0,755 |
3,247 |
10~3 |
3,079 |
io--5 |
2,323 • |
10"5 |
4,634 |
W tym przypadku już dla i = 3 otrzymujemy poprawmą wartość x oraz y±. a pH obliczamy korzystając wprost z definicji:
pH = -lg aH+ = -lg
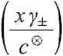
-Ig
3,079-10-5-0,755
1
4,634.
W obliczeniach przybliżonych korzysta się ze wzorów (5)—(7), przy czym pomija się stężenie jonów H+ jako bardzo małe w porównaniu ze stężeniem soli czy kwasu, a także przyjmuje się, że y± = 1. Wówczas wyrażenie (5) przybiera spotykaną często postać
Wyszukiwarka
Podobne podstrony:
skan0289 292 Elektrochemia Tabela 6.9 i /[M] Ig y± y± c [M] A ■, = C/_! - Ci 1 1,889 •
skan0271 274 Elektrochemia a stąd mamy F_ <1 t+ = Ank Wyraźnie widać, że powyższy wrzór różni s
skan0277 280 Elektrochemia z którego można łatwo obliczyć wartość A. Dla wody w 25°C statyczna przen
31199 skan0277 280 Elektrochemia z którego można łatwo obliczyć wartość A. Dla wody w 25°C statyczna
skan0287 290 Elektrochemia Obliczony stąd współczynnik aktywności y± = 0,838 uwzględniamy w wyrażeni
54244 skan0267 270 Elektrochemia 270 Elektrochemia 8,199- 105 (cT)m 8,199 • 105 (78,54-298,15)372 =
więcej podobnych podstron