64377 S0038 (2)
I Selektywne tworzenie wiqzań węgiel węgiel
Zastosowanie sekwencji reakcji: tworzenie estru aryloboronowego (reakcja Miyaury) — wewnątrzcząsteczkowa reakcja Suzuki pozwala z dobrymi wydaj ilościami otrzymywać związki makrocykliczne, w tym antybiotyki (schemat
1.7.5) [13].
V Pochodne poli(l,4-fenylenowinylenu) (PPV) są wykorzystywane w elektroop-Ivcc. Dotychczasowe metody wykorzystujące reakcje Homera lub Wittiga nic
M c< >
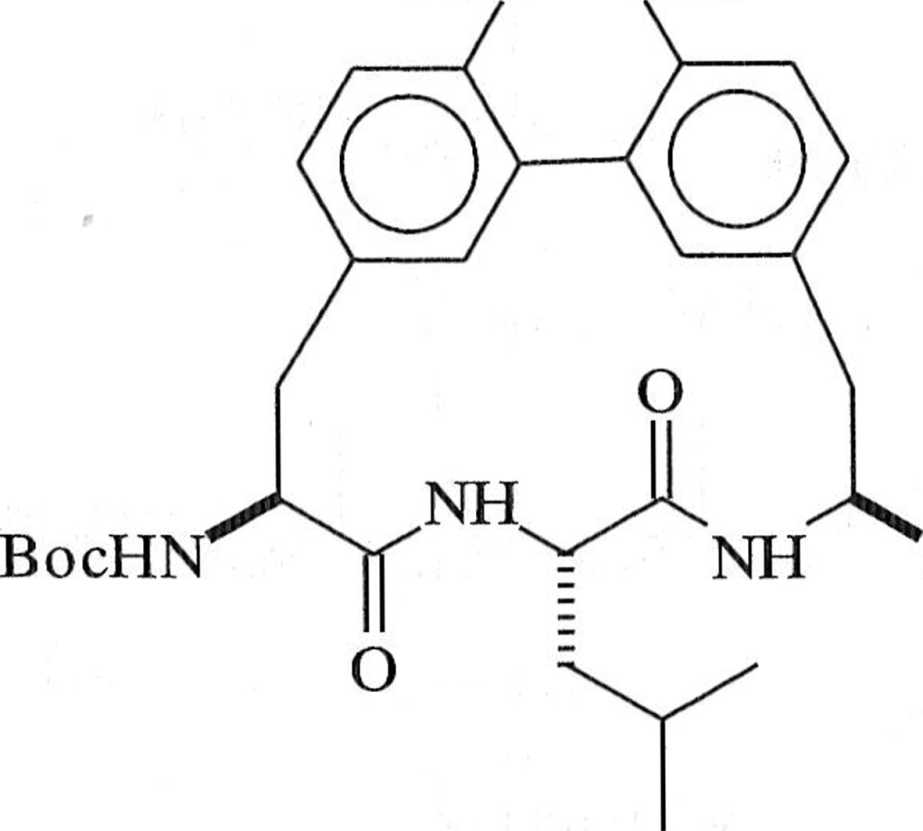
NHBoc
X
NH
O
O

COOMe
NH
OMe
reakcja Miyaury
NHBoc
NH
O
O

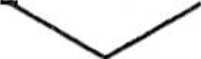
COOMe
NH
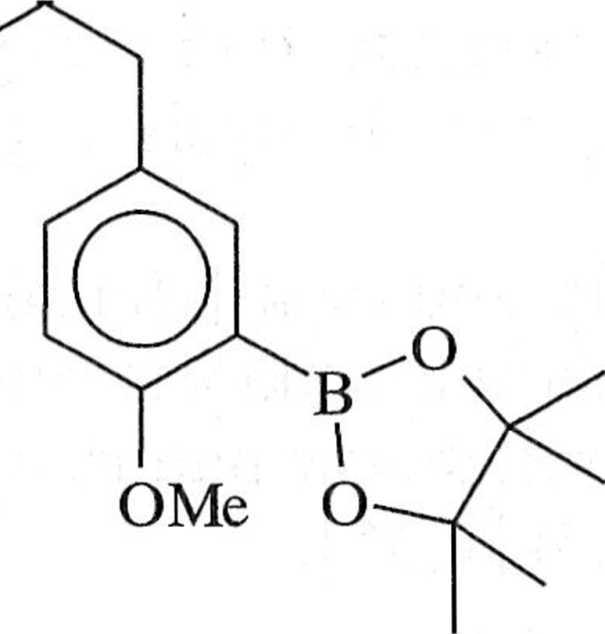
Pd(DPPF)2Cl2
KOAc / DMSO reakcja Suzuki
MeO OMe
COOMe
Schemat 1.7.5

1.7. Reakcja Suzuki

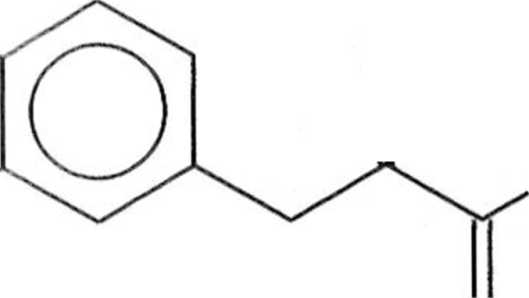
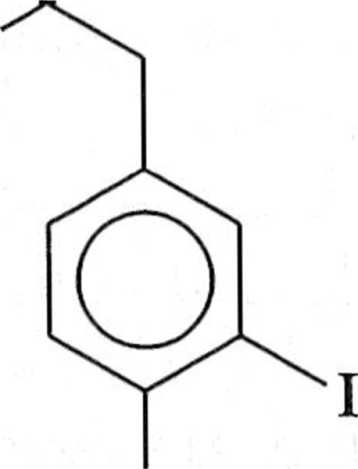
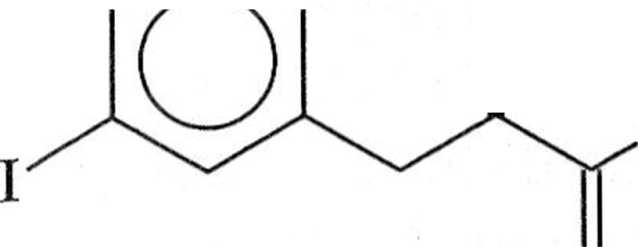
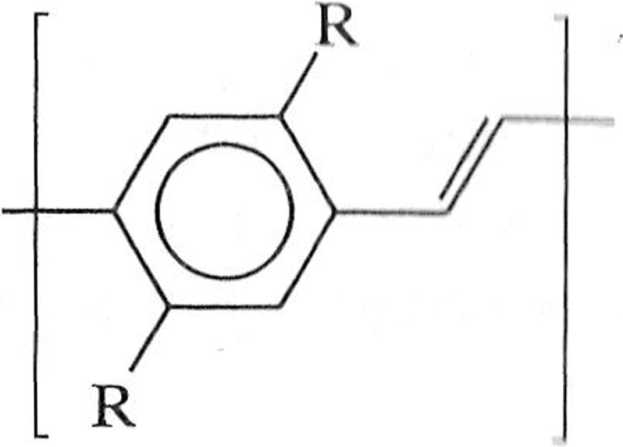
.i przydatne do syntezy polimerów o dużej masie molowej. Podstawione PPV mogą być alternatywnie otrzymywane w reakcji Hecka, ale należy się liczyć powstawaniem regioizomerów. Dogodną metodą otrzymywania podslawio nyeh PPV jest reakcja między £-l,2-dibromoetenem a kwasami arylodiboro nowymi (schemat 1.7.6) [1],
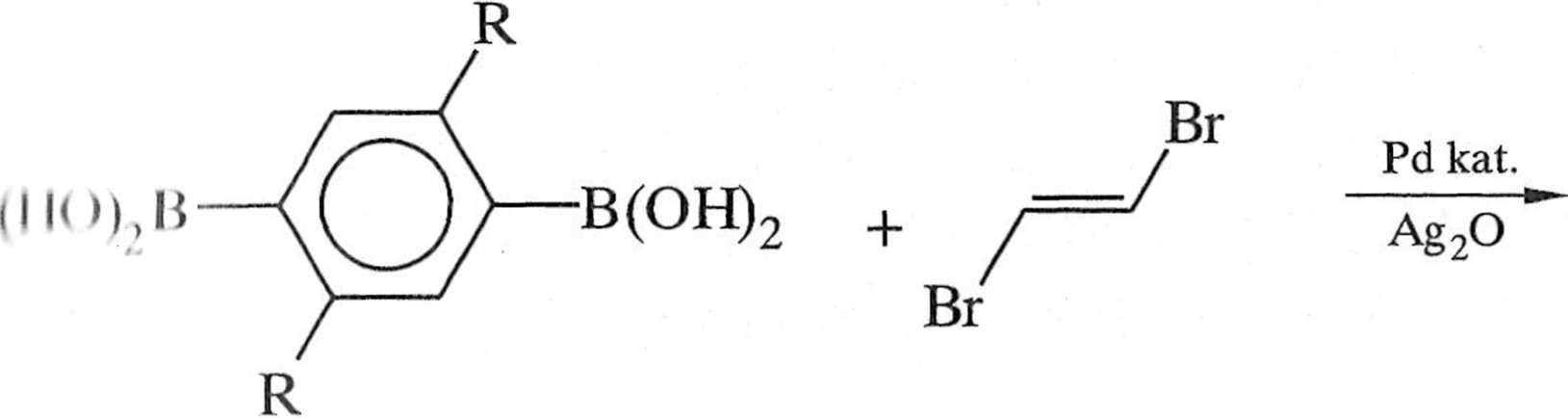
Schemat 1.7.6
i Reakcja Suzuki nadaje się szczególnie dobrze do syntezy zatłoczonych prze n ze unie układów biarylowych zarówno karbo-, jak i heterocyklicznych (sclie mai 1.7.7). Ostatnio opublikowano asymetryczne wersje reakcji Suzuki prowadzące do powstania chiralnych układów biarylowych [1, 3,12-16].
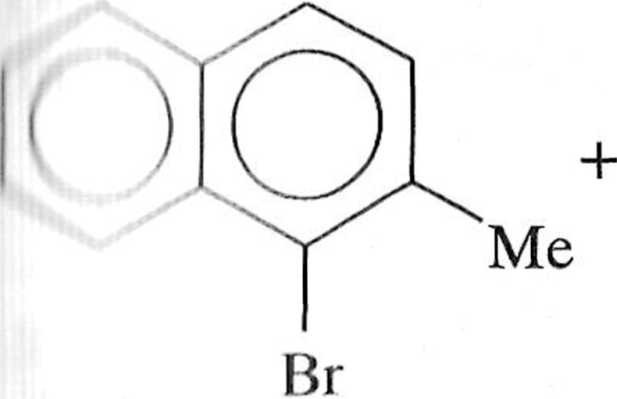
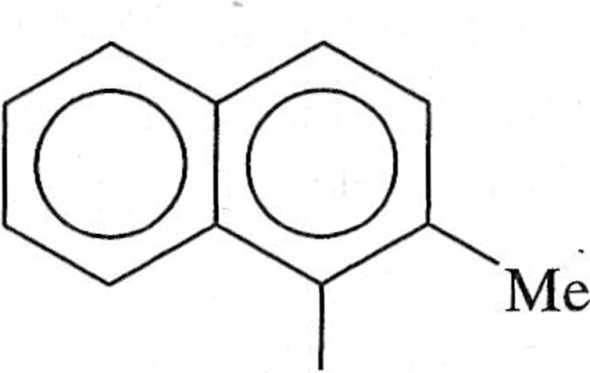
B(OH)2
Pd kat.
chiralny
ligand
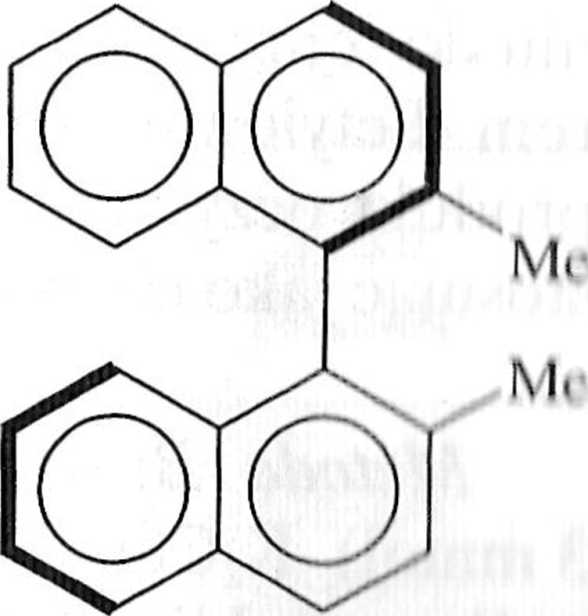
wyd. do 73% e.e. do 85%
Schemat 1.7.7


Część eksperymentalna


Ester metylowy kwasu 4-(l-naftylo)benzoesowego
(schemat 1.7.1, R = 1-naftyl, R' = 4-MeOOCC6H4, X = I)[17]
\\ |v,,lbic kulistej o pojemności 50 ml zaopatrzonej w chłodnicę zwrotną i przedmuchanej argonem umieszcza się kwas 1-naftyloboronowy (85 mg, 0,5 mmol), ,1,1,1 metylowy kwasu p-jodobenzoesowego (144 mg, 0,55 mmol) (I), bezwodny
w *
Wyszukiwarka
Podobne podstrony:
64377 S0038 (2) I Selektywne tworzenie wiqzań węgiel węgiel Zastosowanie sekwencji reakcji: tworzeni
S0038 (2) I Selektywne tworzenie wiqzań węgiel węgiel Zastosowanie sekwencji reakcji: tworzenie estr
S0041 (2) I. Selektywne tworzenie wiązań węgiel-węgiol u) [Mo] + + ■Ht, tłialkenowy proces
S0023 (2) I Selektywna tworzenie wiązań węgiel węgiel (4) 2 ( ) + Ph Nil, A />-TsOH Me toluen,
S0042 (2) I Selektywne tworzenie wiązań węgiel-węgiel ii) RCM CH CH PhH, 24 h 22 °C wyd. 90% e.e. 95
S0046 (2) I Selektywne tworzenie wiązań węgiel węgio! jącego 2-3 mg BHT. Roztwór ten wkrapla się prz
42209 S0044 (2) 1. Selektywne tworzenie wiązań węgiel-węgiul związek cykliczny i eten lub inny lotny
S0023 (2) I Selektywna tworzenie wiązań węgiel węgiel (4) 2 ( ) + Ph Nil, A />-TsOH Me toluen,
S0035 (2) 1. Selektywne tworzenie wiązań węgiel-węgiel («-Bu4NC1) kieruje reakcję w stronę termodyna
57325 S0008 (2) I. Selektywne tworzenie wiązań węgiel-węgiel lun;) cechą reakcji Dielsa-Aldera jest
więcej podobnych podstron