57325 S0008 (2)
I. Selektywne tworzenie wiązań węgiel-węgiel
lun;) cechą reakcji Dielsa-Aldera jest jej regioselektywność. W przypadku użycia niesymetrycznie podstawionych substratów zwykle tworzą się mieszaniny pioduklów, jednak reakcja wykazuje preferencję w kierunku produktów podstawionych raczej „orto/para” niż ,/neta” (schemat 1.1.2).
I. Selektywne tworzenie wiązań węgiel-węgiel

CHO
+
+
130 °C 6 h


80%
CHO
CHO
130 °C 6 h


80%
CHO
Schemat 1.1.2
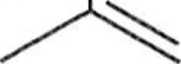
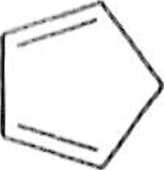
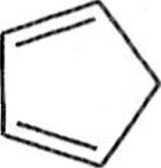
Typowymi dienami są cyklopentadien (1) lub buta-l,3-dien (2). Rolę dienu uh >)'.) lakże odgrywać niektóre związki aromatyczne, np. antracen (3) lub 2-naftol ( I). .i lakże pewne związki heterocykliczne, np. furan (5).
1


OH
O

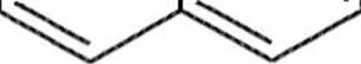
(Cyklopentadien jest zwykle generowany z dimeru (6) bezpośrednio przed użyciem poprzez krakingową destylację — jest to retro-reakcja Dielsa-Aldera (schemat 1.1.3).
A
+
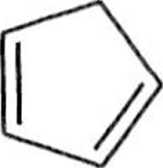
Schemat 1.1.3
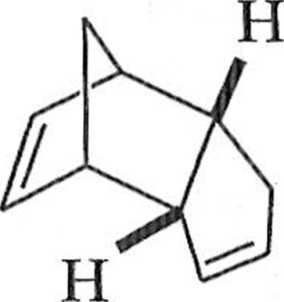
Reakcja Dielsa Aldcra z użyciem cyklopcntadienu prowadzi do utworzenia pro iluk 1 ii bicyklicznego o koitliguiat ji <'ndo (7). Ten kinetyczny deki |< l spowodo
wany drugorzędowymi oddziaływaniami orbitali. Produkt egzo (8) jcsl produktem Irrmodynamicznie bardziej stabilnym, ale tworzy się w mniejszej ilości (schemal 1.1.4).
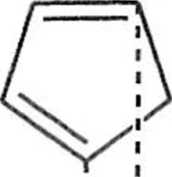
HOOC
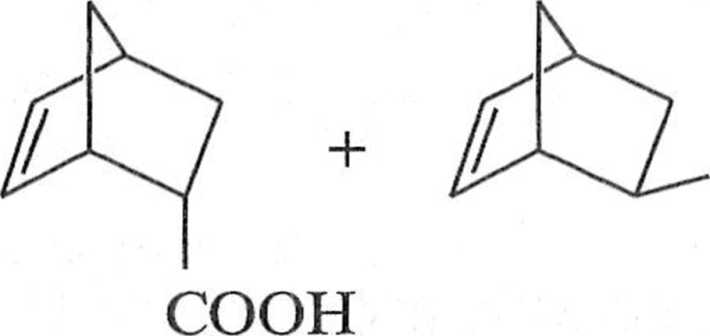
COOH
8
Schemat 1.1.4
I )icn Danishefsky’ego (9) jest bardziej reaktywny niż butadien i umożliwia wpm wadzenie grup funkcyjnych (OMe, OSiMe3) do produktu [2] (schemat 1.1.5).
OMe OMe
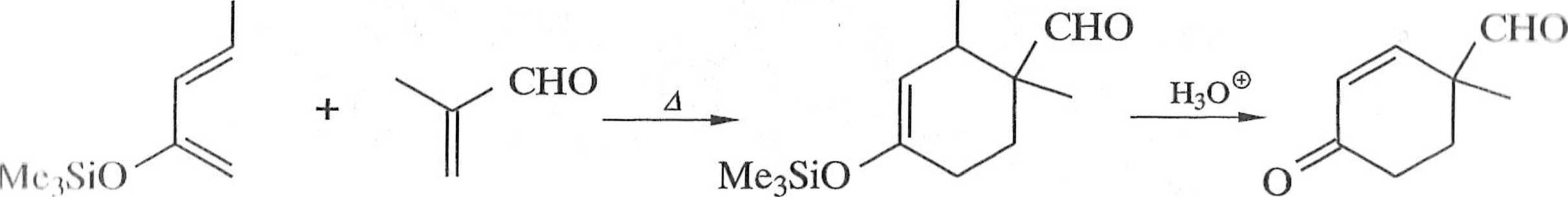
9
Schemat 1.1.5
Nietrwałe dieny, np. chinodimetany, są generowane w środowisku reakcji przez pirolizę prekursora — benzocyklobutanu (10). Chinodimetan (11) jest niezwykle uaklywnym dienem, ponieważ w reakcji Dielsa-Aldera następuje stabilizacja produktu wskutek aromatyzacji pierścienia (schemat 1.1.6).
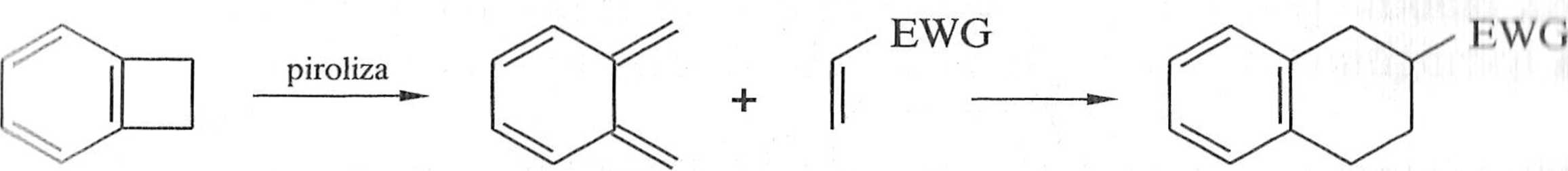
10 li
Schemat 1.1.6
.lako dienofile stosowane są alkeny sprzężone z grupami aldehydowymi, kc łonowymi, karboksylowymi, cyjanowymi, nitrowymi lub arylowymi. Dobrymi die
mii są na przykład bezwodnik maleinowy (12), maleimid (13), akrylonitryl akroleina (15). i .U i kw.r.u uetylenodikarboksylowcgo (16) i /ł-nilroslyien
nolik
(14),
(17).
Wyszukiwarka
Podobne podstrony:
S0011 (2) I Soloklywnr twor/onie wigzciń węgiel węgiel Ważnym wariantem reakcji Dielsa-Aldera jest r
70379 S0011 (2) I Soloklywnr twor/onie wigzciń węgiel węgiel Ważnym wariantem reakcji Dielsa-Aldera
70379 S0011 (2) I Soloklywnr twor/onie wigzciń węgiel węgiel Ważnym wariantem reakcji Dielsa-Aldera
S0041 (2) I. Selektywne tworzenie wiązań węgiel-węgiol u) [Mo] + + ■Ht, tłialkenowy proces
S0023 (2) I Selektywna tworzenie wiązań węgiel węgiel (4) 2 ( ) + Ph Nil, A />-TsOH Me toluen,
S0042 (2) I Selektywne tworzenie wiązań węgiel-węgiel ii) RCM CH CH PhH, 24 h 22 °C wyd. 90% e.e. 95
S0046 (2) I Selektywne tworzenie wiązań węgiel węgio! jącego 2-3 mg BHT. Roztwór ten wkrapla się prz
42209 S0044 (2) 1. Selektywne tworzenie wiązań węgiel-węgiul związek cykliczny i eten lub inny lotny
S0023 (2) I Selektywna tworzenie wiązań węgiel węgiel (4) 2 ( ) + Ph Nil, A />-TsOH Me toluen,
S0035 (2) 1. Selektywne tworzenie wiązań węgiel-węgiel («-Bu4NC1) kieruje reakcję w stronę termodyna
więcej podobnych podstron