S0035 (2)

1. Selektywne tworzenie wiązań węgiel-węgiel


(«-Bu4NC1) kieruje reakcję w stronę termodynamicznie bardziej stabilnego 2-feny-lo-2,3-dihydrofuranu 13 (schemat 1.6.10) [14].
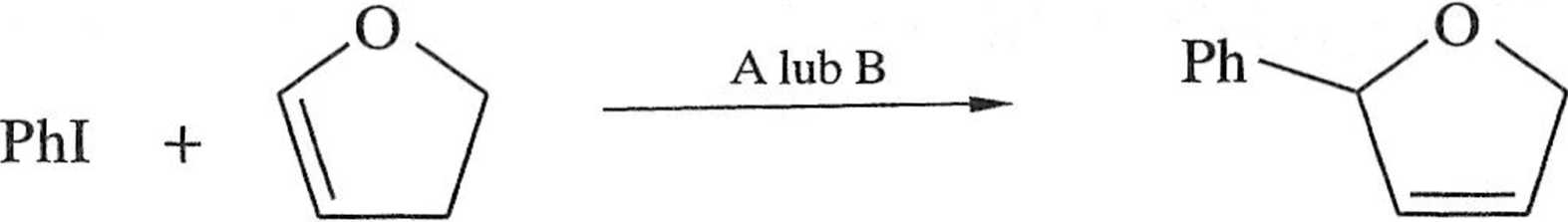
|
12 | |
|
A: Pd(OAc)2, PPh3, Ag2C03 |
98% |
|
B: Pd(OAc)2, «-Bu4NC1, NaOAc |
15% |
Schemat 1.6.10
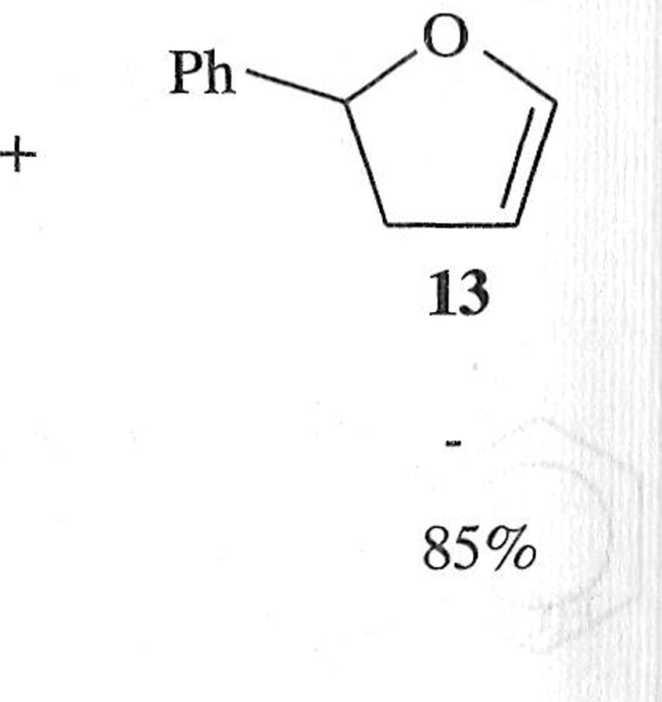

Stosując jako ligand (/?)-BINAP oraz zastępując jodobenzen triflanem fenylu, otrzymuje się z wydajnością 71% (i?)-2-fenylo-2,3-dihydrofuran (13) o nadmiarze enancjomerycznym 93% [7].

Część eksperymentalna
Pochodne kwasu cynamonowego (schemat 1.6.6) [15]
Kwas akrylowy (108 mg, 1,5 mmol) rozpuszcza się w 5 ml wody (1). Następnie dodaje się, mieszając za pomocą mieszadła magnetycznego, węglanu sodu (315 mg, 3 mmol) i chlorku palladu(II) (4 mg, 0,02 mmol) oraz 1 mmol odpowiedniego halogenku arylu (tabela 1.6.1). Całość miesza się intensywnie przez 15 minut w tern peraturze pokojowej, a następnie ogrzewa się pod chłodnicą zwrotną przez 3—1 godziny z równoczesnym intensywnym mieszaniem (2).
Po ostudzeniu zakwasza się mieszaninę 10-procentowym kwasem solnym i od' sączą wytrącony kwas, przemywając osad na sączku wodą. Surowy produkt rozpuszcza się w jak najmniejszej ilości DMSO w celu rozłożenia utworzonego kom pleksu i sączy przez zwitek waty. Produkt krystalizuje się z gorącego DMSO przez dodawanie wody lub 10-procentowego kwasu solnego. Po ostudzeniu odsącza się kryształy, przemywając je wodą, i suszy w eksykatorze próżniowym nad chlorkiem wapnia. W razie potrzeby związek należy rekrystalizować. Wydajności wynoszą 60-80% (tabela 1.6.1).
li
Chemo- i stereoselektywna synteza estru metylowego kwasu 2-acetamido-o-bromocynamonowego (schemat 1.6.8) [14] 2-Acetamidoakrylan metylu (278 mg, 1,95 mmol) należy dodać do roztworu zawierającego octan palladu(II) (20 mg, 0,00 mmol) i obromojodobcnzeii (500 mg,
Tabela 1.6.1. Halogenki aiylowe stosowane w reakcji Hecka otrzymywania pochodnych kwasu cynamonowego (schemat J .6.6)
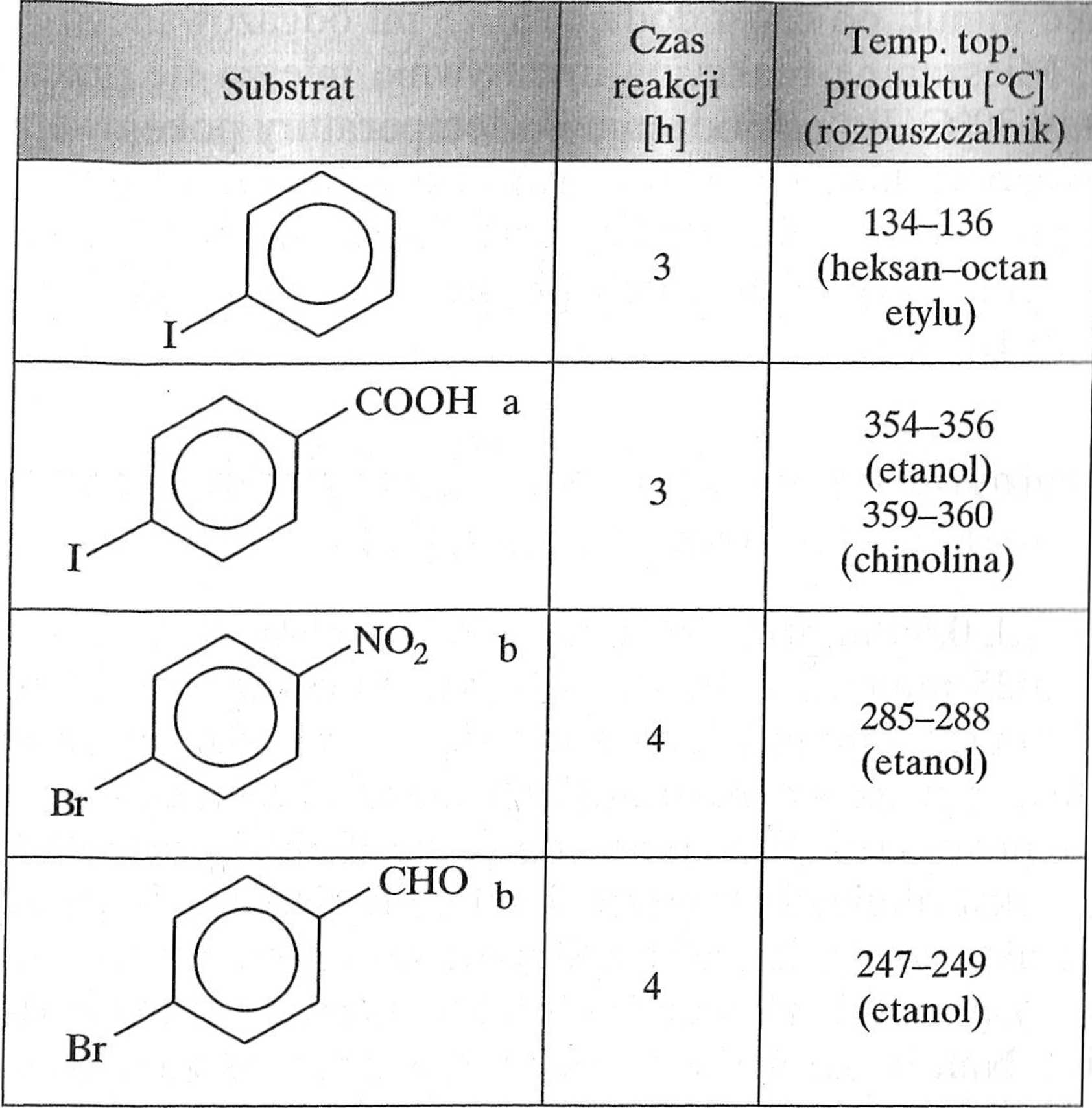
a Należy użyć 4,5 mmola węglanu sodu. b Reakcję prowadzi się w atmosferze gazu obojętnego.
I 'ii mmol) w 1 ml trietyloaminy. Całość ogrzewa się w atmosferze gazu «»l**»|*.1 u. i',o, w łaźni olejowej o temperaturze 100°C, przez 2,5 godziny przy mit s/.iniu h11c.iictycznym. Po ochłodzeniu do temperatury pokojowej rozpuszcza się * .ilu •<
• dichlorometanie (25 ml) i przemywa wodą (3 • 20 ml), po czym warslwę wodną l .irahuje się dichlorometanem (3 • 10 ml). Po połączeniu warstw organiczny* I' a y się je nad MgS04 i odparowuje. Surowy produkt krystalizuje się z mieszani n, dichlorometan-eter dietylowy. Wydajność estru etylowego kwasu 2 acclain iiln o bromocynamonowego wynosi 440 mg (84%, t.t. 142°C).
(E)-Stilben w reakcji winylowania Hecka
(schemat 1.6.1, R1 = R' = Ph, X = Br) [16]
W dwuszyjnej kolbie* o pop mnom i >1) ml, zaopatrzonej w chłodnicę zwrotu;), umieszcza się bromoben/» n t /h'» mg • mmol) (3), styren (780 mg;, 7,S mmol), h. wodny octan sodu (MHImp o I iiiiiml) i pizyiMiłowany wcześniej (nwx d[(u ner
Wyszukiwarka
Podobne podstrony:
S0041 (2) I. Selektywne tworzenie wiązań węgiel-węgiol u) [Mo] + + ■Ht, tłialkenowy proces
S0023 (2) I Selektywna tworzenie wiązań węgiel węgiel (4) 2 ( ) + Ph Nil, A />-TsOH Me toluen,
S0042 (2) I Selektywne tworzenie wiązań węgiel-węgiel ii) RCM CH CH PhH, 24 h 22 °C wyd. 90% e.e. 95
S0046 (2) I Selektywne tworzenie wiązań węgiel węgio! jącego 2-3 mg BHT. Roztwór ten wkrapla się prz
42209 S0044 (2) 1. Selektywne tworzenie wiązań węgiel-węgiul związek cykliczny i eten lub inny lotny
S0023 (2) I Selektywna tworzenie wiązań węgiel węgiel (4) 2 ( ) + Ph Nil, A />-TsOH Me toluen,
57325 S0008 (2) I. Selektywne tworzenie wiązań węgiel-węgiel lun;) cechą reakcji Dielsa-Aldera jest
83227 S0046 (2) I Selektywne tworzenie wiązań węgiel węgio! jącego 2-3 mg BHT. Roztwór ten wkrapla s
33741 S0037 (2) 1. Selektywne tworzenie wiązań węgiel-węgiel Kwasy boronowe łatwo otrzymać w wyniku
więcej podobnych podstron