33741 S0037 (2)

1. Selektywne tworzenie wiązań węgiel-węgiel

Kwasy boronowe łatwo otrzymać w wyniku częściowego utleniania związków triorganoborowych oraz, najczęściej, z odpowiednich związków Grignarda (lub litoorganicznych) i estrów kwasu borowego, a następnie hydrolizy powstałego estru boroorganicznego (schemat 1.7.2).
RX
Mg
eter
- RMgX
B(QR')3
-78°C
- RB(OR')2
h,o
0
- RB(OH)2
Schemat 1.7.2
Łatwość otrzymywania oraz stabilność kwasów aryloboronowych sprawia, że są one dobrymi substratami również w innych tego typu reakcjach, zwłaszcza w reakcjach tworzenia wiązania węgiel-heteroatom katalizowanych miedzią [2].
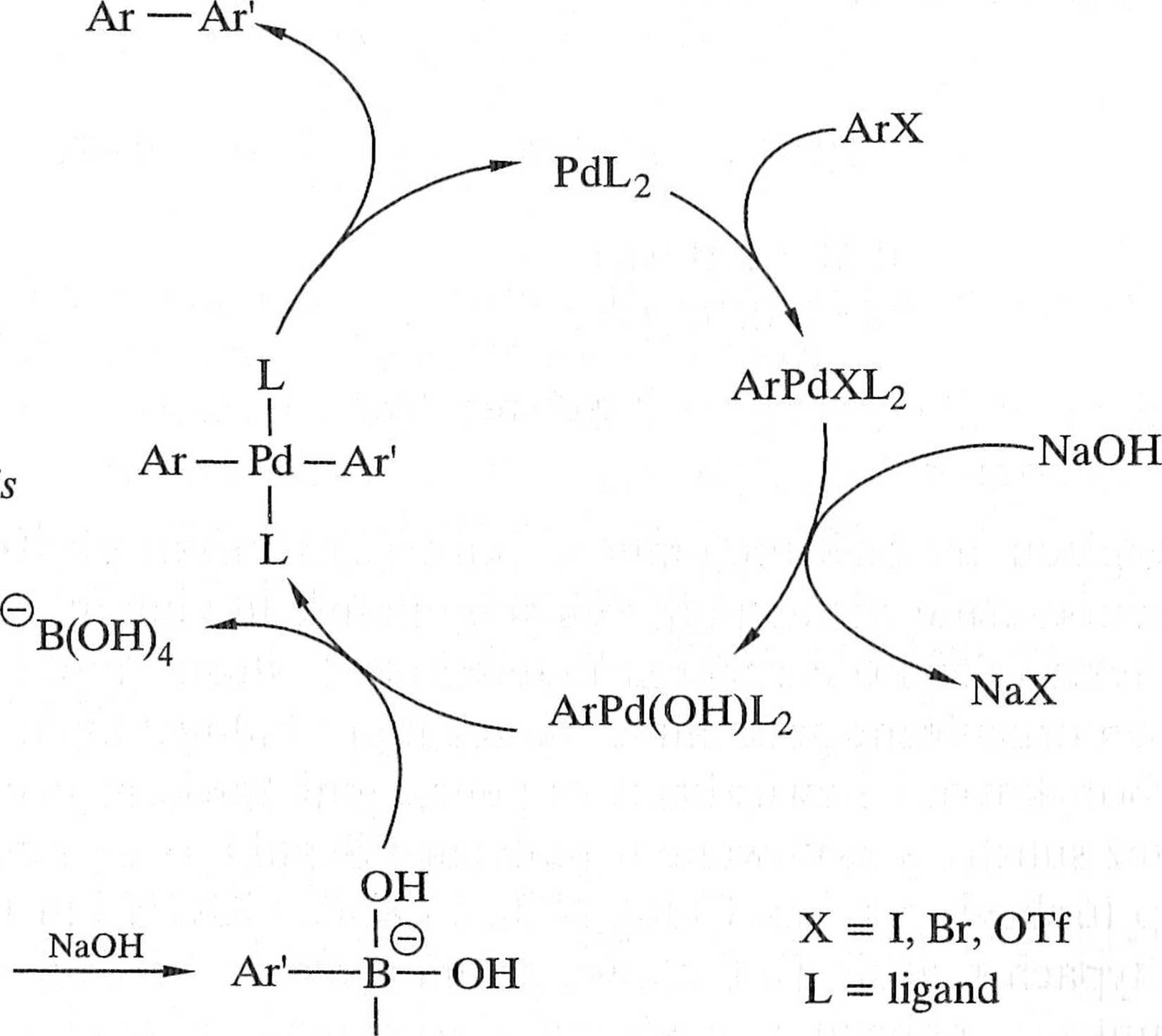
Cykl katalityczny dla reakcji Suzuki jest przedstawiony na przykładzie syntezy związku biarylowego z halogenku arylowego ArX i kwasu aryloboronowego Ar' B(OH)2 przy współudziale dwóch równoważników wodorotlenku sodu jako zasady (schemat 1.7.3).
Po etapie utleniającej addycji następuje metatetyczne wyparcie jonu halogenkowego X’ przez jon HO’ pochodzący z zasady, z wytworzeniem bardziej reaktywnego kompleksu ArPd(OH)L2. Wzrost reaktywności związany jest ze zwięk-
• •
trans i ci
Ar'B(OH)2
OH
Schemat 1.7.3
1.7. Reakcja Suzuki

/(nicm elektrofilowości palladu. Drugi równoważnik zasady jest zużywany w rc il <|i z kwasem boronowym, która daje silnie nukleofilowy boronian — subsliai wykorzystywany na etapie transmetalowania. Po przeniesieniu grupy Ar' z bom n i pallad następuje eliminacja kwasu borowego. Etapem kończącym cykl kalali t a /.ny jest redukcyjna eliminacja. Jak wynika z powyższego, zasada odgrywa waż n i iolę w procesie, a jej brak powoduje, że reakcja kończy się na etapie utlenia |ijivj addycji [1, 3-5].
Podobnie jak w reakcji Hecka najbardziej reaktywnymi halogenkami w rcak a Suzuki są jodki, a najmniej — najtańsze i najłatwiej dostępne chlorki acylowi 111 Zastosowanie nowych typów ligandów (często bardzo łatwych do otrzymaniu ■ warunkach laboratoryjnych) pozwala jednakże na przekształcenie nawet nicu il i ywnych chlorków arylowych w produkty sprzęgania [6].
Najczęściej używanym katalizatorem jest tetrakis(trifenylofosfino)pallnd(il) iii stosowane są i inne związki palladu(O) i palladu(II) — takie jak mi.no i i lilorki — oraz ich kompleksy [3, 7], Pallad osadzony na węglu jest efekty w mm katalizatorem dla wielokilogramowych syntez przemysłowych [<K|. Podoi• ni jak w przypadku reakcji Hecka jako katalizator może być stosowany m msdi(yu-acetato)-bis[o-(di-o-tolilofosfino)benzylo]dipallad(II) i inne cyklu z m kompleksy palladowe [9, 10]. Znane są ponadto liczne przykłady reakcji Su ni i katalizowanej kompleksami niklu(O) lub niklu(II) z aminami trzeciorzędu " i mi, łatwe do otrzymania w warunkach laboratoryjnych. Reakcje katalizowane olnymi od ligandów triarylofosfinowych kompleksami niklu nie dają produk i"W ubocznych, powstających w wyniku sprzęgania z grupami arylowymi ligan iltiw losfinowych [11].
Zastosowania syntetyczne reakcji Suzuki są bardzo szerokie, na przykład Mcrcoselektywna reakcja Suzuki jest często stosowana do syntezy feromoiiow iclinoidów i innych produktów naturalnych, zawierających układ sprzężonego lolienu (schemat 1.7.4) [1,12].
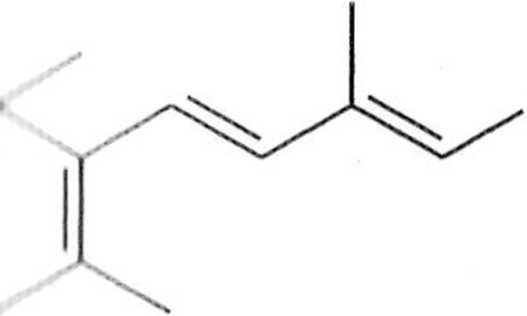
I
+
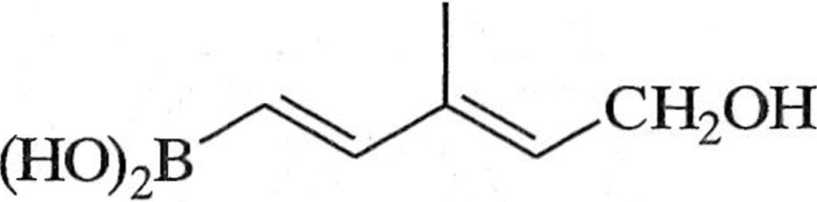
Pcl(l’l,lii),l/;n| IIOII TIN'
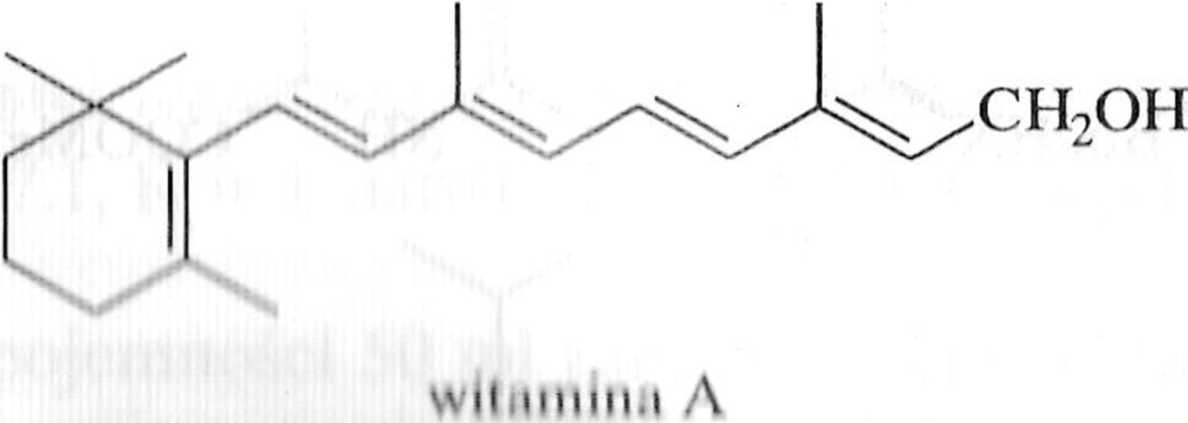
* * 4 In mil I / I
Wyszukiwarka
Podobne podstrony:
S0041 (2) I. Selektywne tworzenie wiązań węgiel-węgiol u) [Mo] + + ■Ht, tłialkenowy proces
S0023 (2) I Selektywna tworzenie wiązań węgiel węgiel (4) 2 ( ) + Ph Nil, A />-TsOH Me toluen,
S0042 (2) I Selektywne tworzenie wiązań węgiel-węgiel ii) RCM CH CH PhH, 24 h 22 °C wyd. 90% e.e. 95
S0046 (2) I Selektywne tworzenie wiązań węgiel węgio! jącego 2-3 mg BHT. Roztwór ten wkrapla się prz
42209 S0044 (2) 1. Selektywne tworzenie wiązań węgiel-węgiul związek cykliczny i eten lub inny lotny
S0023 (2) I Selektywna tworzenie wiązań węgiel węgiel (4) 2 ( ) + Ph Nil, A />-TsOH Me toluen,
S0035 (2) 1. Selektywne tworzenie wiązań węgiel-węgiel («-Bu4NC1) kieruje reakcję w stronę termodyna
57325 S0008 (2) I. Selektywne tworzenie wiązań węgiel-węgiel lun;) cechą reakcji Dielsa-Aldera jest
83227 S0046 (2) I Selektywne tworzenie wiązań węgiel węgio! jącego 2-3 mg BHT. Roztwór ten wkrapla s
83227 S0046 (2) I Selektywne tworzenie wiązań węgiel węgio! jącego 2-3 mg BHT. Roztwór ten wkrapla s
więcej podobnych podstron