70379 S0011 (2)
I Soloklywnr twor/onie wigzciń węgiel węgiel
Ważnym wariantem reakcji Dielsa-Aldera jest reakcja wewnątrzcząsteczko-wa. Jeśli dien i dienofil są połączone trój- lub czteroczłonowym łańcuchem, możliwi- jest tworzenie pochodnych hydrindanu (n = 1) lub dekaliny ( = 2) (sche-mal I.I.I3).
I Soloklywnr twor/onie wigzciń węgiel węgiel
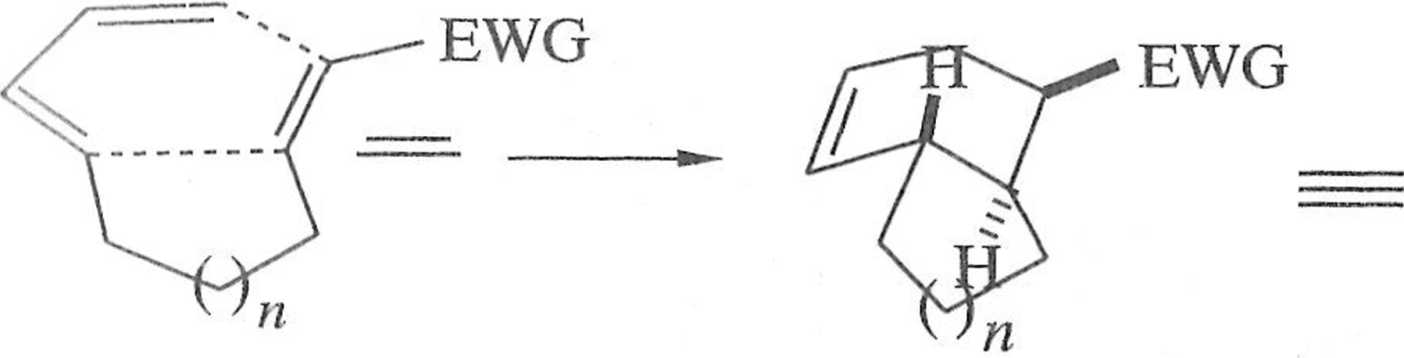
Schemat 1.1.13
EWG

)«
Pizyklad zastosowania wewnątrzcząsteczkowej reakcji Dielsa-Aldera w syn-lr/ic steroidu — pochodnej estradiolu (32) —jest podany na schemacie 1.1.14. W lej reakcji dien o strukturze chinodimetanu (31) jest generowany poprzez pi-mli/.y prekursora benzocyklobutanowego (30). Wysoka reaktywność układu chi-Modimclanu umożliwia zachodzenie reakcji cykloaddycji nawet przy braku grupy , li l imnoakceptorowej w dienofilu [18] (schemat 1.1.14).

OH

Schemat 1.1.14


I I koulu |«i O i ul su Aldora


Część eksperymentalna
Reakcja cyklopentadienu z bezwodnikiem maleinowym (schemat 1.1.10)
< Mr/y mywanie cyklopentadienu (1): W kolbie o pojemności 100 ml umieszcza iy Oicyklopentadien (20 ml) i przeprowadza destylację frakcyjną we wcześniej 111. ygotowanym zestawie do destylacji z odbieralnikiem chłodzonym lodem. Di ii» i ogrzewa się do temperatury wrzenia (około 160°C), w której następuje roz I I.ul na cyklopentadien (t.w. 40-42°C) (1). Destylację kontynuuje się, nie prze I mi zając temperatury wrzenia destylatu (42°C). W ciągu 45 minut powinno l ii edcstylować 12 ml cyklopentadienu, a po następnych 30 minutach uzyskuje się nu mai 20 ml monomeru (2). Cyklopentadien suszy się chlorkiem wapnia, doda uvin bezpośrednio przed użyciem do dalszej reakcji.
()irzymywanie bezwodnika e«rfo-norborneno~5,6-di karboksylowego (22): W kolbie Erlenmayera o pojemności 125 ml rozpuszcza się na gorąco bezwodnik maleinowy (12) (5,88 g, 60 mmol) w octanie etylu (20 ml). Następnie dodaje się li, i, ann (20 ml) i roztwór oziębia się w łaźni lodowej (część bezwodnika może nVl iyslalizować). Dodaje się bezwodnego cyklopentadienu (1) (6 ml) i całość miesza w łaźni lodowej do zakończenia egzotermicznej reakcji. Addukt wydziela w postaci bezbarwnego ciała stałego. Mieszaninę ogrzewa się do rozpuszczeni , i pozostawia do krystalizacji. Uzyskuje się 8,2 g produktu 22 (83%) w postaci ,llni>ic h płytek, t.t. 164-165°C.
Otrzymywanie bezwodnika 1,4-etano-2-okso-I ^^^-tetrahydronaftaleno-ę,]O-endo-dikarboksylowego (23)
(schemat 1.1.10) [19]
w kolbie o pojemności 25 ml, zaopatrzonej w mieszadło magnetyczne i chłód nici, v ioiuą, umieszcza się 2-naftol (4) (2,88 g, 20 mmol) i bezwodnik maleinowy (|») (2,16 g, 22 mmol) i ogrzewa się z mieszaniem w atmosferze gazu obojętnego l.i/ni o temperaturze 200±5°C przez 40 minut. Po oziębieniu do mieszaniny i u«uloktów dodaje się octanu etylu (12 ml) i pozostawia przez noc. Otrzymuje się ■ H g, (58%) krystalicznej mieszaniny adduktów endo i egzo w stosunku 1,7 : I. I, lyslalizacja frakcyjna mieszaniny z octanu etylu umożliwia otrzymanie izomeru , nilo 23 z wydajnością 1,7 g (36%), t.t. 195-196°C.
Diastereoselektywna addycja (-)-fumaranu dimentylu
do antracenu (schemat 1.1.12) [20]
I >o oziębionej (<)"(') mieszaniny AK I, ( 266 mg, 2 mmol) i antracenu (3) (180 mg, i mmol) w toluenie (6 ml) dod.ui \u, ( ) liimaranu dimentylu (26) (362 mg,
Wyszukiwarka
Podobne podstrony:
70379 S0011 (2) I Soloklywnr twor/onie wigzciń węgiel węgiel Ważnym wariantem reakcji Dielsa-Aldera
S0011 (2) I Soloklywnr twor/onie wigzciń węgiel węgiel Ważnym wariantem reakcji Dielsa-Aldera jest r
S0031 (2) I SoloklywMM twor/onio wiązań węgiel węgiel N, N
S0018 (3) I *nlok(ywno twor/onio wigzciń węgiel węgiel T;il)d;i 1.2.3. Substraly i produkty enancjo
S0031 (2) I SoloklywMM twor/onio wiązań węgiel węgiel N, N
S0031 (2) I SoloklywMM twor/onio wiązań węgiel węgiel N, N
81254 S0018 (3) I *nlok(ywno twor/onio wigzciń węgiel węgiel T;il)d;i 1.2.3. Substraly i produkty e
57325 S0008 (2) I. Selektywne tworzenie wiązań węgiel-węgiel lun;) cechą reakcji Dielsa-Aldera jest
S0020 (3) I Solnktywiut twor/.onio wiązań węgiel wygml O© u i :i o()(’( i iP(OEt), + o / K H R O II
77564 S0020 (3) I Solnktywiut twor/.onio wiązań węgiel wygml O© u i :i o()(’( i iP(OEt), + o / K H R
S0038 (2) I Selektywne tworzenie wiqzań węgiel węgiel Zastosowanie sekwencji reakcji: tworzenie estr
S0050 (2) I Solokływno twor/.onio wit/zció w<,><jul umożliwia otrzymanie podstawionych zwią
Węgiel kamienny w polsce Górnośląskie Zagłębie Węglowe jest głównym zagłębiem Polski. Za
70209 S0016 (3) 1, Selektywne Iwoi/nnio wiązań węgiel węgiel Kalalizalorami enancjoselektywnej reakc
więcej podobnych podstron