CEL ĆWICZENIA.
Celem ćwiczenia jest wyznaczanie współczynników aktywności acetonu i n-heptanu na podstawowie badań równowagi ciecz-para tego układu i obliczenie, na podstawie uzyskanych wyników współczynników A i B równań van Laara oraz nadmiarowej molowej entalpii swobodnej
OPRACOWANIE WYNIKÓW.
Na podstawie niżej podanych tabel wykreślić zależność współczynnika załamania światła od ułamka molowego acetonu nD = ƒ(T).
Tabela 1 Wykres zależności współczynnika załamania światła od ułamka molowego acetonu nD= f(xA) - wykres wykonany jest na papierze milimetrowym, dołączony do sprawozdania.
Tabela 2. Zależność prężności pary nad czystym rozpuszczalnikiem od temperatury.
Temperatura
T[°C] |
Prężność par acetonu po/l [mmHg] |
Prężność par n-heptanu poH [mmHg] |
40 |
421,5 |
92,05 |
45 |
510,5 |
|
50 |
612,5 |
140,9 |
56,3 |
760 |
|
60 |
860,6 |
208,9 |
70 |
1190 |
302,3 |
80 |
1611 |
426,6 |
90 |
2142 |
588,8 |
100 |
|
795,2 |
Wyniki pomiarów zestawione w tabeli :
Lp. |
Skład roztworu wyjściowego xA |
Temperatura wrzenia [ 0C] |
Współczynnik załamania światła nD |
Stężenie acetonu |
Stężenie n - heptanu |
|||
|
|
|
Faza ciekła |
Faza gazowa |
Faza ciekła xA |
Faza gazowa yA |
Faza ciekła xB |
Faza gazowa yB |
1 |
Aceton |
56,3 |
1,3600 |
- |
1 |
- |
- |
- |
2 |
n-heptan |
98,4 |
1,3963 |
- |
- |
- |
1 |
- |
3 |
0,1 |
83,2 |
1,3946 |
1,3813 |
0,181 |
0,677 |
0,819 |
0,323 |
4 |
0,2 |
73,1 |
1,3938 |
1,3750 |
0,268 |
0,791 |
0,732 |
0,209 |
5 |
0,4 |
63,7 |
1,3807 |
1,3672 |
0,695 |
0,905 |
0,305 |
0,095 |
6 |
0,6 |
57,3 |
1,3750 |
1,3653 |
0,791 |
0,935 |
0,209 |
0,065 |
Obliczamy współczynnik aktywności acetonu i n-heptanu korzystając ze wzoru :
![]()
p= 768 mmHg
p - ciśnienie barometryczne
poi -prężność czystych składników ( tzn. acetonu i n - heptanu ) w temperaturze wrzenia poszczególnych roztworów
yi i xi - ułamek molowy składnika i - ( tzn. odpowiednio acetonu i n- heptanu ) w fazie gazowej i ciekłej
Współczynniki aktywności dla acetonu :
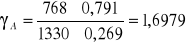
Odchylenia dodatnie od prawa Roulta (γ >1)
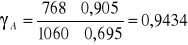
- Odchylenie ujemne od prawa Roulta (γ<1)
4. ![]()
- Odchylenie dodatnie od prawa Roulta (γ >1)
Współczynnik aktywności dla n - heptanu
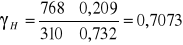
Odchylenia ujemne od prawa Roulta (γ <1)
4. ![]()
- Odchylenie dodatnie od prawa Roulta (γ >1)
Obliczanie parametrów A , B z równania van Laara :
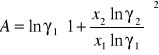
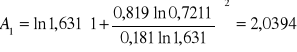
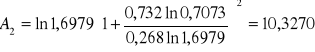
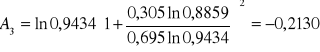
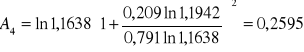
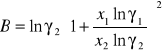
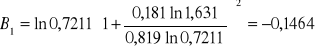
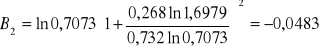
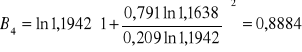
Obliczam nadmiarową molową entalpię swobodną :
T = [ K ]
R = 8, 3143 [ J/mol ⋅ K ]
![]()
GE = 8,3143⋅ 356,35 ( 0,181 ⋅ ln 1,631+ 0,819 ⋅ ln 0,7211 ) = -530,9337[ J/mol ]
GE = 8,3143 ⋅ 346,25 ( 0,268 ⋅ ln 1,6979 + 0,732 ⋅ ln 0,7073 ) = -326,4589 [ J/mol ]
GE = 8,3143 ⋅ 336,85 ( 0,695 ⋅ ln 0,9434 + 0,305 ⋅ ln 0,8859 ) = 4,1751 [ J/mol ]
GE = 8,3143 ⋅ 330,45 ( 0,791 ⋅ ln1,1638 + 0,209 ⋅ ln 1,1942 ) = 12,1885 [ J/mol ]
Wykres równowagi fazowej ciecz-para Twrz=f(xA) dla ukł.aceton- n-heptan
Temperatura |
Ułamek molowy-faza ciekła |
Ułamek molowy-faza gazowa |
T˚C |
xA |
yA |
|
|
|
57,3 |
0,791 |
0,935 |
63,7 |
0,695 |
0,905 |
73,1 |
0,268 |
0,791 |
83,2 |
0,181 |
0,677 |
Wyszukiwarka
Podobne podstrony:
sprawozdania 9 i 30, Kama cw 9 inzynieria, CEL ĆWICZENIA: Wyznaczenie oporu przepływu fazy gazowej n
HA ja na ARA cwiczenia 2010
Cel ćwiczenia
Cel ćwiczenia, UTP-ATR, Elektrotechnika i elektronika dr. Piotr Kolber, sprawozdania
Cel ćwiczenia (2)
biochemia IV, Cel ćwiczenia:
Staliwa (2), 1) Cel ćwiczenia:
BHP, BHPŚWI~1, Cel ćwiczenia
Dynamika, Cel ćwiczenia, Cel ćwiczenia
Elektrotechnika 1, Cel ćwiczenia:
Ćwiczenie C23, Ćwiczenie C23 (1), Cel ćwiczenia
Sprawozdania, automatyka spr 2, Cel ćwiczenia:
Badanie układów impulsowych, UKŁADY IMPULSOWE, 1. Cel ćwiczenia.
Hartowanie i odpuszczenie, 1) Cel ćwiczenia:
Badanie SWW, 1) Cel ćwiczenia:
Wytrzymałość materiałów, WYZNACZANIE NOŚNOŚCI GRANICZNEJ WAŁU, 1.CEL CWICZENIA
biochemia IV&V, Cel ćwiczenia:
więcej podobnych podstron