Chemia fizyczna
Technologia chemiczna, rok II
Katarzyna Łysak
Beata Król
Gr. 4, zespół A
Ćwiczenie 5
Pomiar pH metodą potencjometryczną
Data wykonania ćwiczenia: 22.05.2012r
Cel ćwiczenia
a) zapoznanie się z metodą potencjometrycznego pomiaru pH
b)sporządzenie krzywych miareczkowania kwasu mocną zasadą i słąbego kwasu mocną zasadą
c) wyznaczenie punktu równoważnikowego
d) obliczenie wartości pH w trakcie miareczkowania mocnego kwasu mocną zasadą
2. Przyrządy:
- pH-metr z elektrodą kombinowaną
- bagietka szklana
- zlewki na 100 cm3
- pipety + pompka do pipet
- biureta
- kolby miarowe na 50 cm3
3. Odczynniki:
- 0,1 i 1,0 M CH3COOH
- 0,1 i 1,0 M HCl
- 0,1 i 1,0 M NaOH
- 0,1 i 1,0 M CH3COONa
- roztwór nasycony KCl
- woda destylowana
4.Wykonanie ćwiczenia:
a) Pomiar pH roztworów buforowych:
- sporządzić po 50 cm3 roztworów, których składy przedstawiono w Tabeli 1.
W tym celu obliczyć ilość CH3COOH i CH3COONa potrzebnego do sporządzenia roztworów:
![]()
n1=n2
![]()
![]()
c1V1=c2V2
![]()
(1)
Gdzie:
V1- objętość końcowa roztworu
V2- objętość odczynnika potrzebna do sporządzenia roztworu
c1- stężenie końcowe odczynnika
c2- stężenie początkowe odczynnika
![]()
![]()
![]()
![]()
Skład roztworów buforowych
Stężenie CH3COOH c M |
Stężenie CH3COONa c0 M |
Stężenie HCl M |
Stężenie NaOH M |
0.1 |
0.1 |
|
|
0.3 |
0.1 |
|
|
0.5 |
0.1 |
|
|
0.1 |
0.1 |
0.03 |
|
0.1 |
0.1 |
|
0.03 |
- wymieszać dokładnie każdy roztwór
- umieścić elektrodę kombinowaną w roztworze w taki sposób, aby wyprowadzenie elektrody chlorosrebrowej było w nim na pewno zanurzone
- odczytać i zanotować wartość pH roztworu
b) Wyznaczenie krzywej miareczkowania:
- do zlewki na 100cm3 pobrać 40 cm3 HCl przy pomocy pipety
- napełnić biuretę 0.1 M roztworem NaOH
- zanurzyć elektrodę do roztworu kwasu, odczytać i zapisać wartość pH roztworu
- dodać z biurety 5 cm3 roztworu NaOH, zamieszać, odczytać pH itd., aż do osiągnięcia wartości pH równej 7 lub większej
-zanotować ilość zużytych mililitrów zasady, podnieść elektrodę, opłukać ja wodą destylowaną i osuszyć
- pobrać drugą porcję 40 cm3 kwasu do zlewki na 100 cm3
- zanurzyć elektrodę, odczytać i zapisać wartość pH
- dodać 5 cm3 mniej zasady od tej jaka jest niezbędna do miareczkowania kwasu, zamieszać, odczytać i zapisać wartość pH
- dodać następne 3 cm3 zasady, zamieszać, odczytać i zapisać wartość pH
- dodać 0.2 cm3 wodorotlenku, zamieszać, odczytać i zapisać wartość pH
- dodać następne 0.2 cm3 itd., aż do osiągnięcia wartości pH około 11
- podnieść elektrodę ponad górny brzeg zlewki, opłukać ją wodą destylowaną i osuszyć
Postępując analogicznie wykonać miareczkowanie CH3COOH przy pomocy NaOH.
5. Opracowanie wyników:
- obliczyć wartości pH badanych roztworów buforowych korzystając z wzoru:
![]()
(2)
Gdzie:
pK= - log(1,75∙10-5)
c - stężenie kwasu octowego
c0 - stężenie octanu sodowego
![]()
![]()
![]()
![]()
![]()
Tabela 1. Wyniki pomiarów i obliczeń dla roztworów buforowych.
Stężenie CH3COOH c M |
Stężenie CH3COONa c0 M |
Stężenie HCl M |
Stężenie NaOH M |
pH obliczone |
pH zmierzone |
0.1 |
0.1 |
|
|
4.757 |
4.90 |
0.3 |
0.1 |
|
|
4.280 |
4.40 |
0.5 |
0.1 |
|
|
4.058 |
4.15 |
0.1 |
0.1 |
0.03 |
|
4.488 |
4.56 |
0.1 |
0.1 |
|
0.03 |
5.0258 |
5.12 |
Wyniki miareczkowania potencjometrycznego roztworów HCl i CH3COOH 0,1 M roztworem NaOH zostały zestawione w poniższej tabeli:
Tabela 2. Wyniki miareczkowania kwasu solnego i octowego przy pomocy 0.1 M NaOH.
HCl |
CH3COOH |
||||
L.p. |
VNaOH cm3 |
pH |
L.p. |
VNaOH cm3 |
pH |
1 |
0 |
1,4 |
1 |
0 |
2,89 |
2 |
5 |
1,42 |
2 |
5 |
4,23 |
3 |
10 |
1,57 |
3 |
10 |
4,46 |
4 |
15 |
1,73 |
4 |
15 |
4,77 |
5 |
20 |
1,78 |
5 |
20 |
5,08 |
6 |
25 |
2,00 |
6 |
25 |
5,41 |
7 |
30 |
2,53 |
7 |
30 |
5,82 |
8 |
35 |
4,66 |
8 |
30,5 |
5,90 |
9 |
36 |
8,86 |
9 |
31 |
6,00 |
10 |
36,2 |
9,85 |
10 |
31,5 |
6,12 |
|
|
|
11 |
32 |
6,28 |
|
|
|
12 |
32,5 |
6,55 |
|
|
|
13 |
33 |
6,83 |
|
|
|
14 |
33,5 |
9,38 |
|
|
|
15 |
33,7 |
10,24 |
|
|
|
16 |
34 |
10,64 |
|
|
|
17 |
34,2 |
10,81 |
|
|
|
18 |
34,5 |
10,98 |
|
|
|
19 |
34,7 |
11,09 |
- krzywe miareczkowania potencjometrycznego roztworów HCl i CH3COOH
![]()
Wykres nr 1. Krzywa miareczkowania w układzie HCl- NaOH.
![]()
Wykres nr 2. Krzywa miareczkowania w układzie CH3COOH- NaOH.
- wyznaczenie punktu równoważnikowego przy pomocy pierwszej pochodnej
Tabela 3. Dane dla kwasu octowego
∆V [cm3] |
∆pH |
∆pH/ ∆V |
- |
- |
- |
5 |
1,34 |
0,268 |
5 |
0,23 |
0,046 |
5 |
0,31 |
0,062 |
5 |
0,31 |
0,062 |
5 |
0,33 |
0,066 |
5 |
0,41 |
0,082 |
0,5 |
0,08 |
0,16 |
0,5 |
0,1 |
0,2 |
0,5 |
0,12 |
0,24 |
0,5 |
0,16 |
0,32 |
0,5 |
0,27 |
0,54 |
0,5 |
0,28 |
0,56 |
0,5 |
2,55 |
5,1 |
0,2 |
0,86 |
4,3 |
0,3 |
0,4 |
1,333333 |
0,2 |
0,17 |
0,85 |
0,3 |
0,17 |
0,566667 |
Na podstawie danego wykresu punkt równoważnikowy w punkcie gdzie
delta pH/ delta V= 5,1 ; V NaOH = 33,5 cm3 ; pH = 9,38
Tabela 4. Dane dla kwasu solnego
∆V [cm3] |
∆pH |
∆pH/ ∆V |
- |
- |
- |
5 |
0 |
0 |
5 |
0,15 |
0,03 |
5 |
0,16 |
0,032 |
5 |
0,05 |
0,01 |
5 |
0,22 |
0,044 |
5 |
0,53 |
0,106 |
5 |
2,13 |
0,426 |
1 |
4,2 |
4,2 |
0,2 |
0,99 |
4,95 |
Na podstawie danego wykresu punkt równoważnikowy w punkcie gdzie
delta pH/ delta V= 4,95 ; V NaOH = 36,2 cm3 ; pH = 9,85
- porównanie wyznaczonej wartości pH z wartością tablicową
Błąd względny = [(pHobliczone-pHzmierzone)/pHobliczone] * 100%
Tabela 5.
Nazwa substancji |
Wyznaczona wartość pH |
Wartość tablicowa pH |
Błąd względny [%] |
CH3COOH-NaOH |
9,36 |
9 |
3,85% |
HCl-NaOH |
9,85 |
7 |
28,93% |
- obliczenie wartości pH dla teoretycznej krzywej miareczkowania 0.1 M HCl przy pomocy
0.1 M NaOH
![]()
Do punktu równoważności:
n0=c0V0
![]()
nz=czVz
(3)
Gdzie:
c0- stężenie kwasu solnego
cz- stężenie zasady sodowej
V0- objętość kwasu solnego
Vz- objętość zasady sodowej
[H+] - stężenie jonów wodorowych
W punkcie równoważności:
![]()
(4)
Gdzie:
[H+] - stężenie jonów wodorowych
![]()
- iloczyn jonowy wody
![]()
Po przekroczeniu punktu równoważności:
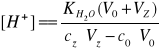
(5)
Gdzie:
[H+] - stężenie jonów wodorowych
c0- stężenie kwasu solnego
cz- stężenie zasady sodowej
V0- objętość kwasu solnego
Vz- objętość zasady sodowej
![]()
- iloczyn jonowy wody
![]()
(6)
Gdzie:
[H+] - stężenie jonów wodorowych
Tabela 6. Wyniki obliczeń do sporządzenia teoretycznej krzywej miareczkowania mocnego kwasu mocną zasadą.
VNaOH
|
Stężenie H+ mol/dm3 |
pH |
0 |
0,1 |
1,0 |
10 |
0,06 |
1,2 |
15 |
0,045455 |
1,3 |
20 |
0,033333 |
1,5 |
25 |
0,023077 |
1,6 |
30 |
0,014286 |
1,8 |
35 |
0,006667 |
2,2 |
36 |
0,005263 |
2,3 |
36,5 |
0,004575 |
2,3 |
37 |
0,003896 |
2,4 |
37,5 |
0,003226 |
2,5 |
37,7 |
0,00296 |
2,5 |
37,9 |
0,002696 |
2,6 |
38,1 |
0,002433 |
2,6 |
38,3 |
0,002171 |
2,7 |
38,5 |
0,001911 |
2,7 |
38,7 |
0,001652 |
2,8 |
38,9 |
0,001394 |
2,9 |
39,1 |
0,001138 |
2,9 |
39,3 |
0,000883 |
3,1 |
39,5 |
0,000629 |
3,2 |
39,7 |
0,000376 |
3,4 |
39,9 |
0,000125 |
3,9 |
39,95 |
|
4,2 |
40,05 |
|
9,8 |
40,1 |
|
10,1 |
40,3 |
|
10,6 |
40,5 |
|
10,8 |
40,7 |
|
10,9 |
40,9 |
|
11,0 |
41,1 |
|
11,1 |
41,3 |
|
11,2 |
Teoretyczny wykres miareczkowania mocnego kwasu mocna zasadą.
- obliczyć wartości pH dla teoretycznej krzywej miareczkowania 0.1 M CH3COOH przy pomocy 0.1 M NaOH
![]()
![]()
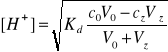
(7)
Gdzie:
ck- stężenie kwasu octowego
c0- początkowe stężenie kwasu octowego
cz- stężenie zasady sodowej
V0- objętość kwasu octowego
Vz- objętość zasady sodowej
Kd- stała dysocjacji kwasu octowego równa 1,75∙10-5
[H+] - stężenie jonów wodorowych
W punkcie równoważności:
![]()
(8)
Gdzie:
[H+] - stężenie jonów wodorowych
![]()
- iloczyn jonowy wody
![]()
Po przekroczeniu punktu równoważności:
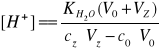
(9)
Gdzie:
[H+] - stężenie jonów wodorowych
c0- stężenie kwasu solnego
cz- stężenie zasady sodowej
V0- objętość kwasu solnego
Vz- objętość zasady sodowej
![]()
- iloczyn jonowy wody
![]()
(10)
Gdzie:
[H+] - stężenie jonów wodorowych
Tabela 7. Wyniki obliczeń do sporządzenia teoretycznej krzywej miareczkowania słabego kwasu mocną zasadą.
VNaOH
|
Stężenie H+ mol/dm3 |
pH |
0 |
0,001323 |
2,9 |
10 |
0,001025 |
3,0 |
15 |
0,000892 |
3,0 |
20 |
0,000764 |
3,1 |
25 |
0,000635 |
3,2 |
26 |
0,000609 |
3,2 |
27 |
0,000583 |
3,2 |
28 |
0,000556 |
3,3 |
29 |
0,000528 |
3,3 |
30 |
0,0005 |
3,3 |
31 |
0,000471 |
3,3 |
32 |
0,000441 |
3,4 |
33 |
0,00041 |
3,4 |
34 |
0,000377 |
3,4 |
35 |
0,000342 |
3,5 |
36 |
0,000303 |
3,5 |
37 |
0,000261 |
3,6 |
38 |
0,000212 |
3,7 |
38,2 |
0,000201 |
3,7 |
38,4 |
0,000189 |
3,7 |
38,6 |
0,000177 |
3,8 |
38,8 |
0,000163 |
3,8 |
39 |
0,000149 |
3,8 |
39,2 |
0,000133 |
3,9 |
39,4 |
0,000115 |
3,9 |
39,6 |
|
4,0 |
39,8 |
|
4,2 |
40,2 |
|
10,4 |
40,4 |
|
10,7 |
40,6 |
|
10,9 |
40,8 |
|
11,0 |
41 |
|
11,1 |
41,2 |
|
11,2 |
41,6 |
|
11,3 |
42 |
|
11,4 |
Teoretyczny wykres miareczkowania słabego kwasu mocną zasadą.
Wnioski i uwagi:
Podczas przeprowadzania przez nas doświadczenia można zauważyć, że przy miareczkowaniu mocnego kwasu (HCl) mocną zasadą (NaOH) o stężeniach 0,1 mol/dm3 w miarę dodawania NaOH stężenie jonów wodorowych maleje na wskutek łączenia się jonów H+ oraz OH- w cząsteczki wody. Wynikiem tego jest wzrost pH roztworu . Na początku zwiększenie wartości pH jest bardzo powolne, jednak przy dalszym wprowadzaniu zasady do roztworu zmiana pH jest coraz szybsza, aż do osiągnięcia punktu równoważnikowego, w którym następuje całkowite zobojętnienie roztworu. Teoretyczna wartość pH dla zobojętnienia wynosi 7, z otrzymanych wyników doświadczalnych na podstawie pierwszej pochodnej punkt równoważnikowy przypadł na wartość pH≈9,85
Końcowym etapem ćwiczenia było porównanie wartości teoretycznych i doświadczalnych dla miareczkowania mocnego kwasu mocną zasadą. Wartości te są sobie bliskie, co widać w tabeli 5. Świadczy to o zgodności przeprowadzonych pomiarów, należy jednak dodać, że pH-metr którym się posługiwano w ćwiczeniu był obarczony błędem pomiarowym.
Podczas miareczkowania słabego kwasu(CH3COOH) mocną zasadą (NaOH) powstaje sprzężona z nim słaba zasada według reakcji:
CH3COOH + OH- = H2O + CH3COO-
Słaba zasada, która powstała w reakcji reaguje z wodą:
CH3COO- + H2O = CH3COOH + OH-
Wynika z tego ,że odczyn roztworu w punkcie równoważnikowym jest zasadowy. Zmniejszenie stężenia jonów wodorowych podczas miareczkowania jest spowodowane nie tylko zobojętnianiem tych jonów jonami OH- , lecz także cofaniem się dysocjacji kwasu octowego, w miarę zwiększania się stężenia anionów CH3COO-. Do mierzenia wartości pH przy takim miareczkowaniu najlepszymi wskaźnikami są:
- fenoloftaleina o zakresie pH 8,1-10
- błękit tymolowy o zakresie pH 8-9,6
a więc prawie dokładnie w obrębie skoku krzywej miareczkowania. Z wykresu wynika, że punkt równoważnikowy doświadczalny przypada na wartość pH≈9,38
Przyczyny rozbieżności wynikają z następujących czynników:
-niedokładności odmierzanych objętości roztworów
-wieku elektrody kombinowanej
-skończonej dokładności pomiaru pH-metru
Błędy pomiarowe:
Pipety : 5 cm3 ± 0,05 cm3
10 cm3 ± 0,04 cm3
20 cm3 ± 0,06 cm3
25 cm3 ± 0,1 cm3
Biureta: ± 0,1 cm3
pH-metr ± 0,5
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()