Cel ćwiczenia:
Celem ćwiczenia jest przebadanie zależności stałej równowagi reakcji rozpuszczania soli w roztworze wodnym:
![]()
Obliczenia:
przewodnictwo właściwe soli:
![]()
Temperatura [0C] |
Przewodnictwo zmierzone wody destylowanej κw [µS] |
Przewodnictwo zmierzone soli CaCO3 κ [µS] |
Przewodnictwo właściwe soli CaCO3 κr [µS] |
25 |
22,8 |
85,92 |
63,12 |
35 |
22,31 |
88,81 |
66,5 |
45 |
21,4 |
92,16 |
70,76 |
55 |
20,44 |
94,59 |
74,15 |
65 |
19,84 |
97,77 |
77,93 |
75 |
19,16 |
101,03 |
81,87 |
stężenie jonów w roztworze:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Dla 250C:
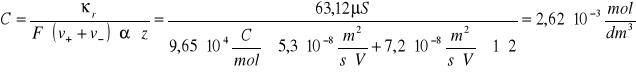
Temperatura [0C] |
Przewodnictwo właściwe soli CaCO3 κr [µS] |
Stężenie jonów w roztworze C [·10-3mol/dm3] |
25 |
63,12 |
2,62 |
35 |
66,5 |
2,76 |
45 |
70,76 |
2,93 |
55 |
74,15 |
3,07 |
65 |
77,93 |
3,23 |
75 |
81,87 |
3,39 |
iloczyn rozpuszczalności:
![]()
Temperatura [0C] |
Stężenie jonów w roztworze C [·10-3mol/dm3] |
Iloczyn rozpuszczalności IR |
Log10(IR) |
1/T |
25 |
2,62 |
6,8644 |
0,836603 |
0,04 |
35 |
2,76 |
7,6176 |
0,881818 |
0,028571 |
45 |
2,93 |
8,5849 |
0,933735 |
0,022222 |
55 |
3,07 |
9,4249 |
0,974277 |
0,018182 |
65 |
3,23 |
10,4329 |
1,018405 |
0,015385 |
75 |
3,39 |
11,4921 |
1,060399 |
0,013333 |
współczynniki wyznaczone za pomocą regresji liniowej:
a=-8,076
b=1,136
ciepło standardowe reakcji:
![]()
y=ax+b
y= lgIr
x=1/T
![]()
b=const.
R=8,31 J/molK
![]()
ΔH°=-(-8,076)∙2,303∙8,31=154,56 J
Wykresy:
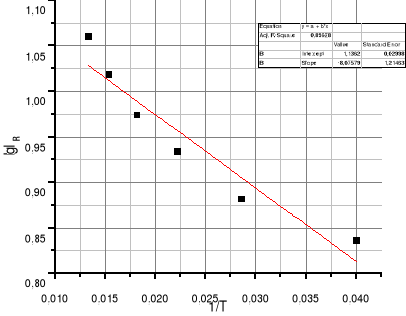
Wnioski:
Podczas ćwiczenie należało zbadać zależności stałej równowagi reakcji rozpuszczania soli w roztworze wodnym. W tym celu zmierzono przewodnictwo wody destylowanej i soli CaCO3. Następnie obliczono przewodnictwo właściwe soli, stężenie jonów w roztworze oraz iloczyn rozpuszczalności. Na tej podstawie narysowano wykres liniowej zależności lgIR od 1/T. Za pomocą regresji liniowej obliczono współczynniki a i b. Z otrzymanych danych wyznaczono szukaną wartość ciepła standardowego reakcji ΔH˚.
Zależność stałej równowagi od temperatury opisana jest równaniem van't Hoffa. W wykonanym ćwiczeniu mamy do czynienia z reakcją endotermiczną, na co wskazuje malejący wykres lgIR=f(1/T), ΔH˚>0 oraz współczynnik a<0. Z wykresu można odczytać, że iloczyn rozpuszczalności soli maleje wraz ze wzrostem odwrotności temperatury. Innymi słowy, wraz ze wzrostem temperatury, rośnie też iloczyn rozpuszczalności. Z obliczeń wynika również, że zarówno przewodnictwo właściwe soli, stężenie jonów, jak i iloczyn rozpuszczalności rosną wraz ze wzrostem temperatury.
Wyszukiwarka
Podobne podstrony:
Zależność stałej równowagi reakcji od temperatury sprawozdanie, Politechnika Poznańska, Laboratorium
Zależność stałej równowagi reakcji od temperatury sprawozdanie 3
Ad 8 Zależność stałej równowagi reakcji od temperatury
Ad 8 Zależność stałej równowagi reakcji od temperatury
Ad 8 Zależność stałej równowagi reakcji od temperatury
Ćw 7 Zależność stałej równowagi reakcji od temperatury
10 ZALEŻNOŚĆ STAŁEJ SZYBKOŚCI REAKCJI OD TEMPERATURY
6 Zależność stałej szybkości reakcji od temperatury
zaleznosc stalej szybkosci reakcji od temp
044 Pomiar zależności oporności metali i półprzewodników od temperatury sprawozdanie
zaleznosc stalej szybk reakcji od temp2
Badanie zależności współczynnika lepkości cieczy od temperat (2), Sprawozdania - Fizyka
zaleznosc stalej szybkosci reakcji od temp (2)
Badanie rezystywności materiałów przewodzących w zależności od temperatury aga, Politechnika Poznań
044 Pomiar zależności oporności metali i półprzewodników od temperatury sprawozdanie
zaleznosc stalej szybkości reakcji od temp
Chemia fizyczna - ćw. 7 Zależność lepkości cieczy od temperatury, Sprawozdania ATH
Pomiar zależności oporności metali i półprzewodników od temperatury, Politechnika Wrocławska, W-5 W
więcej podobnych podstron