Kolokwium z przedmiotu „Kataliza przemysłowa”
Zestaw 1
I. Działanie katalizatora polega na:
zwiększeniu szybkości reakcji chemicznej,
skierowaniu reakcji na jedną z kilku możliwych termodynamicznie dróg prowadzących do różnych produktów,
zmienianiu położenia stanu równowagi chemicznej,
obniżeniu energii aktywacji.
II. Heterogeniczna reakcja katalityczna jest procesem, składającym się z następujących etapów:
transportu substratów reakcji z wnętrza fazy gazowej do zewnętrznej powierzchni katalizatora,
dyfuzji substratów w porach katalizatora do jego powierzchni wewnętrznej (w przypadku katalizatorów porowatych),
chemisorpcji przynajmniej jednego z substratów na powierzchni katalizatora,
reakcji powierzchniowej, w której następuje przekształcenie zaadsorbowanych substratów i powstanie produktów reakcji,
desorpcji produktów z powierzchni katalizatora,
transportu produktów od wewnętrznej i zewnętrznej powierzchni katalizatora do wnętrza fazy gazowej.
Procesami natury fizycznej są etapy:
a. 1-2 |
c. 3-5 |
b. 1-3 |
d. 1-2 i 6. |
W obszarze wewnątrzkinetycznym szybkość procesu zależy od:
|
c. aktywności katalizatora, |
|
d. powierzchni właściwej ziarna |
IV. Reakcję A+Y®B+Z opisuje następujące równanie kinetyczne:
![]()
Oznacza to, że:
a. adsorpcji ulegają wszystkie substraty i produkty,
b. substancje A i B adsorbują na centrach jednego typu, a Y i Z na centrach drugiego typu,
c. substancje A, B i Z adsorbują na centrach jednego typu, a Y na centrach drugiego typu,
d. substancje A i B adsorbują na centrach jednego typu, a Z na centrach drugiego typu,
V. Zeolity i glinokrzemiany są zdolne katalizować reakcje:
a. krakingu,
b. izomeryzacji szkieletowej,
c. migracji wiązania podwójnego,
d. dehydratacji.
VI. Który z podanych związków będzie głównym produktem uwodornienia akroleiny na katalizatorach tlenkowych:
a. CH3CH2CHO |
c. CH3CH2CH2OH |
b. CH2=CHCHO |
d. CH2=CHCH2OH |
Katalizatory metaliczne oddziaływują z substratami dzięki:
|
c. centrom o charakterze kwasów Brönsteda |
|
d. centrom o charakterze zasadowym |
VIII.. Aktywator to substancja:
katalizująca reakcje
będąca trucizną katalizatora
podwyższająca aktywność, selektywność i czas życia katalizatora
zwiększająca aktywność katalizatora
IX. Reakcje krakingu katalitycznego mogą katalizować:
a. g-Al2O3 |
c. glinokrzemiany |
b. SiO2 |
d. zeolity |
Kolokwium z przedmiotu „Kataliza przemysłowa”
Zestaw 2
I. Heterogeniczna reakcja katalityczna jest procesem, składającym się z następujących etapów:
transportu substratów reakcji z wnętrza fazy gazowej do zewnętrznej powierzchni katalizatora,
dyfuzji substratów w porach katalizatora do jego powierzchni wewnętrznej (w przypadku katalizatorów porowatych),
chemisorpcji przynajmniej jednego z substratów na powierzchni katalizatora,
reakcji powierzchniowej, w której następuje przekształcenie zaadsorbowanych substratów i powstanie produktów reakcji,
desorpcji produktów z powierzchni katalizatora,
transportu produktów od wewnętrznej i zewnętrznej powierzchni katalizatora do wnętrza fazy gazowej.
Procesami natury chemicznej są etapy:
a. 2-4 |
c. 3-5 |
b. 1-3 |
d. 1-2 i 6. |
W obszarze zewnątrzdyfuzyjnym szybkość procesu zależy od:
|
c. porowatości katalizatora, |
|
d. powierzchni katalizatora. |
III. Równanie
![]()
opisuje szybkość reakcji A+Y®B. Oznacza to, że:
a. reagent A nie ulega sorpcji, |
c. produkt B nie ulega sorpcji, |
b. reagent Y nie ulega sorpcji, |
d. reagent Y i produkt B nie sorbują. |
Katalizatory na bazie tlenków metali przejściowych oddziaływają z substratami dzięki:
centrom o charakterze kwasów Lewisa |
centrom o charakterze kwasów Brönsteda |
centrom donorowo-akceptorowym |
centrom o charakterze zasadowym |
W obszarze zewnątrzkinetycznym szybkość procesu limituje:
a. szybkość reakcji na wewnętrznej powierzchni katalizatora |
c. szybkość sorpcji substratów |
b. szybkość reakcji na zewnętrznej powierzchni katalizatora |
d. szybkość dyfuzji substratów do powierzchni katalizatora |
VI. Kraking i izomeryzacja szkieletowa przebiegają na:
a. H3PO4/SiO2 |
c. zeolitach |
b. glinokrzemianach |
d. Al2O3 |
VII. Które z wymienionych katalizatorów heterogenicznych mogą mieć centra kwasowe typu Brönsteda:
a. SiO2 |
c. Al2O3 |
b. H3PO4/SiO2 |
d. zeolity |
Promotor to substancja:
a. katalizująca reakcje |
c. podwyższająca aktywność, selektywność i czas życia katalizatora |
b. będąca trucizną katalizatora |
d. zwiększająca tylko aktywność katalizatora |
IX. Który z podanych związków będzie głównym produktem uwodornienia akroleiny na katalizatorach metalicznych:
a. CH3CH2CHO |
c. CH3CH2CH2OH |
b. CH2=CHCHO |
d. CH2=CHCH2OH |
Równanie
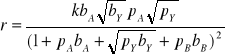
jest charkterystczne dla:
asocjatywnej reagentów,
dysocjowana adsorpcji reagentów,
braku sorpcji
adsorpcji tylko reagenta A.
8. W obszarze wewnątrzkinetycznym szybkość procesu limituje:
szybkość reakcji na wewnętrznej powierzchni katalizatora
szybkość reakcji na zewnętrznej powierzchni katalizatora
szybkość sorpcji substratów
szybkość dyfuzji substratów do powierzchni katalizatora
2. Które z wymienionych katalizatorów heterogenicznych mają centra kwasowe typu Lewisa
a. SiO2 |
c. Al2O3 |
b. H3PO4/SiO2 |
d. zeolity |
9. W obszarze zewnątrzdyfuzyjnym szybkość procesu limituje:
szybkość reakcji na wewnętrznej powierzchni katalizatora
szybkość reakcji na zewnętrznej powierzchni katalizatora
szybkość sorpcji substratów
szybkość dyfuzji substratów do powierzchni katalizatora
Wyszukiwarka
Podobne podstrony:
Kolokwium 3 1999 2000, Chemia, studia PRz, Kataliza
Kolokwium 2 1999 2000, Chemia, studia PRz, Kataliza
Spis zagadnieÅ pomocniczych do kolokwium z przedmiotu MM
Zagadnienia na kolokwium z przedmiotu EGIB, geodezja, EGIB
Wytyczne do kolokwium z przedmiotu socjologia, Socjologia
Zagadnienia do kolokwium z przedmiotu - Kopia, filozofia
Wyniki kolokwium z przedmiotu Państwa rozwijające się w stosunkach międzynarodowych 2012 2013
Zagadnienia na kolokwium z przedmiotu pedagogika ogólna, Resocjalizacja
Zagadnienia do kolokwium z przedmiotu ergonomia, studia UR, rok 1, ergonomia
Zagadnienia na kolokwium z przedmiotu- Żywność i njej zanieczyszczenia, Studia, UTP Ochrona środowis
OPRACOWANE ZAGADNIENIA DO KOLOKWIUM Z PRZEDMIOTU SOCJOLOGIA I PSYCHOLOGIA ZDROWIA
brzuch 1999 2000
definicje wybranych przedmiotów własności przemysłowej
Plan treningów FC BM Amateure 1999 2000
embriologia test 1999 2000 plus odpowiedzi, Medycyna CMUJ, Embriologia
więcej podobnych podstron