18661 S0034 (2)

1. Selektywne tworzenie wiązań węgiel-węgiel

R~
\
HO
0
R'
\
R
©
X
©
\
Pd
l
X
R
L - Pd —R I
OH
l
t
L-Pd-R
HO
0
L = rozpuszczalnik
Schemat 1.6.5
K = H, COOH, N02, CHO \ = Br, I
+
PdCl2
Na2C03
COOH
h2o7 a
COOH
Schemat 1.6.6
palladowe zawierające trifenylofosfinę nie są stosowane. Zastąpienie trifenylo astmy tri(o-tolilo)fosfiną powoduje powstanie dimerycznego, cyklicznego trans (li(//-acetato)-bis[o-(di-o-tolilofosfino)benzylo]dipalladu(II)* 7, w roztworze po /.ostającego w równowadze ze swoim monomerem 8 (schemat 1.6.7). Kompleks 7 |cs! termicznie stabilny aż do 250°C i może być regenerowany z małą stratą reak
lywności [2, 10, 11].
IM(OAc).
I*(<> lolilK
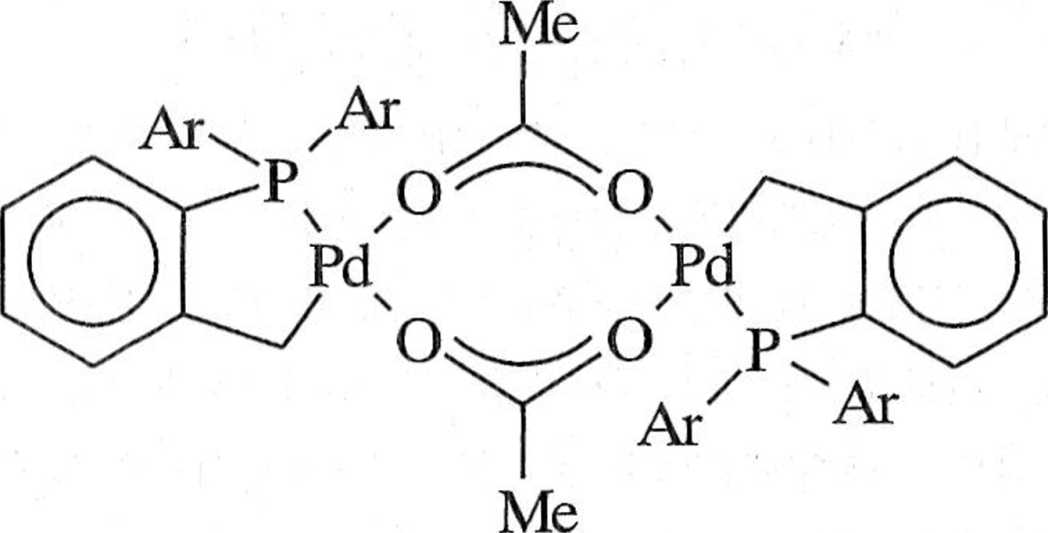
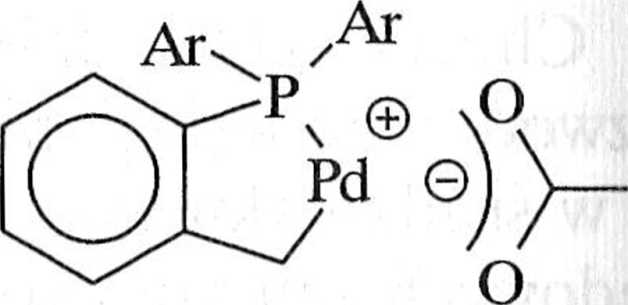
I
8
Ai ntolil
Schemat 1.6.7
Icsl In rniklywna Im nt;t kompleksu, ul lenia ji)cu sit; w wyml u mI«I\ - p hI i m *1 i I .t do IM(IV),
W przypadku obecności dwóch różnych chlorowców w cząsteczce elekt roi il;» i. il i iv można prowadzić chemoselektywnie (schemat 1.6.8), wykorzystując róż nu i, w reaktywności halogenów [13]:
I >> (OTf) > Br >> Cl
AcHN . „ COOM r
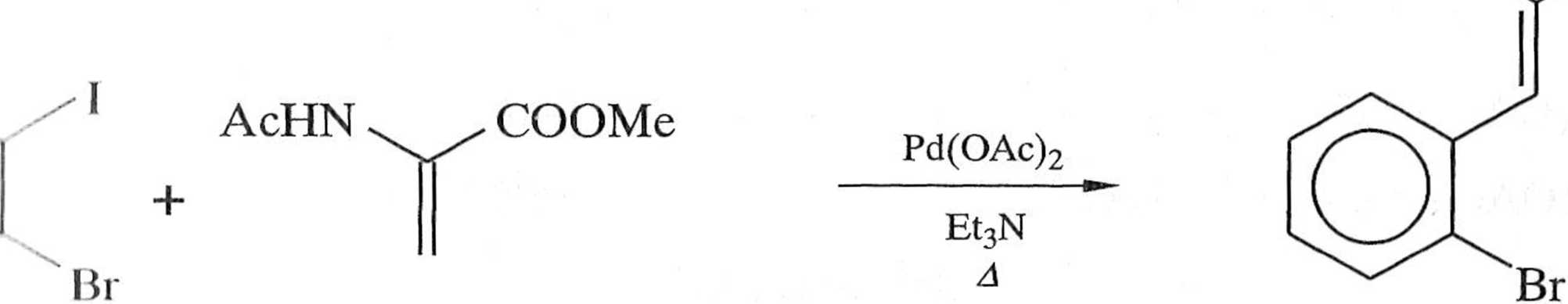
Schemat 1.6.8
Interesujące jest arylowanie cyklicznych alkenów — klucz do konstrukcji ccii liim slereogenicznych. Na przykład arylowanie cykloheksenu nie daje oczekiwani . u I arylocykloheksenu 11, ale wyłącznie 3-arylocykloheksen 10, co związane i niemożnością /^-eliminacji wodoru* w położeniu anti względem PdL„X (9, inliriii.il 1.6.9) [7].
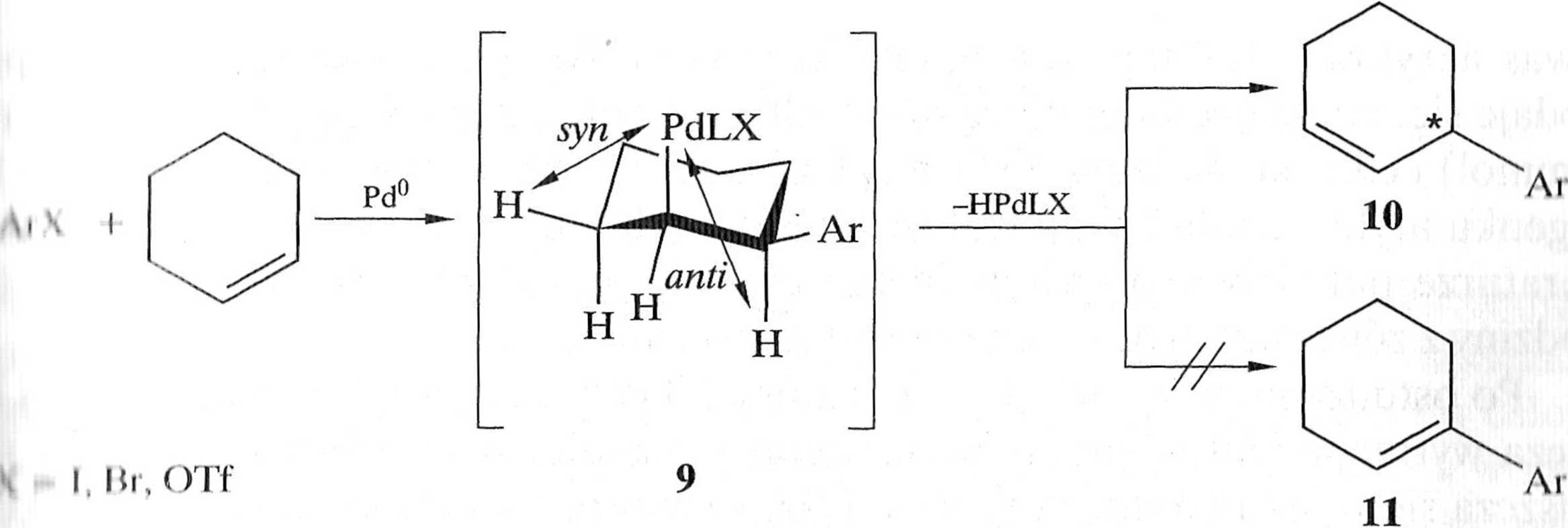
Schemat 1.6.9
Podobnie jest w przypadku arylowania 2,3-dihydrofuranu za pomocą jodo-i n i mi lii jednak rodzaj izomeru powstającego w przewadze zależy od warunki i ca kej i: dodatek soli srebra(I) owocuje wyłącznym powstawaniem 2-f’eny-|h ' ■ diliydrofuranu 12, podczas gdy użycie czwartorzędowej soli amoniowej
i < t limiiku |i tile^.a jeden / alomnw m ffi iipy IMI
W lym |»i / y |». i«I k 11 m.i/wji // rhmuuh /// wuJmiii • ini« l nu pol.ji /onyi h / .itomem wt/^la w pnlo/i ulu p " -rl- •!>
Wyszukiwarka
Podobne podstrony:
S0041 (2) I. Selektywne tworzenie wiązań węgiel-węgiol u) [Mo] + + ■Ht, tłialkenowy proces
S0023 (2) I Selektywna tworzenie wiązań węgiel węgiel (4) 2 ( ) + Ph Nil, A />-TsOH Me toluen,
S0046 (2) I Selektywne tworzenie wiązań węgiel węgio! jącego 2-3 mg BHT. Roztwór ten wkrapla się prz
42209 S0044 (2) 1. Selektywne tworzenie wiązań węgiel-węgiul związek cykliczny i eten lub inny lotny
S0023 (2) I Selektywna tworzenie wiązań węgiel węgiel (4) 2 ( ) + Ph Nil, A />-TsOH Me toluen,
S0035 (2) 1. Selektywne tworzenie wiązań węgiel-węgiel («-Bu4NC1) kieruje reakcję w stronę termodyna
57325 S0008 (2) I. Selektywne tworzenie wiązań węgiel-węgiel lun;) cechą reakcji Dielsa-Aldera jest
więcej podobnych podstron